雷公藤甲素对急性心肌梗死小鼠心肌损伤的影响*
2022-09-01姚德山王思川张振刚龚开政
姚德山,王思川,张振刚,龚开政
(扬州大学附属医院心血管内科,江苏扬州 225001)
左心室负性重构是缺血性心力衰竭发生发展的主要病理生理机制,虽然多种因素参与调控,但这一过程的基本决定因素是初始梗死的程度和心肌梗死后修复过程。先前的动物实验研究表明,急性心肌梗死(acute myocardial infarction,AMI)的病理过程主要分为三个阶段:炎症反应阶段、修复阶段和负性重构阶段[1]。早期炎症反应阶段主要通过无菌性炎症清除坏死细胞,随后抑制炎症反应,炎症消退,(肌)成纤维细胞增殖,通过瘢痕形成进行修复。研究显示,急性心肌梗死后的炎症反应的时间延长、程度过高或未及时终止,均可导致持续的组织损伤和愈合不当、瘢痕形成缺陷以及细胞丢失和收缩功能障碍,导致梗死面积扩大,心肌负性重构加重[2]。
雷公藤甲素(triptolide,TPL)是一种二萜类化合物,是中药雷公藤的主要活性成分,常用于治疗类风湿性关节炎、膜性肾病、系统性红斑狼疮和银屑病[3-4]。近来研究显示,TPL 可通过抑制脂多糖诱导的炎症反应来预防骨骼肌萎缩[5]。此外,TPL 通过抑制PDE4B/AKT/NF-κB 信号级联反应,减少巨噬细胞浸润和M1型极化,从而减弱葡聚糖硫酸钠诱导的肠道炎症反应[6]。本课题组前期研究证实,在慢性压力负荷诱导的小鼠心肌肥厚病理过程中,TPL 通过抑制NLRP3 炎症小体和下游炎症介质的释放,减轻炎症反应[7]。然而,TPL 对AMI诱导的心肌重构的作用尚未明确,本实验通过结扎小鼠左冠状动脉前降支构建AMI 模型,观察TPL 对AMI 后心肌负性重构的抑制作用,并探讨这种作用的潜在机制。
材料和方法
1 实验动物分组
取50 只SPF 级健康雄性C57BL/6J 小鼠,8~10 周龄,体重23~25 g,购自扬州大学比较医学研究院,许可证号为SCXK(苏)2017-0007。适应性饲养1周,将50 只小鼠按照随机数表法分为6 组:二甲基亚砜(dimethyl sulfoxide,DMSO)+假手术(DMSO+sham)组(n=5)、高剂量TPL+假手术[TPL(H)+sham]组(n=5)、DMSO+手术(DMSO+AMI)组(n=10)、低剂量TPL+手术[TPL(L)+AMI]组(n=10)、中剂量TPL+手术[TPL(M)+AMI]组(n=10)及高剂量TPL+手术[TPL(H)+AMI]组(n=10)。根据之前的研究[7],在造模前3 d 开始腹腔注射10µg·kg-1·d-1、30µg·kg-1·d-1和100µg·kg-1·d-1的TPL,每天一次。假手术组分别给予DMSO 和高剂量(100 µg·kg-1·d-1)TPL 作为对照,手术对照组给予DMSO作为对照。
2 主要试剂
TPL(645900)购自Sigma;即用型免疫组化试剂盒(SA1028)购自博士德生物工程有限公司;RTqPCR 试剂购自南京诺威赞生物科技有限公司;Bax抗体(ab32503)、Bcl-2 抗体(ab194583)、Ly6G 抗体(ab261916)、F4/80 抗体(ab100790)及心肌钙蛋白T(cardiac troponin T,cTnT)抗体(ab47003)购自Abcam;NF-κB Pathway Antibody Sampler Kit(9936)和β-actin抗体(12262)购自Cell Signaling Technology;白细胞介素1(interleukin 1,IL-1)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、结缔组织生长因子(connective tissue growth factor,CTGF)、I型胶原蛋白(collagen type I,Col I)、Col III、骨膜蛋白(periostin)和GAPDH 所用引物由上海生物工程有限公司设计合成,序列见表1。

表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
3 实验方法
3.1 急性心肌梗死模型构建 参照先前报道的研究方法[8],采取结扎左冠状动脉前降支构建AMI 模型。小鼠腹腔注射氯胺酮(80 mg/kg)及赛拉嗪(5 mg/kg)联合麻醉,行气管插管通气。于第4肋间隙打开胸腔暴露心脏,用8 号线于左心耳下方2 mm 处结扎左冠状动脉前降支(sham 组仅穿线不结扎),观察小鼠心电图的变化,出现ST段抬高判定手术成功。
3.2 HE 染色 在术后第1 和7 天取材,心脏组织经石蜡包埋后,切成5 µm 厚的薄片,常规脱蜡后使用HE 染色试剂盒中伊红染色液染色2 min,流水冲洗5 min,苏木素染色10 min,流水冲洗10 min,分化液染色30 s,流水冲洗2 min,返蓝液染色30 s,流水冲洗10 min,封片后观察AMI后心脏损伤。
3.3 RT-qPCR 用Trizol 法提取各组样本心肌组织的RNA,反转录成cDNA,按照说明书进行RT-qPCR检测IL-1、IL-6、TNF-α、CTGF、periostin、Col I 和ColIII 的mRNA 表达水平。RT-qPCR 的扩增程序为:95 ℃30 s;95 ℃3 s,60 ℃34 s,40 个循环。GAPDH作为内参照,使用2-ΔΔCt法计算目的基因的表达。
3.4 免疫组化检测中性粒细胞和巨噬细胞 按照免疫组化说明书进行免疫组化染色,分别使用中性粒细胞和巨噬细胞的特异性标志蛋白Ly6G 和F4/80抗体检测AMI后心肌组织中中性粒细胞和巨噬细胞的浸润情况。
3.5 Masson 三色法染色 石蜡切片常规脱蜡后,按照Masson 三色法染色试剂盒说明书进行染色,检测AMI后心肌组织胶原纤维的表达。
3.6 Western blot 取20~30 mg心肌组织,提取总蛋白,用BCA 法进行蛋白定量。通过常规SDS-PAGE分离,转膜,5%脱脂牛奶封闭,先后与Ⅰ抗(包括p-P65、P65、p-IκBα、IκBα、Bax、Bcl-2 和β-actin)杂交,洗膜后与Ⅱ抗杂交,采用化学发光液试剂盒进行发光显影,采用ImageJ软件分析蛋白条带灰度。
3.7 TUNEL 染色 在AMI 后第7 天,将心肌梗死组织进行石蜡包埋,切片后常规脱蜡,按照TUNEL 染色试剂盒说明书进行染色,同时使用cTnT 抗体进行荧光染色标记心肌细胞,使用抗荧光淬灭剂封片后,使用荧光显微镜观察心肌组织中细胞凋亡的比例。
4 统计学处理
使用SPSS 20.0 软件分析数据,数据以均数±标准误(mean±SEM)表示。两组间比较采用独立样本t检验。P<0.05认为差异有统计学意义。采用Graph-Pad Prism 8.0软件进行图表制作。
结果
1 TPL 通过抑制NF-κB 通路减轻小鼠AMI诱导的炎症反应
HE 染色结果显示(图1A),小鼠AMI 后第1 天,与DMSO+sham 组相比,DMSO+AMI 组心肌组织出现大量的细胞核固缩,细胞质溶解消失,心肌组织纹理紊乱。此外,免疫组化染色显示(图1A),心肌组织中出现大量中性粒细胞和巨噬细胞浸润;与DMSO+AMI组相比,TPL预处理可以显著减少心肌梗死区中性粒细胞和巨噬细胞的浸润(P<0.05),高剂量组效果更加显著。Western blot 结果显示(图1B),DMSO+AMI 组心肌组织中p-P65 和p-IκBα 的蛋白水平显著升高(P<0.01);而与DMSO+AMI组相比,TPL预处理可以显著降低AMI 后p-P65 和p-IκBα 蛋白水平(P<0.05)。RT-qPCR 检测结果显示(图1C~E),AMI 术后IL-1、IL-6 和TNF-α 的mRNA 表达水平显著升高(P<0.01);而与DMSO+AMI组相比,TPL预处理小鼠AMI 后IL-1、IL-6 和TNF-α 的mRNA 表达水平显著降低(P<0.05),高剂量组效果更加显著。
在小鼠AMI 后第7 天,HE 染色结果显示(图2A),心肌组织出现明显的组织紊乱,核溶解消失;而与DMSO+AMI 组相比,TPL 预处理小鼠AMI 后心肌组织损伤面积显著减小(P<0.05),高剂量组效果更加显著。Western blot 分析显示(图2B),AMI 后心肌组织中p-P65 和p-IκBα 蛋白水平显著升高,而TPL预处理小鼠AMI 后心肌组织中p-P65 和p-IκBα 蛋白水平显著降低(P<0.05)。RT-qPCR 结果显示(图2C~E),AMI后第7天炎症因子IL-1、IL-6和TNF-α 水平显著增高,而TPL 预处理小鼠AMI 后炎症因子水平显著降低(P<0.05),高剂量组效果更加显著。
2 TPL减轻小鼠AMI后心肌纤维化
Masson 染色显示(图3A),小鼠AMI 第7 天心肌组织中胶原体积分数(collagen volume fraction,CVF)显著升高;而与DMSO+AMI 组相比,TPL 预处理小鼠AMI 后CVF 显著降低(P<0.05),高剂量组效果更加显著。RT-qPCR 结果显示(图3B~3E),AMI 后心肌组织中CTGF、perisotin、Col I 和Col III 的mRNA 表达水平显著升高;而与DMSO+AMI 组相比,TPL 预处理小鼠AMI 心肌组织CTGF、periostin、Col I 和Col III 的mRNA 表达水平显著降低(P<0.05),高剂量组效果更加显著。

Figure 1.Effect of TPL pretreatment on inflammatory response in mice 24 h after AMI.A:representative images of HE staining and immunohistochemical staining for Ly6G and F4/80 in cardiac tissues(scale bar=200 µm),and Ly6G and F4/80 positive cells were counted(n=5);B:representative Western blot images and semi-quantitative analysis of the protein levels of p-P65 and p-IκBα in myocardial infarction tissue(n=3);C,D and E:the mRNA levels of IL-1,IL-6 and TNF-α in myocardial tissue were detected,and GAPDH was used as internal reference(n=5~7). Mean±SEM.**P<0.01 vs DMSO+sham group;#P<0.05,##P<0.01 DMSO+AMI group.图1 TPL预处理对小鼠急性心肌梗死后24 h炎症反应的影响

Figure 2.Effect of TPL pretreatment on inflammatory response in mice 7 d after AMI.A:the representative images of HE staining(scale bar=1 000 µm)and the quantitative results of the extent of myocardial tissue injury(n=5);B:the representative Western blot images and semi-quantitative analysis of the protein levels of p-P65 and p-IκBα in myocardial infarction tissue(n=5);C,D and E:the mRNA levels of IL-1,IL-6 and TNF-α in myocardial tissue were detected,and GAPDH was used as internal reference(n=5~10).Mean±SEM.**P<0.01 vs DMSO+sham group;#P<0.05,##P<0.01 DMSO+AMI group.图2 TPL预处理对小鼠急性心肌梗死7 d炎症反应的影响
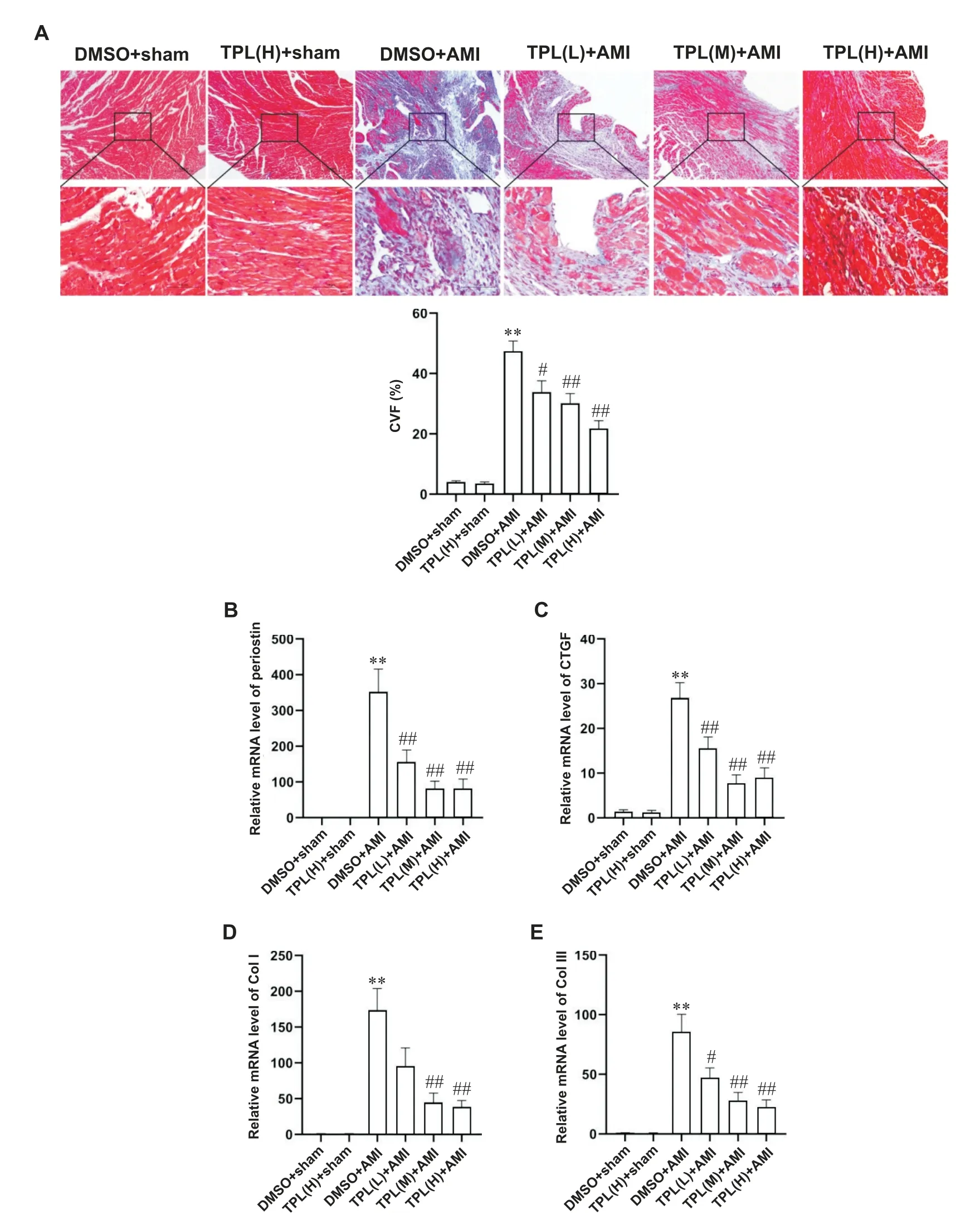
Figure 3.Pretreatment with TPL attenuated myocardial fibrosis induced by AMI.A:representative images of Masson staining(scale bar=100µm)and semi-quantitative analysis of collagen volume fraction(CVF)in Masson staining(n=5~7);B,C,D and E:the mRNA expression levels of CTGF,periostin,Col I and Col III in myocardial tissue(n=5~10). Mean±SEM.**P<0.01 vs DMSO+sham group;#P<0.05,##P<0.01 DMSO+AMI group.图3 TPL预处理减轻急性心肌梗死诱导的心肌纤维化
3 TPL减轻小鼠AMI后心肌细胞凋亡
TUNEL 染色与cTnT 染色结果显示(图4A),小鼠AMI 后心肌梗死区域出现大量凋亡的心肌细胞,而且心肌细胞边界模糊,心肌细胞溶解消失;同时也观察到有少量TUNEL 阳性染色不能完全与cTnT 染色共定位,提示心肌组织内也有少量非心肌细胞发生了细胞凋亡;而TPL 预处理小鼠AMI 后凋亡的心肌细胞显著减少(P<0.05),高剂量组效果更加显著。Western blot 分析显示(图4B),AMI 后Bax/Bcl-2 的比值显著升高;而TPL 预处理小鼠AMI 后Bax/Bcl-2 的比值显著降低(P<0.05)。
讨 论

Figure 4.Pretreatment with TPL attenuated cardiomyocyte apoptosis induced by AMI.A:the representative images of TUNEL(green)and cTnT(red)staining in myocardial tissue(scale bar=200 µm;blue showed the nuclei of total cells),and the percentage of apoptotic myocardial cells(n=5~10);B:the representative Western blot images and semi-quantitative analysis of the protein levels of Bax and Bcl-2 in myocardial tissue(n=5). Mean±SEM.**P<0.01 vs DMSO+sham group;#P<0.05,##P<0.01 DMSO+AMI group.图4 TPL预处理减轻急性心肌梗死诱导的细胞凋亡
本研究首次证明了TPL 通过调节炎症反应和减轻病理损伤来抑制小鼠AMI 诱导的心肌重构。TPL预处理通过减少心肌组织中性粒细胞和巨噬细胞浸润,抑制NF-κB通路激活,减少炎症因子IL-1、IL-6和TNF-α 的释放,从而减轻小鼠AMI 后炎症反应。此外,TPL 预处理可以显著减少细胞外基质中CTGF、periostin、Col I 和Col III 的表达,减轻心肌纤维化,并且通过降低Bax/Bcl-2 比值,减少急性缺血诱导的心肌细胞凋亡,从而抑制AMI诱导的心肌重构。
TPL 是中草药雷公藤的提取物,基于其抗炎作用被广泛应用于治疗自身免疫和炎症性疾病[3,9-10]。然而,TPL 发挥抗炎和免疫抑制的作用机制尚不明确。先前研究表明,大剂量TPL具有细胞毒性[7,11-13]。参照以往研究资料[7],本实验设置了3 个剂量梯度,并且设置高剂量(100 µg·kg-1·d-1)TPL+假手术组作为对照,证实了该高剂量的TPL 对正常心肌组织没有显著的毒性作用,排除TPL 的毒性作用对实验结果的影响。
先前的研究显示,大量炎症因子释放及中性粒细胞和巨噬细胞募集是心脏负性重构过程中的关键机制[7,14]。在CX3CR1gfp/+小鼠AMI 模型中,通过活体显微镜显示单核细胞在几分钟内即可迅速被招募到心肌梗死区域,募集的单核细胞吸引中性粒细胞聚集在梗死区,放大了炎症信号[15]。巨噬细胞通过调节CXCL2 和CXCL5 的产生,促进中性粒细胞外渗到缺血性心肌组织中,促进ROS 的产生,传播炎症反应,进一步招募单核细胞和调节巨噬细胞的极化[16]。此外,激活NF-κB 信号通路释放大量的炎症因子,可以显著的加重小鼠AMI 诱导的心肌组织损伤,加重心脏功能的恶化[14]。之前的研究显示,TPL 通过减少ROS 的产生,减轻心肌氧化应激损伤,减少TNF-α和IL-10 的表达,改善关节炎大鼠的心脏功能[17]。在糖尿病心肌病模型中,TPL 通过抑制TNF-α/VCAM-1炎症途径以及TGFβ1/α-SMA/vimentin 纤维化途径减弱炎症反应和心肌纤维化,发挥对糖尿病心肌病的保护作用[18]。本研究结果显示,在AMI 早期心肌组织中出现大量的中性粒细胞和巨噬细胞浸润,而且随着疾病的发展,心肌组织的炎症反应持续激活,心肌缺血损伤范围不断的扩大,而TPL 预处理可以显著的减少中性粒细胞和巨噬细胞浸润,并且可以持续抑制NF-κB 信号通路的激活,减少炎症因子IL-1、IL-6 和TNF-α 的产生,从而减轻小鼠AMI 诱导的炎症反应,减轻心肌组织损伤。
心肌纤维化是心肌负性重构的主要病理机制,可以导致心脏收缩和舒张功能障碍[19-21]。持续的炎症反应可以加重心肌纤维化[7]。有研究显示,在血管紧张素Ⅱ诱导的心肌肥大病理模型中,TPL 通过抑制NLRP3 炎症小体的激活,减轻心肌组织炎症反应,从而减轻心肌纤维化[22]。此外,TPL 曾被证实可减轻异丙肾上腺素和慢性压力负荷诱导的心肌纤维化[7,23]。本研究的结果显示,在AMI 病理过程中,TPL 预处理可以抑制AMI 后心肌组织细胞外基质中CTGF、periostin、Col I和Col III的mRNA 表达水平,减轻心肌纤维化,抑制小鼠AMI后心肌负性重构。
细胞凋亡是细胞死亡的主要形式之一,与多种心血管疾病密切相关[11]。在心肌梗死病理过程中,在心肌梗死区和梗死边缘区都会出现细胞凋亡,它是梗死面积大小的最终决定因素[24-25]。先前研究显示,TPL 通过调节miR-24-3p-BCL2L11-PPARs-PGC1α轴减轻氧化低密度脂蛋白诱导的细胞凋亡[26]。在氧糖剥夺实验中,TPL 可通过上调Scr/Akt/GSK3β 途径的磷酸化来抑制少突胶质细胞凋亡。Bcl-2/Bax 凋亡信号通路在内在凋亡途径中起关键作用[27]。本研究通过cTnT 标记心肌细胞,与TUNEL 染色共染,观察到TPL 可以显著减少AMI 诱导的心肌细胞凋亡;重要的是,TPL 不仅可下调促凋亡蛋白Bax 的表达,还可增加促存活蛋白Bcl-2 的表达,因此减轻AMI 诱导的心肌细胞凋亡。
总之,本研究结果提示,TPL 通过抑制NF-κB 信号通路减轻小鼠AMI 诱导的炎症反应和心肌纤维化,并且降低Bax/Bcl-2 比值,减少心肌细胞凋亡,从而抑制心肌负性重构。
