人脐带间质干细胞来源的外泌体抑制肝窦内皮细胞毛细血管样改变
2022-08-25王晨王岩金杨馥吉严永敏谭友文
王晨, 王岩金, 杨馥吉, 严永敏, 谭友文
(1. 江苏大学附属镇江三院肝病科,江苏 镇江 212005; 2. 江苏大学医学院,江苏 镇江 212013)
据统计,全球有超过13亿的肝病患者,其中我国为4亿多[1]。慢性肝病是肝病的常见形式之一,其向肝纤维化进展的病理基础之一是肝窦毛细血管化。肝窦毛细血管化是早期肝纤维化治疗的重要靶点,但目前尚缺乏理想的干预手段[2]。肝窦内皮细胞(liver sinusoidal endothelial cell, LSEC)是肝脏中占比最高的非实质性细胞,也是肝窦毛细血管化的效应细胞。LSEC通过内吞循环血液中的有毒物质参与肝脏免疫耐受,保护肝脏抵御外界损伤[3]。抑制LSEC的毛细血管样改变是靶向肝窦毛细血管化治疗慢性肝病的重要内容。
间质干细胞(mesenchymal stem cell, MSC)是一种来源于中胚层并广泛分布于全身各组织中的干细胞,具有高度的多向分化能力和自我更新能力。外泌体是一种由细胞内多胞体与胞膜融合后分泌到细胞外环境中的非可溶性膜性囊泡(30~100 nm)。外泌体携带其来源细胞的遗传信息(蛋白或mRNA、miRNA),通过受体结合、胞吞、胞膜融合等方式进入靶细胞,是细胞间遗传信息传递的载体[4]。不同细胞来源的外泌体组成不同,因此具有较复杂的生物学功能。许多类型的MSC以及MSC来源的外泌体(MSC derived exosomes, MSC-Ex)在组织损伤修复、免疫调节等方面发挥着重要作用[5-7]。近年来,MSC-Ex在肝病治疗领域引起了广泛关注[8],但其能否抑制肝窦毛细血管化尚不清楚。本研究拟观察人脐带MSC-Ex对LSEC毛细血管样改变的影响,以及对肝纤维化组织胶原沉积及促血管生成素-2(angiopietin-2, Ang-2)蛋白表达的作用。
1 材料与方法
1.1 动物、试剂及主要仪器
雌性ICR小鼠,6~8周龄,15只,体质量(26±2) g,购买并饲养于江苏大学实验动物中心, 合格证号UJS-IACUC-AP-2020033127。饲养条件:温度20~25 ℃,湿度45%~55%,通风良好,提供充足的饮食。各项实验方案均符合江苏大学动物实验中心伦理审查标准。
内皮细胞完全培养液(浙江明州生物有限公司);TNF-α、0.25% EDTA胰蛋白酶(美国Gibco公司);胎牛血清(澳大利亚Bovogen公司);DMSO(沪试公司);青霉素-链霉素双抗和引物(美国Invitrogen公司);兔抗人CD9(美国Proteintech公司);兔抗人β-肌动蛋白、CD34、Ang-2抗体(美国Bioworld公司);兔抗人CD63、TSG101、Calnexin,小鼠抗人Alix(英国Abcam公司);HRP标记的羊抗兔/小鼠二抗,BCA蛋白测定试剂盒(北京康为世纪公司);RIPA/PMSF裂解液、逆转录试剂盒(中国Vazyme公司);蛋白预染Marker(MBI公司);Matrigel基质胶(美国BD公司);SABC免疫组织化学试剂和DAB显色试剂盒(武汉博士德生物科技有限公司);曝光液(德国Millipore公司);96孔板(美国Cellster公司);25 cm2细胞培养瓶(美国Fisher公司);冻存管(美国Axygen公司);封口膜(法国Pechiney公司);截留分子量100 kD超滤离心管(中国MBI公司)。NanoDrop 1000核酸蛋白浓度检测仪(美国Thermo公司);蛋白电泳仪和电泳槽(美国Bio-Rad公司);ABI荧光定量PCR仪(美国Applied Biosystems公司);化学发光凝胶成像仪(日本GE公司);纳米颗粒跟踪分析仪(英国Malvern公司);数字切片扫描仪(匈牙利3D Histech公司);倒置荧光显微镜(日本Nikon公司)。
1.2 细胞实验
1.2.1 MSC分离培养 分离培养MSC所需脐带取自镇江市第四人民医院,涉及所有实验程序均符合江苏大学伦理委员会(2012258)批准。将无菌操作的脐带剪成约4 mm3组织块,贴壁培养在含10%胎牛血清和1%青霉素-链霉素双抗的α-MEM中,并放置于含5% CO2的37 ℃培养箱内。待细胞贴壁密度大于50%时更换营养液。该营养液中添加的胎牛血清预先在4 ℃行10 000 ×g超速离心16 h,以去除胎牛本身含有的外泌体。继续培养至细胞贴满板底,消化传代,每次消化前收集培养上清液,于-80 ℃保存。
1.2.2 LSEC培养 以含5%胎牛血清、1%青霉素-链霉素双抗和1%的内皮细胞培养添加剂的原代内皮细胞完全培养液培养LSEC,并放置于含5% CO2的37 ℃培养箱内,每2~3 d传代1次,实验所用LSEC均生长状态良好。
1.2.3 MSC-Ex提取和鉴定 将MSC培养过程收集的细胞上清液通过2 000 ×g离心去除大细胞碎片、小细胞碎片以及细胞器。装入100 kD的超滤管以3 500×g离心30 min,重复多次至液体黏稠;4 ℃,100 000×g离心60 min以沉淀外泌体;弃上清液,加入适量PBS溶解过夜;将溶解得到的MSC-Ex通过0.22 μm滤菌器灭菌,分装于数小支Ep管,于-80 ℃保存。采用透射电镜观察MSC-Ex形态,采用纳米颗粒跟踪分析仪确定MSC-Ex粒径分布和相对颗粒数,采用BCA蛋白检测试剂盒对MSC-Ex进行蛋白浓度分析,蛋白质免疫印迹检测外泌体标志物表达。
1.2.4 LSEC毛细血管化模型构建 将第1~3代生长状态良好的LSEC以2×105个/孔细胞密度接种于6孔板内。参考文献[9-10]进行预实验,显示100 ng/mL、200 ng/mL TNF-α对LSEC有较好的诱导效果。依据不同浓度的TNF-α将细胞分为0、100、200 ng/mL TNF-α组。待细胞贴壁后,用原代内皮细胞完全培养液稀释初始浓度为100 ng/μL TNF-α,使得6孔板各孔中TNF-α终浓度分别为0、100、200 ng/mL,并置于含5% CO2的37 ℃孵箱内继续培养至24 h。在MSC-Ex治疗实验中,根据TNF-α及MSC-Ex浓度的不同,分为对照组、200 ng/mL TNF-α组、200 ng/mL TNF-α+200 μg/mL MSC-Ex组和200 ng/mL TNF-α+400 μg/mL MSC-Ex组,继续培养24 h以上。
1.2.5 外泌体摄取实验 实验前一天将LSEC以2×105个/孔细胞密度种于6孔板。实验当天将40 μL外泌体(约1.5×1010/mL)与2 μL DIO染料混合,静置20 min;加入适量PBS,以3 000×g,4 ℃离心30 min洗涤未结合的染料;将DIO标记的外泌体均匀加入预先铺有LSEC的6孔板内,于5% CO2,37 ℃孵育8 h以上,荧光显微镜下观察外泌体摄取情况。
1.2.6 蛋白质免疫印迹检测外泌体标志物及LSEC中Ang-2、CD34蛋白表达 采用BCA蛋白测定试剂盒测定每个样品蛋白浓度。按照目的分子量大小配置不同浓度SDS-PAGE分离胶。蛋白质样品行SDS-PAGE(60 V电泳30 min,接着80 V电泳120 min),然后电转至硝酸纤维素膜(300 mA电转120 min);用含5%脱脂奶粉的TBST孵育1 h;加入兔抗人β-肌动蛋白(1 ∶2 000)、小鼠抗人Alix(1 ∶400)、兔抗人Calnexin、兔抗人TSG101、兔抗人CD63、兔抗人CD9,均1 ∶500稀释;兔抗人Ang-2、兔抗人CD34,均1 ∶1 000稀释,4 ℃孵育过夜;TBST清洗;加入HRP标记的羊抗小鼠或羊抗兔二抗(1 ∶2 000)于37 ℃孵育1 h;TBST清洗;用Bio-Rad成像系统曝光显影,用Image J软件对条带进行灰度值分析。
1.2.7 RNA提取和qRT-PCR检测LSEC中Ang-2、CD34 mRNA相对表达量 Trizol法提取LSEC总RNA,采用NanoDrop 1 000核酸蛋白浓度检测仪检测总RNA浓度和纯度后,按照逆转录操作程序将提取的RNA逆转录为cDNA,按照试剂盒说明书配置好20 μL反应体系:SYBR Green Mix 10 μL,上、下游引物各0.5 μL(10 μmol/L),cDNA模板2 μL,DEPC水7 μL。qRT-PCR反应条件:94 ℃预变性5 min,94 ℃变性30 s,退火1 min(Ang-2: 58 ℃,CD34: 63 ℃),72 ℃延伸30 s,共计40个循环。β-肌动蛋白为内参,独立样本均设3个复孔,统计各组2-ΔΔCt,比较mRNA相对表达。引物序列由美国Invitrogen公司合成。见表1。
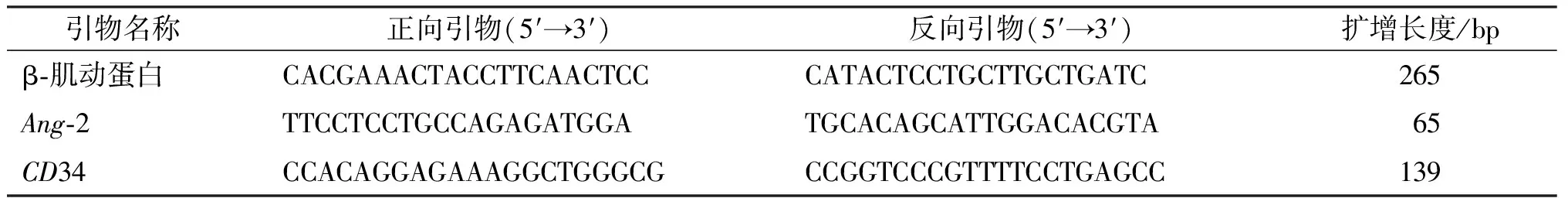
表1 引物序列
1.2.8 小管形成实验 预先在冰冷96孔板铺上100 μL基质胶(10 mg/mL),于37 ℃静置至少30 min使基质胶凝固。使用去除生长因子的原代内皮细胞完全培养液将“1.2.4”中不同组别的LSEC以3×104个细胞(100 μL)/孔接种在96孔板内,标记好组别,在5% CO2,37 ℃孵箱中培养。预实验发现2 h后出现成管现象,6 h成管结束,故每间隔1 h在倒置显微镜下观察LSEC的管腔形成能力,并进行拍摄。选取某一具有代表性的时间点,采用Image J软件分析管腔形成情况。
1.3 动物实验
1.3.1 肝纤维化模型构建 采用蛋氨酸、胆碱缺乏饲料(methionine and choline deficiency diet,MCD)喂养小鼠8周制备肝纤维化模型[11]。将小鼠随机分为3组:对照组组、MCD组、MSC-Ex组,每组5只。将250 μg MSC-Ex溶于100 μL PBS,通过尾静脉分别注射MSC-Ex(10 mg/kg)和100 μL PBS,每3 d注射1次,共注射5次。末次注射后1 d注射适量戊巴比妥对小鼠实施安乐死并收集各组小鼠肝脏组织,置于4%多聚甲醛中固定,石蜡包埋后切成4~6 μm薄片。
1.3.2 天狼猩红染色检测小鼠肝脏组织胶原沉积 肝组织切片常规脱水脱蜡;天狼猩红染色液滴染1 h,流水冲洗10 min去除切片表面染液;滴加苏木素染色液染细胞核8~10 min,流水冲洗10 min;脱水透明,用中性树脂封固并在显微镜下观察。用Image J软件分析小鼠肝脏组织中胶原沉积阳性面积百分率。
1.3.3 免疫组织化学检测小鼠肝脏组织中Ang-2蛋白表达 取小鼠肝脏组织石蜡切片于60 ℃烘箱中烘干6~8 h;切片依次置于二甲苯(15 min)、二甲苯(15 min)、100%乙醇(2 min)、100%乙醇(2 min)、95%乙醇(1 min)、95%乙醇(1 min)、80%乙醇(1 min)、70%乙醇(1 min);PBS洗3次,每次5 min;将切片浸泡于高温柠檬酸盐缓冲液30 min以修复抗原;3%过氧化氢孵育30 min以抑制内源性过氧化物酶活性;5%牛血清白蛋白封闭1 h;加入Ang-2(1 ∶200)一抗孵育过夜,阴性对照以PBS代替Ang-2抗体进行孵育;次日,各组加入生物素化二抗室温孵育30 min;SABC试剂于37 ℃孵育30 min;滴加DAB显色液;苏木精复染,并控制每组显色时间相同;脱蜡,水化,中性树脂封片,于自动扫片机下观察,进行切片图像采集。用Image J软件分析小鼠肝脏组织中目的蛋白Ang-2的阳性面积百分率。
1.4 统计学处理

2 结果
2.1 MSC-Ex鉴定
结果显示,MSC高表达Alix、Calnexin、TSG101、CD63、CD9,MSC-Ex高表达Alix、TSG101、CD63、CD9,而去MSC-Ex上清液中外泌体标志物表达阴性。透射电镜显示MSC-Ex呈典型的盘状囊泡。纳米颗粒跟踪分析仪检测结果显示,MSC-Ex平均直径为110 nm左右,提取获得的MSC-Ex颗粒浓度约为3.4×1011/mL。由此提示MSC-Ex提取成功。见图1。

A:蛋白质免疫印迹检测外泌体标志物表达;B:透射电镜检测MSC-Ex结构;C:纳米颗粒分析仪检测MSC-Ex粒径分布及浓度
2.2 TNF-α体外诱导LSEC中Ang-2、CD34的mRNA和蛋白表达
qRT-PCR结果显示,与0 ng/mL组相比,100 ng/mL和200 ng/mL TNF-α组Ang-2 mRNA、CD34 mRNA相对表达水平明显升高(P均<0.05)。与100 ng/mL TNF-α相比,200 ng/mL TNF-α组的Ang-2 mRNA相对表达水平明显升高(t=26.92,P<0.05),CD34 mRNA差异无统计学意义。
蛋白质免疫印迹结果显示,与0 ng/mL组相比,100 ng/mL和200 ng/mL TNF-α组Ang-2、CD34蛋白表达明显增加(P均<0.05)。100 ng/mL和200 ng/mL TNF-α组间Ang-2和CD34蛋白表达差异无统计学意义。由此提示,TNF-α可成功诱导LSEC毛细血管样改变。结合上述结果,选择200 ng/mL TNF-α作为诱导LSEC毛细血管样改变的合适浓度。见图2。
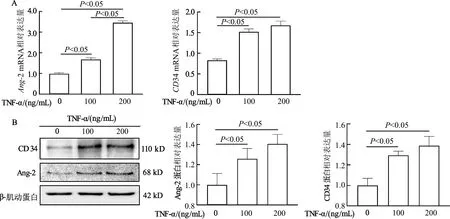
A:qRT-PCR检测LSEC中Ang-2、CD34 mRNA表达;B:蛋白质免疫印迹检测LSEC中Ang-2、CD34蛋白表达
2.3 TNF-α体外诱导LSEC管腔形成
结果表明,成管4 h时,各组开始出现较明显的成管现象,因此选择4 h作为成管试验的观察时间节点。与0 ng/mL TNF-α组相比,100、200 ng/mL TNF-α组管分支数、网眼数、结点数显著增加(P均<0.01)。与100 ng/mL TNF-α组相比,200 ng/mL TNF-α组管腔分支数、网眼数、结点数明显增加(P均<0.01)。由此提示,TNF-α可成功诱导LSEC体外管腔形成,并且选择200 ng/mL TNF-α作为诱导LSEC体外管形成的合适浓度。见图3。
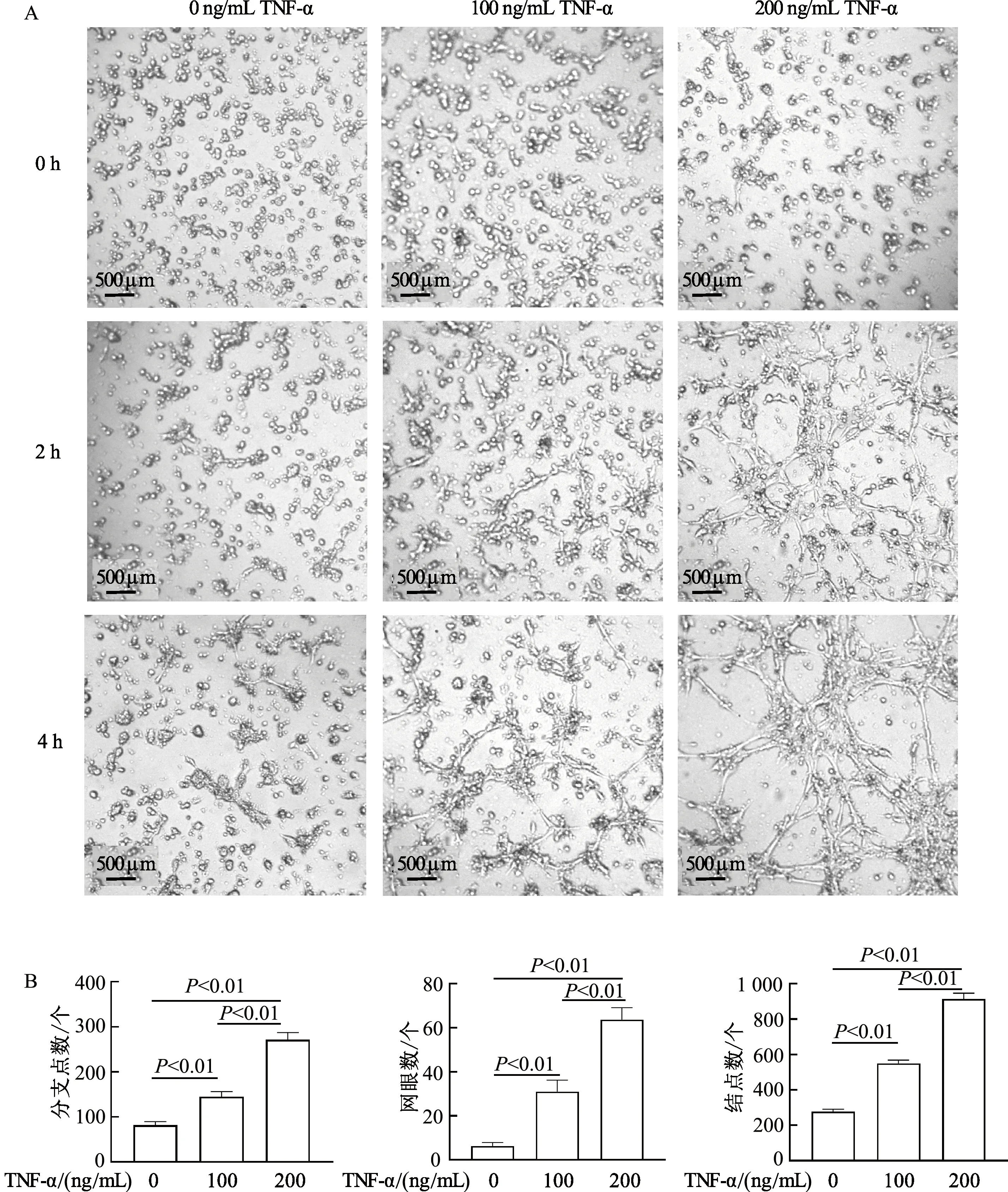
A:倒置显微镜下观察LSEC管腔形成能力;B:成管4 h时小管形成能力的相对定量分析
2.4 MSC-Ex体外抑制LSEC中Ang-2、CD34 mRNA表达
结果显示,MSC-Ex与LSEC共培养8 h后可被LSEC摄取,MSC-Ex定位于LSEC胞质和胞核周围,如图4A中箭头所示。qRT-PCR检测结果显示,与对照组相比,200 ng/mL TNF-α组Ang-2和CD34 mRNA表达明显上升(P均<0.01)。相较于200 ng/mL TNF-α组,200 ng/mL TNF-α+200 μg/mL MSC-Ex组和200 ng/mL TNF-α+400 μg/mL MSC-Ex组Ang-2、CD34 mRNA表达显著降低(P<0.01或<0.05)。而与200 ng/mL TNF-α+200 μg/mL MSC-Ex组相比,200 ng/mL TNF-α+400 μg/mL MSC-Ex组Ang-2以及CD34 mRNA表达无显著差异。见图4。
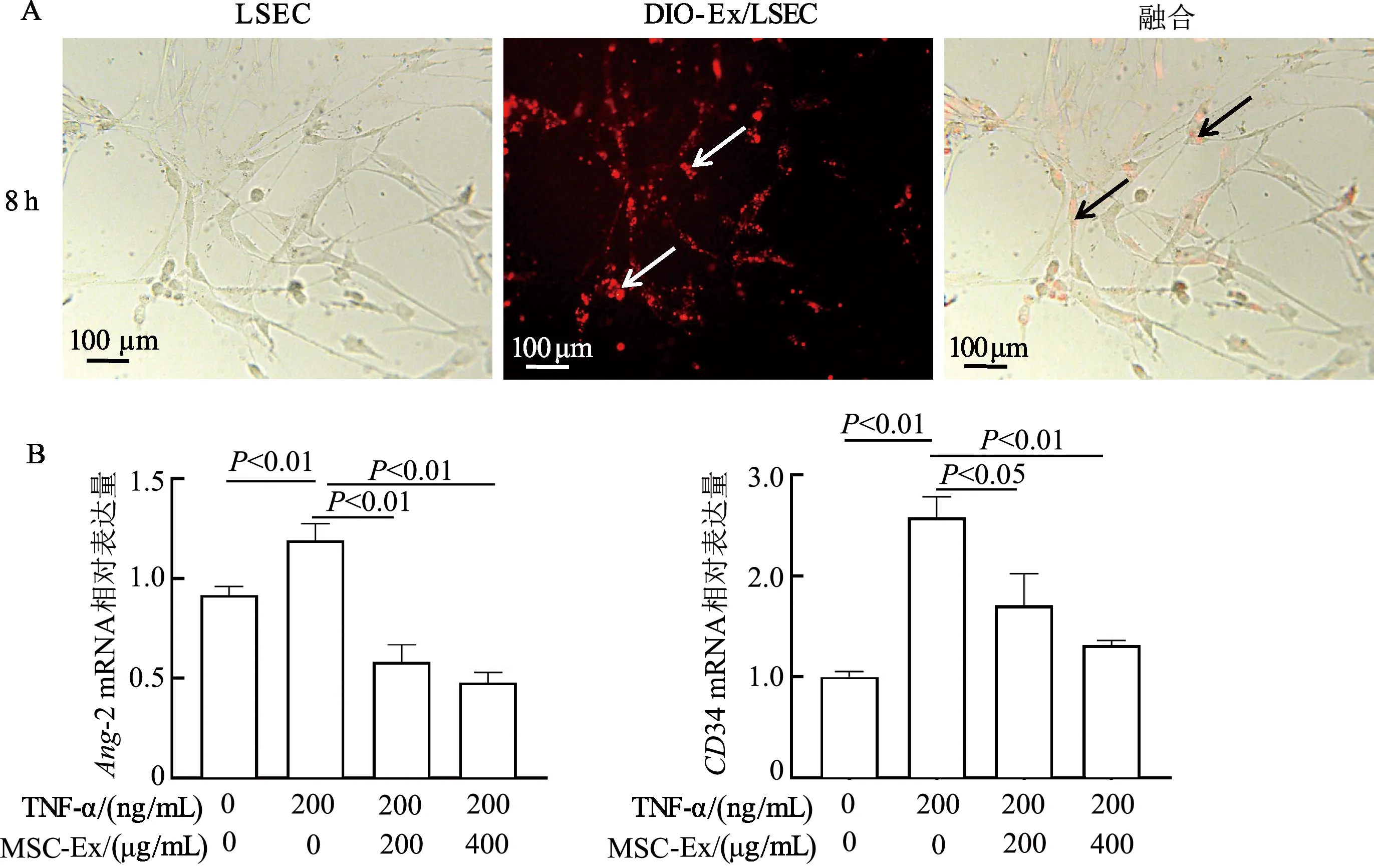
A:红色荧光染料DIO显示MSC-Ex在LSEC内定位;B:qRT-PCR检测LSEC中Ang-2、CD34 mRNA表达
2.5 MSC-Ex抑制LSEC管腔形成
结果表明,成管4 h时各组出现明显成管现象,因此选择4 h作为观察统计的时间节点。相较于对照组,200 ng/mL TNF-α显著促进LSEC管腔形成,管的分支数、网眼数、结点数均明显增加(P均<0.01),这与“2.3”的结果一致。相较于200 ng/mL TNF-α组,200 ng/mL TNF-α+200 μg/mL MSC-Ex组和200 ng/mL TNF-α+400 μg/mL MSC-Ex组4 h管腔形成的分支数、网眼数以及结点数明显下降(P均<0.01)。与200 μg/mL MSC-Ex组相比,400 μg/mL MSC-Ex对TNF-α诱导的LSEC管形成的分支数以及结点数的抑制作用更明显(P均<0.05),LSEC网眼数无显著差异。由此提示MSC-Ex可显著抑制TNF-α诱导的LSEC体外管腔形成。见图5。
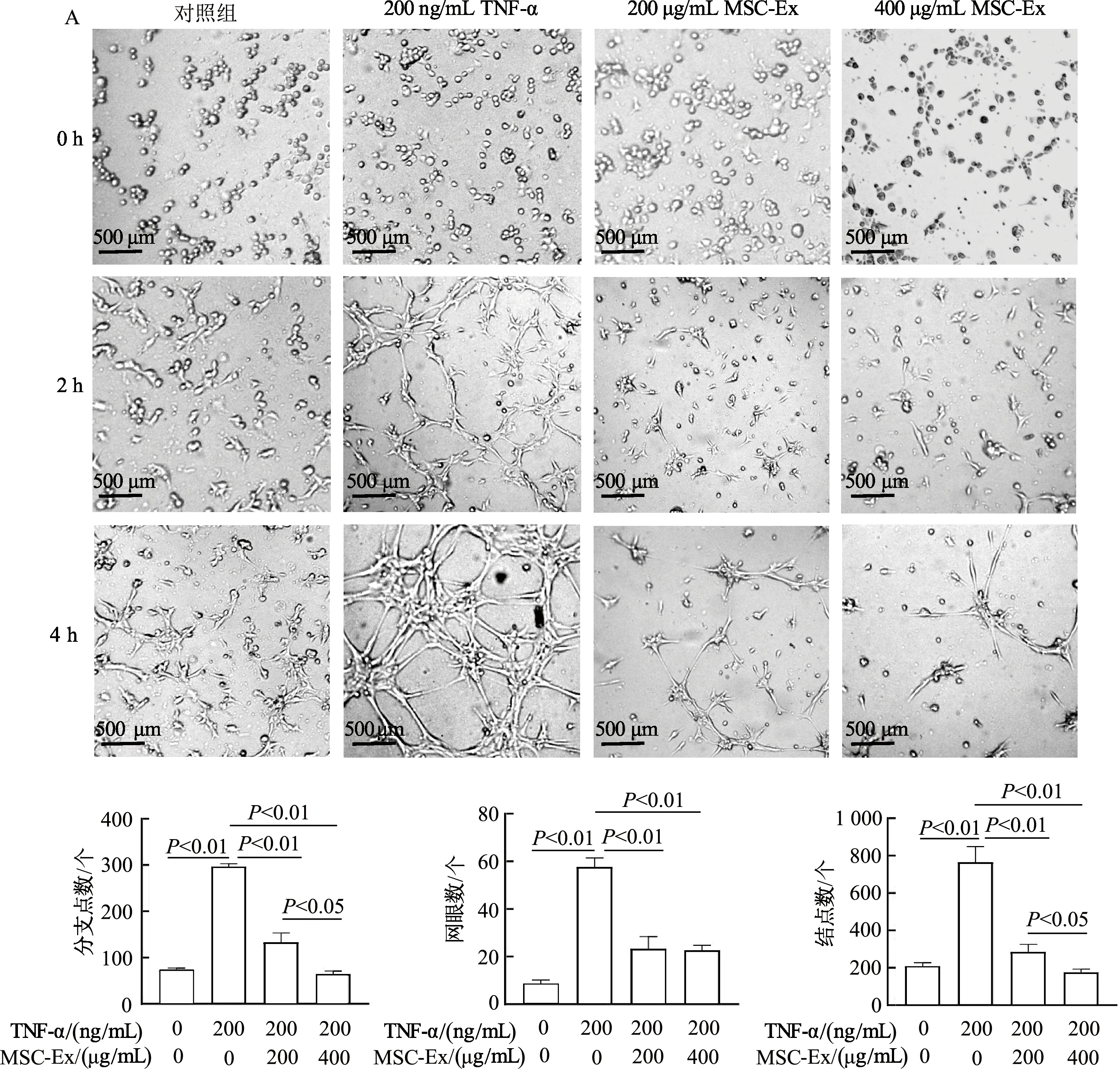
A:倒置显微镜下观察LSEC管腔形成能力;B:成管4 h时小管形成能力的相对定量分析
2.6 MSC-Ex抑制肝纤维化组织胶原沉积及Ang-2的蛋白表达
天狼猩红染色结果显示,与对照组相比,MCD组肝组织内胶原大量沉积于胆管周围(t=5.87,P<0.01),肝小叶结构不规则,出现少量点、灶状坏死。相较于MCD组,MSC-Ex组肝组织内胶原沉积缓解,肝小叶结构变清晰(t=4.33,P<0.05),如图6A箭头所示。免疫组织化学染色结果显示,相较于对照组,MCD饮食8周可造成小鼠肝组织Ang-2蛋白表达增加(t=4.86,P<0.05)。相较于MCD组,MSC-Ex组小鼠肝组织表达Ang-2蛋白降低(t=4.30,P<0.01),如图6B箭头所示。由此提示,MSC-Ex可缓解MCD饮食诱导的肝纤维化组织胶原形成,抑制促血管形成因子Ang-2的蛋白表达。
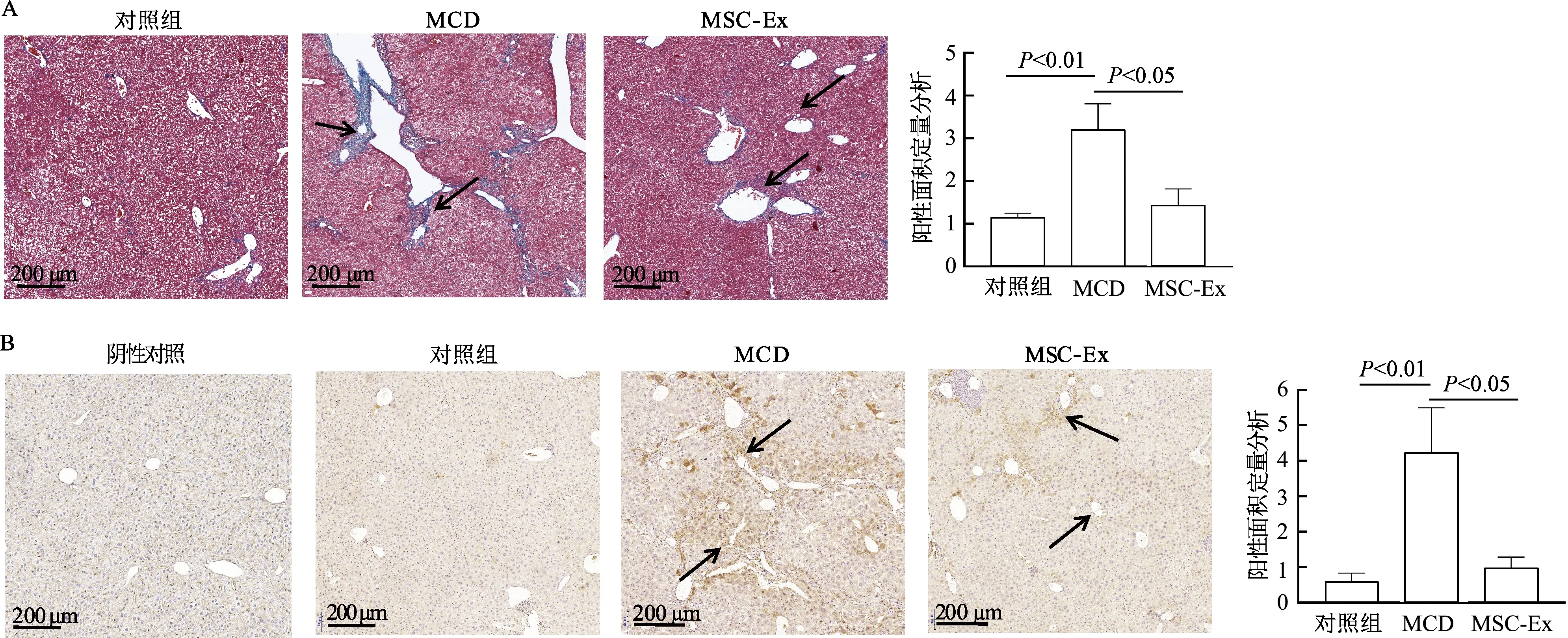
A:肝组织的天狼猩红染色及胶原沉积阳性面积定量分析;B:免疫组织化学染色检测肝组织的Ang-2蛋白表达及Ang-2阳性面积定量分析图6 天狼猩红染色和免疫组织化学染色分别检测肝组织胶原沉积和Ang-2蛋白表达(n=3)
3 讨论
LSEC毛细血管化是肝纤维化过程中的重要病理改变,可促肝脏纤维化[12]。既往关于MSC-Ex在肝纤维化中的研究主要聚焦于抑制星状细胞胶原合成[13]、抗氧化[14]、抑制肝细胞凋亡[15]等方面。本研究发现,MSC-Ex可在体外抑制LSEC毛细血管样改变,在体内抑制纤维化肝组织的胶原沉积和Ang-2蛋白表达,这可能是抑制肝纤维化的新研究方向。
多种因素可以影响LSEC的毛细血管样改变,如酒精[16]、脂毒性[17]以及药物[18]等慢性理化刺激。研究发现,TNF-α是一种可以作用于内皮细胞的多向促炎性细胞因子[19],可促进人脐静脉内皮细胞管形成,促进人脐静脉内皮细胞表达血管细胞黏附分子-1[20]。生理状态下LSEC可自分泌TNF-α参与血管内皮的炎症反应,调节机体的免疫应答,影响血管内皮细胞微环境的稳定。本研究表明,TNF-α可体外诱导LSEC血管化指标Ang-2和CD34的mRNA及蛋白表达,诱导LSEC管腔形成。CD34在静息内皮细胞中表达较低,但在活化的内皮细胞和循环内皮祖细胞中表达较高[21],本研究结果与其一致,但不同浓度TNF-α诱导LSEC表达CD34 mRNA和蛋白没有显著差异,可能是由于100 ng/mL TNF-α已经足以诱导LSEC表达CD34 mRNA和蛋白,因此与更高浓度200 ng/mL TNF-α的差异并不大。而相较于100 ng/mL TNF-α,200 ng/mL TNF-α体外诱导LSEC表达Ang-2 mRNA和蛋白的能力更强,诱导LSEC管形成的能力也优于100 ng/mL TNF-α,呈一定的浓度依赖性。研究发现,外泌体可以作为一种血管生成抑制剂,如人脐带MSC-Ex通过抑制素βA基因抑制胃癌的血管生成和转移[22],或通过激活免疫细胞和免疫细胞因子抑制肿瘤细胞增殖,抑制肿瘤血管生成[23]。在既往体内外研究中,已经证实本研究所使用的MSC-Ex剂量安全无毒性,未引起小鼠不良反应[24]。本研究结果表明MSC-Ex抗LSEC毛细血管样改变,在体外可以抑制TNF-α诱导的管形成,抑制LSEC血管化指标表达。
研究显示,Ang-2增加血管内皮通透性[25],诱导血管重塑[26],是一种有效的血管新生调节因子。研究显示,抗Ang-2治疗在体内外均显示出对肝细胞癌血管生成和肿瘤生长的显著抑制作用[27],并且可以通过增强Akt通路抑制血管瘤内皮细胞的增殖并诱导其凋亡[28]。也有研究显示,Ang-2促进肝脏病理性血管生成,抗Ang-2治疗可以缓解非酒精性脂肪肝的血管生成,是小鼠非酒精性脂肪肝疾病的治疗靶标[29]。在慢性肝病的发展过程中,LSEC毛细血管化先于肝纤维化,抑制肝窦毛细血管化可以抑制肝星状细胞活化,改善肝纤维化的进展[30]。在MCD饮食诱导的小鼠早期肝纤维化模型中,MSC-Ex发挥抗LSEC毛细血管化相关抗纤维化作用,而MSC-Ex治疗与LSEC的Ang-2蛋白水平降低有关,推测Ang-2可能是外泌体调控LSEC血管生成的重要靶点,进一步过表达或敲减Ang-2基因可以验证其发挥的调控作用。目前的研究结果也可能适用于其他器官,如肺或肾的血管化。此外,外泌体作为一个天然药物载体,是否可以携带一些抗Ang-2药物来联合治疗,尚需要进一步证实。
本研究结果显示,MSC-Ex可体外抑制TNF-α诱导的LSEC Ang-2、血管内皮细胞标志CD34表达和管腔形成,降低小鼠肝纤维化组织胶原沉积及Ang-2蛋白表达,初步表明MSC-Ex可抑制LSEC的毛细血管样改变,而MSC-Ex中发挥关键作用的活性因子有待进一步研究。
