干性增强的小鼠胚胎成纤维细胞来源的挤压囊泡抑制多种肿瘤细胞生长
2022-08-25房文静杨梦婷张俊尧费菲李丽陈茜李张左侯寒进龚爱华
房文静,杨梦婷,张俊尧,费菲,李丽,陈茜,李张左,侯寒进,龚爱华
(江苏大学医学院,江苏 镇江 212013)
近来,干细胞调控肿瘤微环境的作用引起广泛的关注。干细胞可以定向迁移至肿瘤局部,抑制肿瘤细胞生长并使其向良性表型转化,相对于传统的肿瘤治疗具有安全性高和不良反应小等优势[1-2]。研究发现,小分子化合物可以诱导小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)转变为多能干细胞,具有安全性高、成本低和易操作等优势[3]。研究表明,β-烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)、雷帕霉素、维生素C等小分子药物具有诱导或维持干细胞干性的作用[4-6]。此外,在2D培养中,干细胞的多种特性可能会降低甚至丧失,3D培养则可提供更完整的细胞与细胞和细胞与基质相互作用的微环境。在3D培养中,细胞所需的多种特性得以保持甚至促进[7]。
八聚体结合转录因子4(octamer-binding transcription factor 4,Oct4)基因主要在胚胎干细胞及生殖干细胞中表达,对于维持胚胎干细胞的多潜能性和自我更新具有重要作用,也是产生诱导多能干细胞的必要因子[8]。Nanog基因主要在胚泡的内细胞团中表达,其与细胞分裂、分化情况以及细胞的干细胞特性密切相关[9]。干细胞通过释放各种旁分泌因子如细胞外囊泡和可溶性物质等发挥功能,这些因子可影响肿瘤的发生、发展和转移[10-11]。近来研究发现,从间充质干细胞上清液中提取的微囊泡在体内外均有明显的抗肿瘤效应[12]。此外,经间充质干细胞挤压出的囊泡产出率高,且与分泌至细胞外的微囊泡具有相似的特征和功能[13]。但是,干细胞挤压囊泡是否具有与干细胞来源的外泌体功能类似的抗肿瘤效应尚不清楚。因此,本研究拟筛选小分子药物NMN、甜菜碱、维生素C和雷帕霉素促进MEF干性的最适浓度和最适组合,并将筛选出的组合与3D培养相结合,进而将筛选出的干性增强的MEF挤压成囊泡,探究其对肿瘤细胞生长的影响。
1 材料与方法
1.1 材料
1.1.1 细胞 MEF、小鼠胶质母细胞瘤GL261细胞系、小鼠肺癌细胞Lewis和小鼠肝癌细胞Hepa1-6均由江苏大学医学院细胞生物学研究室保存。
1.1.2 主要试剂 DMEM购自美国Hyclone公司;澳洲胎牛血清购自美国Gibco公司;Trizol裂解液、2×SYBR Green Mix溶液、CCK8试剂盒均购自南京诺唯赞公司;HiScript Ⅲ RT SuperMix for qPCR逆转录试剂盒购自美国Thermo公司;Matrigel胶购买自美国BD公司;兔抗人β-微管蛋白抗体购自英国Abcam公司;干性指标相关兔抗小鼠Oct-4抗体和兔抗小鼠Nanog抗体购自美国Cell公司;NMN、雷帕霉素、甜菜碱等均购自美国MCE公司;ECL发光液购买自美国Millipore Immobilon公司。
1.2 方法
1.2.1 细胞培养 MEF、Lewis、Hepa1-6和GL261细胞用含谷氨酰胺、5 μg/mL青霉素、10 μg/mL链霉素、10%胎牛血清的DMEM,于5% CO2,37 ℃的培养箱中培养。
1.2.2 筛选促进MEF干性的小分子药物
1.2.2.1 药物配制及处理 用培养液配制1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L、100 μmol/L浓度梯度的NMN和甜菜碱,10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L、100 μmol/L、1 mmol/L浓度梯度的维生素C和雷帕霉素,另设不加药物的培养基作为对照,加入MEF培养体系中培养72 h。
1.2.2.2 qRT-PCR检测不同浓度药物处理细胞中Oct-4mRNA相对表达量 用Trizol提取“1.2.2.1”不同浓度梯度NMN、甜菜碱、雷帕霉素和维生素C处理的MEF总RNA,用逆转录试剂盒行逆转录,独立样本均设3个复孔并将其逆转录成cDNA。配置10 μL反应体系,4.1 μL DEPC水、5 μL SYBR Premix ExTaqⅡ和上、下游引物各0.2 μL、0.5 μL cDNA混合均匀后加入8联管中。95 ℃预变性30 s,95 ℃ 5 s,55 ℃退火30 s,40个循环。根据NCBI查找的基因序列设计引物,Oct-4mRNA上游引物为5′-TTAAGAACATGTGTAAGCTGCG-3′,下游引物为5′-GCATATCTCCTGAAGGTTCTCA-3′。将GAPDH设为内参,以2-ΔΔCt计算Oct-4mRNA相对表达量,实验重复3次。筛选出NMN、甜菜碱、雷帕霉素和维生素C最适浓度。
1.2.3 筛选促进MEF干性的小分子药物组合
1.2.3.1 药物分组及处理 将NMN、甜菜碱、雷帕霉素和维生素C按照筛选出的最适浓度进行互相组合,两两组合为NMN+雷帕霉素、NMN+甜菜碱、NMN+维生素C、雷帕霉素+甜菜碱、雷帕霉素+维生素C、甜菜碱+维生素C;3种互相组合为NMN+甜菜碱+雷帕霉素、NMN+维生素C+雷帕霉素、NMN+甜菜碱+维生素C、甜菜碱+雷帕霉素+维生素C;4种相互组合为NMN+雷帕霉素+甜菜碱+维生素C;将不同组合分别加入MEF培养体系中培养72 h。
1.2.3.2 qRT-PCR检测不同处理组细胞Oct-4mRNA相对表达量 采用Trizol提取“1.2.3.1”中MEF总RNA,其余操作同“1.2.2.2”。
1.2.3.3 CCK8法检测细胞增殖 将MEF接种于96孔板,每孔接种3 000个细胞(100 μL培养基),于37 ℃,5% CO2培养箱培养12 h;观察细胞生长状态,分别加入10 μmol/L NMN、10 μmol/L雷帕霉素、10 μmol/L甜菜碱、100 μmol/L维生素C以及“1.2.3.1”所述小分子药物组合,每组设3个复孔,孵育72 h;每孔加入10 μL CCK8溶液,孵育1~4 h;用酶标仪测定450 nm处光密度(D)值。细胞活性(%)=(D实验组-D空白组)/(D对照组-D空白组)×100%。
1.2.4 小分子药物联合3D培养体系的建立
1.2.4.1 3D培养体系的建立 取处于对数生长期的MEF,胰酶消化,制备成细胞悬液,计数5×105个细胞,加入至10 μL Matrigel基质胶中;将与细胞混匀的基质胶滴到预热的24孔板中;待胶滴凝固呈凸起的穹顶状时,每孔加入500 μL无血清条件培养基,于37 ℃,5% CO2培养箱中培养。
1.2.4.2 药物分组及处理 将NMN+甜菜碱、雷帕霉素+甜菜碱、甜菜碱+维生素C药物组合分别加入至3D培养体系中,以未经药物处理的3D培养体系为对照,每隔一天记录MEF生长状态。在第6天时,显微镜(40×)下计数直径大于50 μm的克隆球个数。
1.2.4.3 蛋白质印迹法检测相关蛋白表达 制备含1% PMSF的蛋白裂解液,分别收集未经药物处理的2D培养、未经药物处理的3D培养、NMN+甜菜碱联合3D培养、甜菜碱+雷帕霉素联合3D培养、甜菜碱+维生素C联合3D培养6 d后的MEF,加入裂解液,充分裂解后,100 ℃加热10 min;4 ℃,12 000×g离心10 min;配制10%的SDS-PAGE分离胶,加入蛋白,80 V电泳120 min分离样品;300 mA转膜150 min将蛋白转移至PVDF膜;5%脱脂奶粉室温封闭1~2 h;加入一抗(Oct-4抗体、Nanog抗体,均1 ∶2 000稀释,β-微管蛋白抗体1 ∶5 000稀释)于4 ℃孵育过夜;TBST溶液洗膜3次;37 ℃孵育二抗(1 ∶10 000稀释)1 h;TBST溶液清洗3次;ECL发光液显色,灰度分析软件Image J 5.0分析图像。
1.2.4.4 qRT-PCR检测不同处理组细胞Oct-4mRNA相对表达量 以不加任何药物处理的2D培养体系的MEF为对照组,按照“1.2.3.1”分组将药物进行组合,分别加入至3D培养体系的MEF中,培养72 h后提取RNA,qRT-PCR检测不同处理组细胞Oct-4mRNA相对表达量,方法同“1.2.2.2”。
1.2.5 挤压法收集细胞囊泡及粒径测定
1.2.5.1 囊泡制备 取2D培养的MEF,胰酶消化,离心收集后计数。NMN+甜菜碱联合3D培养体系与3D培养体系的MEF通过收集板表面凝固的胶滴到1.5 mL EP管中,在1 mL室温解离缓冲液中(EDTA胰蛋白酶)重新悬浮颗粒,200×g离心5 min,弃上清液;加入1 mL预冷的培养基,4 ℃,500×g离心5 min,弃上清液,用培养基重悬后计数。将细胞分别通过10 μm、1 μm、200 nm的聚碳酸酯膜,通过反复抽滤使其挤压成200 nm左右的小囊泡。
1.2.5.2 囊泡分组与粒径分析 根据囊泡来源不同,分成2D囊泡组、3D囊泡组与干性明显增强的NMN+甜菜碱联合3D囊泡组,将“1.2.5.1”细胞挤压出的囊泡分别梯度稀释104倍,采用32 W、50 Hz的超声仪器超声15 min;采用NanoZS90粒径分析仪检测囊泡粒径。
1.2.6 细胞分组及挤压囊泡处理 将Hepa1-6、Lewis、GL261和MEF接种至96孔板,每孔3 000个细胞,培养过夜;分别以不加任何处理的Hepa1-6、Lewis、GL261和MEF为对照组,取“1.2.5”挤压所得囊泡分别加入96孔板中(每孔加入相当于3 000个细胞挤压的囊泡数),同时为了防止药物本身对肿瘤细胞增殖的影响,每孔加入NMN、甜菜碱、NMN+甜菜碱,每组设3个复孔,继续培养72 h;CCK8法检测细胞增殖情况,方法同“1.2.3.3”。
1.3 统计学处理

2 结果
2.1 不同浓度小分子药物对MEF干性的影响
用不同浓度梯度的小分子药物处理MEF,qRT-PCR结果显示,相对于未经药物处理的细胞,1 μmol/L NMN抑制Oct-4mRNA表达,10 μmol/L促进Oct-4mRNA表达(图1A,P<0.05);甜菜碱在10 nmol/L和10 μmol/L时促进Oct-4mRNA表达,且10 μmol/L时效果更明显(图1B,P<0.05);维生素C在100 nmol/L、10 μmol/L和100 μmol/L时促进Oct-4mRNA表达,且100 μmol/L效果更明显,但是1 μmol/L和1 mmol/L抑制Oct-4mRNA表达(图1C,P<0.05);雷帕霉素10 μmol/L和100 μmol/L促进Oct-4mRNA表达,且10 μmol/L作用效果更明显,1 mmol/L抑制Oct-4mRNA表达(图1D,P<0.05)。上述结果表明,NMN、雷帕霉素和甜菜碱促进MEF干性的最适浓度为10 μmol/L,维生素C最适浓度为100 μmol/L。

A:MEF细胞在6种浓度梯度NMN处理下Oct-4 mRNA表达量;B:MEF细胞在6种浓度梯度甜菜碱处理下Oct-4 mRNA表达量;C:MEF细胞在6种浓度梯度维生素C处理下Oct-4 mRNA表达量;D:MEF细胞在6种浓度梯度雷帕霉素处理下Oct-4 mRNA表达量;*:P<0.05,与对应的0 nmol/L组比较
2.2 不同药物组合对MEF干性和增殖能力的影响
qRT-PCR结果表明,两种药物组合中NMN+甜菜碱、雷帕霉素+甜菜碱、甜菜碱+维生素C明显促进Oct-4mRNA表达,且NMN+甜菜碱组相对表达最高(图2A,P<0.05)。3种药物组合和4种药物组合中,与未经药物处理组相比,甜菜碱+雷帕霉素+维生素C组Oct-4mRNA相对表达量明显增高,而NMN+甜菜碱+雷帕霉素组、NMN+维生素C+甜菜碱、NMN+维生素C+甜菜碱Oct-4mRNA表相对达量则明显降低(图2B,P<0.05)。

A:两种药物相互组合对MEF中Oct-4 mRNA表达的影响;B: 3种药物和4种药物相互组合对MEF中Oct-4 mRNA表达的影响;C: CCK8法检测不同药物和药物组合处理后MEF增殖情况。*:P<0.05,与未经药物处理组比较
CCK8结果表明,与未经药物处理组相比,10 μmol/L雷帕霉素细胞增殖率明显降低(P<0.05),两种药物组合中雷帕霉素+甜菜碱组细胞增殖率明显降低(P<0.05),3种药物组合和4种药物组合中,NMN+甜菜碱+雷帕霉素、NMN+雷帕霉素+维生素C、甜菜碱+雷帕霉素+维生素C、NMN+雷帕霉素+甜菜碱+维生素C组细胞增殖率明显降低(图2C,P均<0.05)。由此可见,NMN+甜菜碱组合促进MEF干性效果最强,同时不抑制其增殖。
2.3 小分子药物组合对3D培养体系中MEF干性的影响
MEF在不同3D培养体系中生长,逐渐形成不同数量的克隆球,相对于不加药物处理的3D培养组,NMN+甜菜碱组联合3D培养组与甜菜碱+维生素C联合3D培养组克隆球数目明显增多,其中NMN+甜菜碱组联合3D培养组粒径大于50 μm的克隆球数目最多(图3A~B,P<0.05)。与2D培养组细胞相比,未经药物处理的3D培养组和小分子药物组合联合3D培养体系细胞Oct-4mRNA表达水平均明显升高,其中3D培养体系中,NMN+甜菜碱联合3D培养组细胞中Oct-4mRNA相对表达水平明显高于其他组,且表达水平最高(图3C,P<0.05)。在MEF中,NMN+甜菜碱联合3D培养组Oct-4和Nanog蛋白表达量明显高于2D培养组、未经药物处理的3D培养组、甜菜碱+维生素C联合3D培养组、雷帕霉素+甜菜碱联合3D培养组(图3D~3F,P<0.05)。上述结果表明,MEF在3D环境下生长,干性明显增高,加入筛选出的药物NMN+甜菜碱组合能够进一步提高MEF干性。

A:MEF在3D培养和加药3D培养条件下形态变化;B:不同药物处理的3D培养体系中直径大于50 μm的克隆球数比较;C:qRT-PCR检测不同药物组合和3D培养对MEF中Oct-4 mRNA表达量的影响;D:蛋白质免疫印迹法检测MEF中Oct-4和Nanog蛋白表达;E:Nanog蛋白相对表达量灰度分析图;F:Oct-4蛋白相对表达量灰度分析图。*:P<0.05,与未经药物处理组比较;△:P<0.05,与2D培养组比较;#:P<0.05,与未经药物处理的3D培养组比较
2.4 挤压法获得MEF囊泡的表征
将促进细胞干性最强的组合NMN+甜菜碱联合3D培养体系细胞、3D培养体系细胞和2D培养体系细胞挤压成囊泡,粒径分析结果显示,2D培养体系细胞囊泡平均粒径为208 nm(图4A),3D培养体系细胞囊泡平均粒径为213 nm(图4B),NMN+甜菜碱组3D培养体系细胞囊泡平均粒径为193 nm(图4C)。由此可见,细胞已经被挤压成了200 nm左右的囊泡。
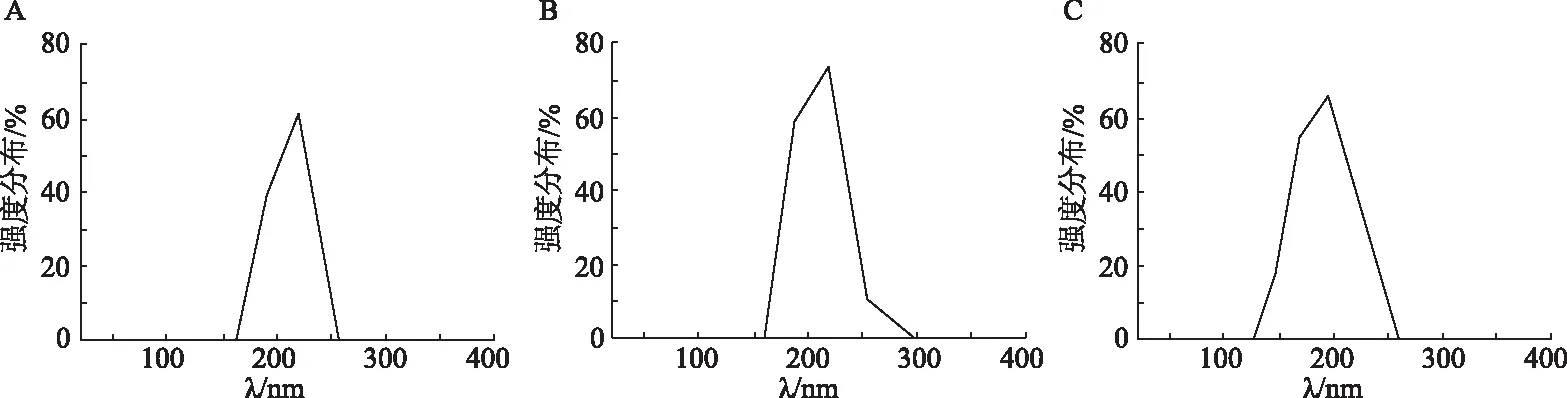
A:2D培养体系挤压囊泡粒径分布;B:3D培养体系挤压囊泡粒径分布;C:NMN+甜菜碱组3D培养体系挤压囊泡粒径分布
2.5 干性增强的MEF挤压囊泡抑制多种肿瘤细胞生长
CCK8结果表明,与对照组相比,3D囊泡组、NMN+甜菜碱联合3D囊泡组Hepa1-6、Lewis和GL261细胞增殖率明显降低(P均<0.05);与3D囊泡组相比,NMN+甜菜碱联合3D囊泡组Lewis和GL261细胞增殖率明显降低(P均<0.05);与对照组相比,2D囊泡组、3D囊泡组与NMN+甜菜碱联合3D囊泡组对MEF增殖没有明显影响(图5A)。将NMN+甜菜碱单独加入4种细胞中,CCK8结果显示,与未加药处理的对照组相比,加入NMN和甜菜碱的MEF、Lewis、Hepa1-6和GL261细胞增殖无明显差异(图5B)。由此可见,小分子药物联合3D培养导致干性增强的MEF挤压囊泡能够特异性地抑制Hepa1-6、Lewis和GL261肿瘤细胞生长。
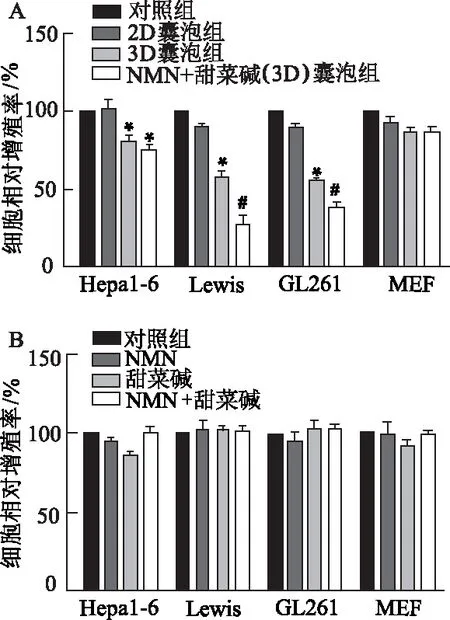
A:CCK8检测2D、3D和加药3D组细胞挤压囊泡对不同肿瘤细胞和MEF生长的影响;B:CCK8检测NMN和甜菜碱对肿瘤细胞和MEF生长的影响。*:P<0.05,与对照组相比;#:P<0.05,与3D囊泡组相比
3 讨论
以往研究发现,小分子化合物能够代替传统的基因重编程的方式诱导多能干细胞的产生,提供更加简单和安全有效的方式来重新赋予成体细胞“多潜能性”[14-15]。本研究选取NMN、甜菜碱、维生素C和雷帕霉素4种具有促进细胞干性潜力的小分子药物作用于MEF,通过干性指标Oct-4mRNA水平的变化挑选出最适作用浓度。为提高小分子药物的作用效果,将几种小分子药物在最适浓度条件下组合,同时为防止药物组合影响细胞生长的状态,通过CCK8分析细胞的增殖情况,筛选出既能促进细胞干性,又能维持细胞生长的小分子药物组合,即NMN+甜菜碱。
Nanog和Oct-4是有助于胚胎干细胞自我更新的关键因子,在胚胎干细胞的全能性维持中起关键作用,在未分化的胚胎干细胞中表达量较高[16-17]。3D培养比传统的2D培养更好地模拟了干细胞所处的微环境,能够维持干细胞干性[18]。本研究通过比较Nanog和Oct-4的mRNA和蛋白表达水平发现,与2D培养体系相比,在3D培养条件下MEF干性显著增强,NMN+甜菜碱在3D培养的基础上能够进一步增强细胞干性。
早期研究表明,干细胞来源的外泌体具有抑制肿瘤细胞生长的潜力,但是外泌体的提取过程比较繁琐并且产量低[19]。研究表明,通过挤压间充质干细胞,可以产生大量的纳米囊泡,其产量是外泌体的20倍,并且间充质干细胞挤压的囊泡具有心肌保护作用和治疗潜力,类似于从相同的细胞中提取的细胞外囊泡[13]。本研究通过3D培养和小分子药物组合获得干性增强的细胞,挤压法制备成囊泡作用于Hepa1-6、Lewis、GL261等3种肿瘤细胞和MEF,结果显示,与2D培养体系细胞挤压囊泡相比,3D培养体系细胞的挤压囊泡能够抑制肿瘤细胞增殖而不影响MEF增殖,而干性更强的NMN+甜菜碱联合3D培养组MEF囊泡抑制效果更强。由此表明,干性增强的细胞囊泡能够抑制多种肿瘤细胞生长,具有广谱性,并且对不同肿瘤细胞抑制效果不同,其具体机制尚未可知,有待进一步研究。
综上所述,NMN+甜菜碱与细胞的3D培养相结合能够提高MEF的干性,同时不抑制MEF的生长。干性提高后的MEF挤压囊泡对肿瘤细胞的生长有一定抑制作用。
