迁移体的生物学功能研究进展
2022-08-25马永宾赵乐羽周丹张欢妍姚鑫冯昱卉
马永宾,赵乐羽,2,周丹,张欢妍,姚鑫,冯昱卉,2
(1. 江苏大学附属金坛医院中心实验室,江苏 金坛 213200; 2. 江苏大学临床医学院,江苏 镇江 212013)
迁移体(migrasome)是在2015年由我国学者俞立教授团队首次发现并报道的由迁移细胞产生的一类细胞器[1]。细胞在迁移过程中,细胞尾部产生收缩丝的尖端或分叉处会产生膜性结构囊泡(图1),将其命名为迁移体[1],这一产生过程称为迁移性胞吐。随着细胞迁移和收缩丝的回缩,迁移体被留在原地脱落,释放至细胞外空间或直接被邻近细胞摄取,从而介导细胞质内容物的释放和细胞-细胞之间的通讯[2]。目前,已证实迁移体存于多种细胞、体液以及组织中,且其生理功能也已在胚胎发育过程中进行了初步的研究探讨。随着迁移体分子细胞生物学功能的不断揭示,预示着迁移体在血管稳态[3]、机体免疫反应、组织再生和肿瘤转移等细胞迁移活跃的生物过程中发挥着重要的信号传递作用。

图1 通过扫描电镜拍摄巨噬细胞(RAW264.7)形成迁移体的典型图
1 迁移体的发现
Taylor等[4]于1963年首次通过透射电镜观察到迁移细胞从基质中回缩后呈现出长管状结构,后将其命名为“收缩丝”,但是其并未对收缩丝尖端的囊泡样结构进行报道。2015年,俞立教授团队从细胞原位透射电镜中观察到直径为0.5~3.0 μm的单层膜的囊泡样结构,其内在富含数量不等的小囊泡,这些结构类似于开放的石榴,故将其命名为“石榴体(pomegranate-like structures, PLSs)”,通过扫描电镜发现其附着于收缩丝上[1]。Ma等[1]通过梯度密度离心法将PLSs分离并通过质谱分析鉴定其可能的蛋白组成,随后通过GFP荧光标记富集蛋白质并定位,最终鉴定四跨膜蛋白家族-4(tetraspanin-4, TSPAN4)是PLSs中高度富集的蛋白标志物,定位于细胞膜和细胞膜表面伸出的收缩丝上。在细胞迁移的过程中,细胞的尾部出现很长的收缩丝,且在尖端或分叉处形成PLSs,最终收缩丝回缩断裂,PLSs则释放到介质中,其存在的平均生命周期约为400 min,最终破碎消失。鉴于PLSs的形成取决于细胞迁移过程,故正式命名为“迁移体”。
2 迁移体的形成机制
2.1 整合素和细胞外基质结合介导迁移体形成
迁移体的形成取决于细胞迁移过程,而细胞迁移依赖于细胞外基质(extracellular matrix,ECM)的黏附作用。事实上,纤连蛋白包被的培养皿,不仅提高了细胞迁移速率,同时也增加了黏附于培养皿底部迁移体的数量;反之,则减少迁移体的数量和阻断迁移体的再形成[1],提示迁移体的形成可能受到参与调节细胞-细胞或细胞-基质之间的蛋白分子调控。Wu等[5]发现,整合素α5β1富集在迁移体底部,且其出现在收缩丝上的时间点显著早于迁移体的形成。这种分布模式进一步支持了整合素是迁移体形成的重要功能分子。然而,不同的整合素与不同ECM蛋白结合,并且每种ECM蛋白在特定生物体中具有特定的时空分布模式。因此,整合素与特定ECM蛋白结合可能是迁移体形成的关键因素。正如在富含整合素α5的大鼠肾脏细胞(NRK细胞)中,纤连蛋白是促进迁移体形成的最佳ECM[5];另外,在富含整合素α1的中国仓鼠卵巢细胞(CHO细胞)中,与其亲和度最高的Ⅳ型胶原蛋白显著增强了迁移体的形成,但其他ECM相关蛋白却未参与[5]。从机制上讲,当细胞迁移时,整合素使细胞迁移成为可能,并且整合素与其特异性ECM伴侣蛋白的配对为收缩丝提供了黏附力,逐渐在迁移细胞的后方产生收缩丝,最终形成迁移体。最近,Lu等[6]研究再次印证了上述结论,即迁移体形成取决于细胞黏附和迁移的共同作用,且提出了细胞与ECM的黏附可调节收缩丝上的张力,而收缩丝适当的张力是迁移体形成的先决条件。这些研究表明,整合素与特定ECM伴侣蛋白配对以获得适当的黏附能力是迁移体形成的决定因素。同时,迁移体所富集的整合素也为其进入特定受体细胞提供了特异性,这为回答迁移体“从哪来”和“到哪去”的问题提供了可能,以及为迁移体生物学功能的探究提供了理论基础。
2.2 TSPAN4参与迁移体形成
TSPAN4属于四跨膜蛋白家族一员,含有4个跨膜结构域。Ma等[1]研究发现,TSPAN4在迁移体中富集度最高且是第一个被用于鉴定迁移体的蛋白标志物。Huang等[7]研究发现,TSPAN扮演的角色不仅仅是用于鉴定迁移体的蛋白标志物。在哺乳动物中,四跨膜家族有33种TSPAN蛋白成员,其中14种TSPAN蛋白成员过表达均可增强NRK细胞中迁移体的形成[7]。然而,敲除最高表达的TSPAN蛋白(TSPAN4),则损害了NRK细胞和人胃癌细胞(MGC-803细胞)中迁移体的形成,而小鼠成纤维细胞(L929细胞)中TSPAN4的缺乏并没有损害迁移体的形成,这可能是由于其他TSPAN成员的存在[7]。在迁移体形成过程中对TSPAN4-GFP的研究显示,TSPAN4能被主动招募到迁移体中,且TSPAN4-GFP的信号强度与迁移体的形成呈正相关。此外,在迁移体体积达到最大尺寸后,迁移体中TSPAN4-GFP的信号将保持不变并处于稳定期,继而停止富集TSPAN4。这表明TSPAN4可能驱动了迁移体的形成。已经证实,TSPAN蛋白能在膜上形成四跨膜蛋白富集的微结构域(tetraspanin-enriched microdomains, TEM)。Huang等[7]研究发现,迁移体中富含胆固醇,而降低作为TEM的关键组分的胆固醇可阻碍迁移体的形成。这提示TSPAN4和胆固醇是迁移体形成所必需的物质。在迁移体的形成过程中,迁移体被许多小TEM成分富集组装为四跨膜蛋白富集的宏结构域(tetraspanin-enriched macrodomains, TEMAs),从而有助于收缩丝的生长和迁移体的形成。Huang等[7]建立了体外模拟系统,通过机械应力、液体流动及人工拉伸来形成迁移体和收缩丝。迁移体重建成功后,TSPAN4在迁移体样结构中高度富集,且在迁移体样结构中的胆固醇与TSPAN4完全共定位。而当胆固醇或TSPAN4缺失时,未观察到迁移体样结构形成,且两者都随机分布在收缩丝上,更为重要的是TSPAN4没有组装成TEMAs。不仅如此,Huang等[7]通过使用玻璃针向细胞膜施加机械应力以产生收缩丝样结构。在拉伸过程中,伴随TSPAN4组装形成TEMAs,最终自发膨大形成迁移体样结构。而当缺乏TSPAN4则不能形成迁移体样结构。这些研究表明,胆固醇和TSPAN4组装成的TEMAs是迁移体形成的必要条件。此外,Huang等[7]通过建立基础物理理论模型发现,收缩丝上形成的TEMAs的弯曲刚度显著高于其他部位,从而导致质膜硬化膨大形成迁移体。原子力显微镜测量参数与理论推导计算参数高度一致。这些研究表明,TSPAN蛋白和胆固醇形成的微米级TEMAs能够介导迁移体形成,且提出胆固醇和TSPAN4是迁移体形成的基本组件,这为研究迁移体的生物学功能与调控机制提供了可靠的参考方法和理论依据。
2.3 细胞迁移模式调节迁移体的形成
前期研究已经表明,迁移体的形成依赖于细胞迁移,其附着在迁移细胞的收缩丝上。最新报道发现,与细胞直线迁移相比,细胞迁移方向的改变则能导致迁移体形成明显较少[8]。这是由于细胞迁移时,细胞体伸长导致尾部变窄,在细胞迁移过程中不稳定的迁移方向会造成收缩丝的减少,最终导致迁移体形成减少。此外,Fan等[8]进一步研究发现,细胞迁移速度的增加可使形成的收缩丝长度增加,继而形成更多的迁移体。而去除与维持细胞形状直接相关的波形蛋白(vimentin)后,便会阻碍细胞的迁移速度和持续性,导致迁移体形成减少。这表明,细胞迁移速度与迁移体形成呈正相关,由此提示细胞迁移模式(迁移方向以及速度)通过调节收缩丝的状态控制迁移体的形成。
3 迁移体的生物学功能
3.1 迁移体与胚胎发育
斑马鱼胚胎发育过程是第一个成功应用于观察迁移体在体内生理学功能的模型。Jiang等[9]发现,在斑马鱼原肠胚形成过程中会产生大量迁移体,且主要分布于斑马鱼胚胎中胚层以及内胚层合胞层之间的空间中。进一步研究发现,在敲除TSPAN4a与TSPAN7基因的个体中,迁移体形成减少且斑马鱼胚胎出现左右不对称发育缺陷。而外源性给予迁移体,仅能部分挽救斑马鱼器官的发育。这提示造成斑马鱼器官发育缺陷可能直接由有缺陷的迁移体形成所致,而非TSPAN4a和TSPAN7等其他影响。值得注意的是,给予外源性注射迁移体也能有效地挽救CXCL12基因敲除斑马鱼胚胎器官发育缺陷。进一步机制研究表明,CXCL12在迁移体中富集并作为化学趋化剂,在胚胎屏障下方的腔内累积,通过CXCL12介导的趋化性,将表达CXCL12受体(CXCR4)的背部先驱者细胞招募到胚胎屏障附近并正确定位,从而协调斑马鱼原肠胚形成过程中的器官形态发育。这项研究是首次在斑马鱼胚胎器官发育中证实迁移体存在的直接证据,且揭示了迁移体作为信号分子通过膜包装形成完美的信号载体释放,并建立特定的时空分布,从而发挥协调斑马鱼胚胎器官发育的新机制。在斑马鱼器官发育过程中,涉及背部先驱者细胞迁移的关键环节,而这一过程受迁移体的功能调控。这也为其他细胞迁移相关疾病提供了启示,迁移体很可能在其中扮演重要角色。
3.2 迁移体与线粒体胞吐
最近,Jiao等[10]发现当轻度线粒体应激时,受损的线粒体会易位到迁移体中,最终被迁移细胞清除,这一过程被命名为“线粒体胞吐”。但这一过程不是无序的,而是具有高度选择性。在线粒体异质性细胞实验中,从携带有正常和突变线粒体DNA(mitochondrial DNA,mtDNA)的细胞中分离的迁移体中发现,迁移体内的绝大多数mtDNA是以突变形式存在的。由于突变mtDNA中缺失大量编码蛋白质的基因,导致线粒体功能受损。这表明功能受损的线粒体会被选择性地运输到迁移体中。此外,线粒体胞吐也需要KIF5B、Drp1及Myo-19的协同和级联功能。线粒体受损募集KIF5B到线粒体上介导其向膜边缘延伸,一旦到达膜边缘,线粒体会通过Myo-19将其束缚在质膜的肌动蛋白皮质上,随后与肌动蛋白皮质结合的管状线粒体的尖端经历Drp1介导的线粒体裂变,最终运输到迁移体中。而且,被运输到迁移体中的受损线粒体已经丧失了自身的膜电位。因此,线粒体胞吐是迁移体调控线粒体质量控制的过程。而线粒体胞吐也可能具有保护性作用,从而维持线粒体的稳态。Jiao等[10]进一步通过建立中性粒细胞为研究对象的体内模型发现,循环中性粒细胞广泛产生了大量含有受损线粒体的迁移体。在敲除TSPAN9基因的小鼠中,循环中性粒细胞形成的迁移体数量减少和膜电位显著降低。更为重要的是,敲除TSPAN9基因小鼠的循环中性粒细胞生存活力明显降低。以上研究表明,线粒体胞吐对于维持循环中性粒细胞存活至关重要。值得注意的是,线粒体胞吐是通过轻度应激诱发形成的,而在使用诱导线粒体自噬剂量的线粒体氧化磷酸化解偶联剂作用下,几乎没有迁移和线粒体胞吐。这一现象表明,线粒体胞吐和线粒体自噬可以作为两种系统来维持迁移细胞中的线粒体稳态[10-11],即线粒体胞吐处理生理条件下的轻度线粒体损伤,而线粒体自噬则处理由病理导致的严重线粒体损伤。此外,线粒体受损后活性氧的产生主要发生在线粒体胞吐之前,而线粒体自噬对活性氧引发的线粒体损伤具有保护作用[12]。那么,这两种独立系统之间是否存在机制上的关联。另外,通过迁移体释放的受损线粒体的最终“命运”如何?这都是未来研究需要重点关注的问题。
3.3 迁移体内容物传递
现有证据表明,细胞在迁移过程中释放的迁移体,会被周围细胞所摄取,从而传递其内在所携带的生物活性物质,如蛋白质、mRNA。这表明,迁移体可以介导细胞间的信息“交流”,与小细胞外囊泡(small extracellular vesicle, sEV)的转运机制有一定的类似之处,即sEV可通过传递自身携带的细胞内容物至受体细胞,从而影响受体细胞的生物学功能。最近,Zhu等[13]通过基因测序发现,L929细胞源迁移体中高度富集具有翻译功能的全长mRNA,且这些mRNA与代谢、细胞内运输、细胞连接、囊泡融合、亚细胞和膜结构组装等功能高度相关。磷酸酶张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)作为迁移体中富集度极高的mRNA,在使用迁移体刺激PTEN缺陷的肿瘤细胞后,在肿瘤细胞中检测到了PTEN的表达且显著降低了磷酸化AKT(p-AKT)水平,最终抑制肿瘤细胞的增殖。不仅如此,分别使用蛋白酶K去除PTEN蛋白及Triton X-100添加RNA酶去除PTENmRNA处理迁移体的研究中,也进一步证实了迁移体可通过水平转移PTEN蛋白或mRNA调节细胞的p-AKT水平,而PTEN蛋白主要在早期时间点调节,PTENmRNA则在晚期时间点发挥调节作用。这表明,迁移体可以将自身的内容物(如mRNA和蛋白)转运至受体细胞,从而通过基因修饰或蛋白本身调节受体细胞的生物学功能。此外,Liu等[14]分离人类足细胞中的迁移体,通过基因测序发现迁移体也同样富集了高丰度的miRNA。随着迁移体富含的生物活性组分的不断鉴定,其生物学功能仍有待阐明,尤其是在生理和病理条件下的功能作用。
4 迁移体与临床疾病
目前,尽管迁移体的生物学功能在不断刷新人们的认知,然而很大程度上其与临床疾病的关系仍不明确。现有报道显示[15],人脑卒中组织中存在迁移体,高盐膳食会导致缺血性脑实质中迁移体的形成增加,然而具体功能机制仍有待阐明。Liu等[14]发现,足细胞损伤后会释放大量的迁移体且可被作为足细胞早期损伤的非侵入性的生物标志物,这对于肾病发生的早期诊断具有重要意义。另外,还提出Rac-1抑制剂可以通过阻断足细胞迁移体的形成来保护足细胞免受损害。鉴于目前迁移体在介导细胞间通讯以及维持细胞稳态功能方面的重要作用,不难预见,迁移体可能参与血管稳态[3]、机体免疫反应、组织再生和肿瘤转移等细胞迁移相关疾病,具体机制有待进一步探索和揭示。
5 迁移体与外泌体的异同
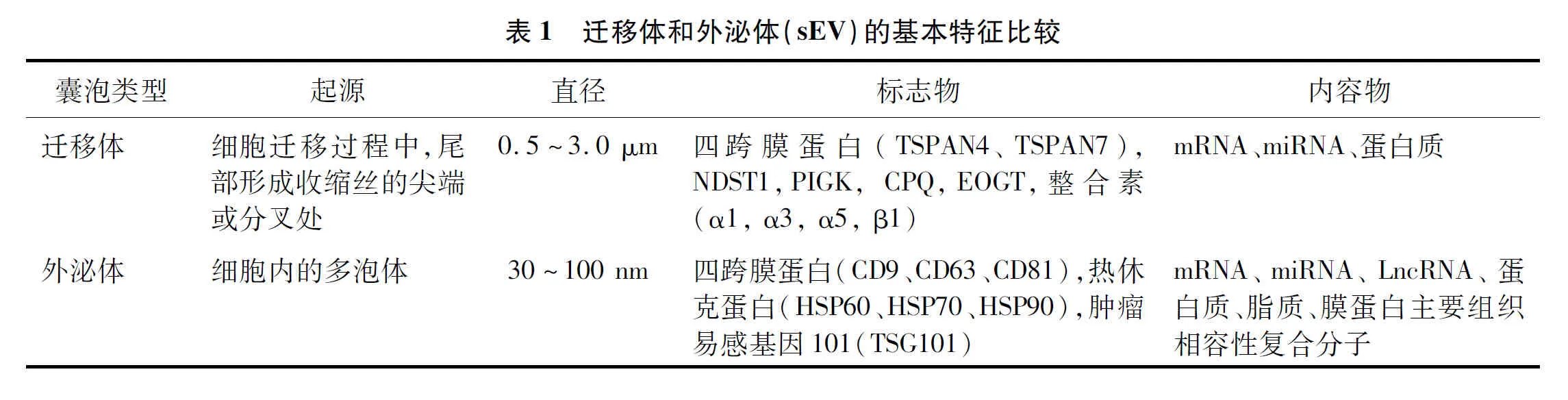
外泌体是一类具有膜结构的sEV,并可由多种细胞类型分泌[16- 17]。同样具有膜结构的迁移体与sEV看似相似。但事实上,迁移体与sEV有着本质上的不同(表1),首先,两者之间的释放过程不同,迁移体涉及细胞内容物易位,通过收缩丝回缩断裂释放,而sEV则通过多泡体与质膜的融合并释放[18];其次,两者的直径不同,迁移体直径为0.5~3.0 μm,且内在包含数量不等的小囊泡,而sEV直径为30~100 nm[16];此外,两者的蛋白标志物不同,如迁移体特异性表达N-脱乙酰基酶/N-硫酸基转移酶1(N-deacetylase/N-sulfotransferase 1, NDST1),糖基磷脂酰肌醇锚定生物合成K类(phosphatidylinositol glycan anchor biosynthesis, class K, PIGK),羧肽酶Q(carboxypeptidase Q, CPQ)和EGF结构域特异性O-连接的N-乙酰氨基葡萄糖转移酶(EGF domain-specific O-linked N-acetylglucosaminetransferase, EOGT),但在sEV中不存在或几乎检测不到,且迁移体表达的TSPAN4/7和整合素α1,α3,α5,β1等可以作为迁移体的基本结构标志物[1, 9,15,18];另外,两者所携带的内容物不同,如蛋白质组学分析两者仅有27%(158个)蛋白质相同[18],基因测序分析两者具有不同的miRNA富集[14]。以上研究提示,迁移体是一类独特的囊泡,且被认为是一种新型细胞器[1]。da Rocha-Azevedo等[2]发表的评论文章支持迁移体是一类新的和结构上不同于sEV样囊泡,并提出细胞是通过迁移体向外释放内容物的一种新途径的观点。目前,在迁移体检测方面,除原位透射电镜和荧光显微镜之外,俞立教授课题组最近开发了一种快速、方便的基于小麦胚芽凝集素(WAG)荧光探针来检测固定细胞和活细胞中的迁移体[19]。
6 结语
近几年,迁移体生物学功能的认知已得到广泛关注且已成为细胞生物学研究的新领域。相对于与迁移体同样具有膜结构的sEV而言,迁移体目前的研究尚处于初始阶段,其具体的生物发生和调控的分子机制是需要尽快解决的问题。已有研究阐明,迁移体的内容物中负载有较为丰富的mRNA、蛋白及miRNA,而这些内容物是如何有选择地进入迁移体?此外,这些内容物可被周围细胞所摄取,这种功能形式是否是机体生理条件下发生的相关事件?迁移体在临床疾病的发生和发展中的作用仍有待进一步发掘。然而,不争的事实是,已有证据显示,迁移体可能参与细胞迁移相关疾病的发生和发展,这对于临床疾病的诊断和治疗具有巨大的应用潜力,而这种临床应用需要通过揭示迁移体在生理和病理过程中的作用才能够得以发挥。
