小鼠深静脉血栓实验模型的制备
2022-08-25张茜谷田刘哲宇李思郑晓新
张茜, 谷田, 刘哲宇, 李思, 郑晓新
(1. 武汉大学人民医院心血管内科,湖北 武汉 430060; 2. 心血管病湖北省重点实验室,湖北 武汉 430060; 3. 武汉大学心血管病研究所,湖北 武汉 430060)
深静脉血栓(deep venous thrombosis,DVT)是多种因素引起的静脉血栓性疾病,多发生在腿部,并伴有肺栓塞,统称为静脉血栓栓塞[1]。DVT成因复杂,主要有遗传因素、创伤、血液黏度增大、长期固定、血管内皮功能异常等[2]。患病后易造成肢体残疾,甚至危及生命,其治疗主要包括抗凝[3]和介入治疗[4]等。然而DVT病变过程复杂,病因尚未完全明确,研究DVT形成的信号传导通路、标志性的早期预警因子、预防和治疗的药物研发都离不开动物模型。小鼠因具有价廉、操作方便、可重复性强、符合实验动物的3R原则[5]等特点而成为DVT研究的首选动物。小鼠DVT模型制备的质量及成功率将直接影响实验研究的进度和可信度,目前系统讨论小鼠DVT模型制备方法的报道较少。本研究旨在构建一种操作性、可行性和实用性强的小鼠DVT模型,探讨相关构建的方法。
1 材料与方法
1.1 实验动物与分组
C57BL/6J小鼠56只, 6~8周龄,雌雄不限,体重20~25 g,购自湖南斯莱克景达实验动物有限公司,实验操作遵守武汉大学人民医院动物伦理委员会规定。实验小鼠随机分为正常对照组(n=6)、假手术组(n=12)、手术1组(n=12)、手术2组(n=12)、内毒素+手术组(n=14)。正常对照组不做处理;手术1组行下腔静脉90%结扎术;假手术组除不结扎外,其他操作同手术1组;手术2组在结扎术前2 h,腹腔注射0.1 mL的生理盐水;内毒素+手术组在结扎术前2 h,腹腔注射溶于0.1 mL生理盐水的0.1 mg/kg内毒素(脂多糖,美国Sigma公司)。
1.2 DVT模型制备
1.2.1 术前准备及超声评估 实验小鼠术前4 h禁水,12 h禁食,称重,用2%异氟醚-氧(氧浓度100%)混合物麻醉小鼠,待小鼠安静、呼吸平稳后仰卧固定于手术台。使用Visual Sonics带有40 MHz小鼠扫描头的Vevo 2100 系统获得下腔静脉和周围结构、血管以及血流的图像。
1.2.2 分离下腔静脉 腹部消毒,沿其腹白线切开,切口不要太长,下至凝固腺,上至露出肝脏一角即可。用湿棉签小心拨出小肠等器官置于小鼠左侧,用温生理盐水浸湿的纱布包裹,显露下腔静脉。在解剖显微镜下辨别下腔静脉和腹主动脉以及旁边的输尿管和神经,用显微器械小心地在肾动脉分叉水平以下节段,将下腔静脉与主动脉分离,结扎所有下腔静脉侧支。
1.2.3 下腔静脉结扎及术后即刻超声评估 参考Ponomaryov等[6]方法,将1根30 G的针头与下腔静脉用7-0聚丙烯缝线一并绑绕,再移除针头,该方法可使下腔静脉面积缩小约90%,且不损伤血管内皮。腹腔中加入8 000 U青霉素预防伤口感染,用5-0缝合线逐层缝合腹腔。迅速在下腔静脉所在区域覆盖超声凝胶,使用Vevo 2100超声影像系统获得下腔静脉和周围结构、血管以及血流的图像。随后纱布清洁和碘伏消毒。
1.2.4 术后护理 将小鼠置于25~28 ℃的环境中,直至复苏。保持垫料清洁干燥,常规饲养及饮水,监测小鼠精神状态、食欲、伤口恢复和体重情况。术后肌注青霉素8 000万/d预防伤口感染。
1.3 标本的获取及测量
造模术后48 h,用90 mg/kg、5%戊巴比妥钠腹腔注射小鼠,致过量麻醉后处死小鼠。沿腹白线开腹,移开小肠等器官,显露下腔静脉。在下腔静脉的结扎处下方,取出结扎线远心端长度为1.0 cm的下腔静脉段血管,小心分离血栓,进行测量。根据文献报道[7],超声测得的血栓面积和按比例确定的血栓重量显示出很强的相关性(r2=0.96)。因此,本研究中使用的手动血栓大小评估方法可以被认为是有效的,与传统的超声测量面积的方法相比,更加简单便捷。
1.4 统计学方法

2 结果
2.1 手术成功率及死亡率
实验动物术后死亡视为手术失败。正常对照组的6只小鼠全部存活至实验终点;假手术组小鼠手术成功率为66.7%(8/12,不合格2只),术后死亡率为16.7%(2/12,1只为麻醉意外,1只为出血);手术1组小鼠手术成功率为66.7%(8/12),术后死亡率为25.0%(3/12,1只为麻醉意外,1只为出血,1只为感染);手术2组小鼠手术成功率为75.0%(9/12),术后死亡率为25.0%(3/12,2只为出血,1只为感染);内毒素+手术组手术成功率为50.0% (7/14,不合格1只),术后死亡率为42.8%(6/14,2只为出血,4只为感染)。内毒素+手术组有4例动物在注射内毒素后死亡,不能排除由内毒素引起,故在计算下腔静脉狭窄术手术总死亡率和成功率时,仅纳入手术1组和手术2组数据。下腔静脉狭窄手术的小鼠共24只,下腔静脉狭窄术总死亡率为25.0%(6/24),总成功率为70.8%(17/24)。死亡原因主要为麻醉意外、术中或术后出血、伤口感染。在观察终点,各实验组存活动物体重无明显差异。
2.2 麻醉效果
用异氟醚在自制麻醉盒里诱导麻醉30~40 s,随后以2%异氟醚-氧混合物持续麻醉小鼠,维持效果好,以动物安静、捏脚趾反射消失和呼吸平稳为完全麻醉表现。本实验麻醉意外死亡2只,均为瘦弱个体,推测可能也与异氟醚诱导麻醉时间过长有关(>50 s)。
2.3 手术成功评价
图1显示的是小鼠DVT模型构建过程,白光及血管超声图片。在小鼠的下腔静脉未结扎前,超声显示血流清晰且通畅,下腔静脉易于压缩。在下腔静脉结扎并拔掉30 G针头后即刻,超声可见结扎线远端一束来自后侧支的静脉血流注入下腔静脉的信号,说明仍有静脉血流通过结扎点,表明血栓模型造模成功。
2.4术后动物基本情况和取材前大体观
所有实验组动物术后2~3 h逐渐开始活动,24 h后活动量明显增大,内毒素+手术组小鼠活动稍差、精神欠佳、食欲减退。正常对照组和假手术组下腔静脉管径粗细均匀,管壁薄而柔软,内膜面平整、光滑。手术1组、手术2组和内毒素+手术组小鼠术后48 h形成DVT的下腔静脉血管段血管弹性下降,腹腔内均可见肠系膜静脉血管明显扩张,肠蠕动减弱,并可见轻-中度肠胀气。
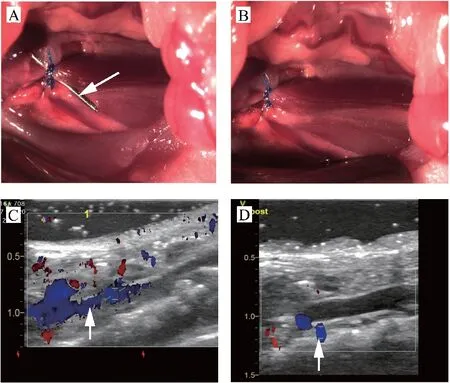
A:下腔静脉结扎时,箭头所示为30G针头;B:下腔静脉 90%结扎后即刻;C:结扎前下腔静脉超声图,箭头所示为下腔静脉血流信号;D:下腔静脉结扎后超声图,箭头所示为后侧支静脉血流信号
2.5 血栓重量与长度
各组血栓形成情况如图2所示。以同一批次小鼠形成血栓的重量和长度是否有统计学差异,来评估DVT模型的稳定性。手术1组与手术2组的下腔静脉血栓重量和长度比较,差异均无统计学意义[重量:(5.58±3.98) mgvs.(5.80±4.33)mg,t=-0.105,P=0.918;长度:(3.30±1.92) mmvs.(3.51±2.45)mm,t=-0.196,P=0.847]。与手术2组相比,内毒素+手术组血栓长度增加,差异有统计学意义[(6.37±2.08)mmvs.(3.51±2.45)mm,t=2.469,P=0.027],血栓重量也增加,但差异无统计学意义[(9.81±4.72)mgvs.(5.80±4.33)mg,t=1.771,P=0.098]。正常对照组、假手术组、手术1组、手术2组和内毒素+手术组形成血栓例数占比依次为0、0、87.5%、77.7%和100%。

图2 各实验组血栓形成情况
3 讨论
DVT是血液在深静脉内不正常凝结引起的静脉回流障碍性疾病。深入研究其致病机理,对改善患者症状、降低并发症发生率及死亡率有重要意义。而建立稳定可靠且符合临床DVT特点的动物模型是这一问题的研究基础。
既往研究尝试多种不同的动物制备模型[8]。杨军等[9]认为,在血栓机化的早期阶段,不同动物个体间存在着相似的规律。目前小鼠应用最为广泛,其优势表现在[10]:① 标准“实验动物”可受到全面控制,保证实验结果的可靠性;② 技术操作的可行性高;③成本低,易于取得。
众多危险因素均是通过Virchow提出的血栓形成3大要素,即血管壁损伤、血流缓慢、血液高凝状态而促进静脉血栓的形成[11]。目前常采用的方法有[12]:① 下腔静脉狭窄法,通过外力加压下腔静脉导致稳定的层状血栓形成。该法保证近心端通畅,更符合人体血栓形成特点,形成血栓时间较长,量少且数值相差不大。适合血栓溶解和再通的实验研究。② 下腔静脉结扎法,通过手术闭塞下腔静脉,从而损伤血管,暴露血管内皮下胶原纤维,并造成局部低氧环境和炎症反应,最终激活凝血系统[13]。该法不能保障血栓的近心端通畅,不适合药物研究。③ 电解损伤法,即将直流电通过导线诱导血管内自由基形成,从而使内皮细胞活化,诱发形成血栓。该模型可用于血栓治疗药物研发,但手术时间长,并可使静脉壁完整性破坏。本研究使用了上述第一种方法,即下腔静脉狭窄法。在该模型中,下腔静脉管腔体积减小了约 90%。血栓形成由内皮细胞活化启动,形成于血流速度降低的狭窄点远心端。在组织学上观察到该模型中形成的血栓也与人类静脉血栓相似[14]。因此基于该模型所获得实验数据具有一定的参考价值。
本实验总结提高成功率降低死亡率的要点如下,① 动物质量、饲养环境及术前护理:实验动物适应性饲养1周。术前12 h禁食、4 h禁水,避免过多消化道内容物影响手术过程,降低术后发生肠梗阻等并发症的风险。② 麻醉效果:本实验麻醉意外死亡2只,推测可能与自身体弱及异氟醚诱导麻醉时间过长有关。小鼠体型小,应注意避免麻醉药物过量。③ 预防出血和组织损伤:切口应下至凝固腺,上至露出肝脏一角即可,尽量避免长切口以减少创伤。下腔静脉比较脆弱易破裂,加上个别动物存在异常解剖结构,故分离时采用显微手术器械小心钝性分离,动作轻柔避免损伤神经纤维和输尿管。④ 预防感染:器械严格灭菌处理,术中遵守无菌操作,青霉素预防感染。⑤ 预防腹腔粘连:术后腹腔中注入1.0 mL生理盐水。
本研究中,手术1组和手术2组DVT重量和长度均无统计学差异,表明本实验DVT模型是稳定的。为进一步验证模型实用性,设置了内毒素+手术组,低剂量内毒素可诱导DVT加重,血栓长度有统计学差异,血栓重量无统计学差异,但仍大于手术2组。可能由于内毒素刺激机体合成与过量释放细胞间黏附分子1,最终使出血-凝血机制失衡,从而促进血栓形成。既往研究曾探讨过内毒素注射后循环炎性标志物变化情况以及血栓病理形态学,但该部分不是本研究重点内容,故未进行重复[15]。
综上所述,本研究通过方法学改进,建立一种较理想的DVT小鼠模型。与其他动物或不同模型相比,手术1组和手术2组建立的动物模型具备诸多优势,其更符合人体DVT的病理生理演变,操作可重复性强,方法简便并且价格低廉。
