5-氮杂-2’-脱氧胞苷对高糖培养的NRK-52E细胞中分泌型卷曲相关蛋白1表达的影响
2022-08-17田平平卢雨微石明隽
田平平,宁 洁,邹 琴,卢雨微,郭 兵,石明隽*
(1.新乡医学院 三全学院 扩理学院,河南 新乡 453003;2.贵州医科大学 病理生理学教研室,贵州 贵阳 550025;3.贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州 贵阳 550025)
肾脏纤维化是慢性肾脏疾病发展的常见病理过程。各种致病因素刺激使肾脏细胞不断分泌炎性介质及细胞因子等,促进细胞外基质(extracellular matrix, ECM)的分泌与沉积,最终引起肾脏结构和功能的改变[3]。
分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, Sfrp1)属于分泌型糖蛋白。本课题组研究发现,在糖尿病肾病(diabetic nephropathy, DN)大鼠肾组织中,Sfrp1表达减少可能参与肾脏纤维化的发生[4]。也有研究发现,Sfrp1甲基化与多种肿瘤的发生密切相关,其中DNA甲基化转移酶(DNA methyltransferase,Dnmts)扮演着重要角色[5-6]。Dnmts共包含Dnmt1、Dnmt2、Dnmt3a、Dnmt3b和Dnmt3l 5个成员。在哺乳动物中,参与甲基化调节的主要有Dnmt1、Dnmt3a和Dnmt3b[7]。5-氮杂-2’-脱氧胞苷(5-Aza-2’deoxycytidine, 5-Aza-CdR)是一种DNA甲基转移酶抑制剂,可共价结合Dnmts,调节基因表达。
本研究拟从体外水平,利用5-Aza-CdR干预NRK-52E细胞,观察Sfrp1、Dnmt3a、Dnmt3b、col-Ⅲ及col-Ⅳ在各组细胞中的表达变化,探讨Dnmt3a、Dnmt3b、col-Ⅲ及col-Ⅳ与Sfrp1的关系以及Sfrp1在DN肾脏纤维化发病中的作用及意义,为DN的治疗提供依据。
1 材料与方法
1.1 材料
1.1.1动物:清洁级雄性SD大鼠16只,体质量(180±20)g[辽宁长生生物技术有限公司,生产许可证号:SCKK(辽)2015-0001]。
1.1.2细胞:大鼠近端肾小管上皮细胞系(NRK-52E细胞),购于美国菌种保藏中心(American Type Culture Collection, ATCC)。
1.1.3试剂及试剂盒:链脲佐菌素(streptozotocin, STZ),5-氮杂-2’-脱氧胞苷(5-Aza-2’deoxycytidine, 5-Aza-CdR),小鼠抗大鼠col-Ⅳ单克隆抗体(Sigma-Aldrich公司);两步法免疫组化检测试剂盒(北京中杉金桥公司);胎牛血清、DMEM培养基和0.25%胰蛋白酶(Gibco Introvagen公司);蛋白提取试剂盒 (北京索莱宝公司);小鼠抗大鼠β-actin单克隆抗体(武汉普美克生物技术有限公司);兔抗大鼠Dnmt3a、Dnmt3b、Sfrp1和col-Ⅲ多克隆抗体 (北京博奥森公司);Trizol Regent(Ambion 公司);Sfrp1和β-actin引物(上海生工生物技术工程服务有限公司);Revert AidTMFirststrand cDNA Synthesis Kit(Thermo Fisher Scientific公司);2×SuperReal PreMix Plus(天根生化科技有限公司)。
1.2 方法
1.2.1 DN模型大鼠复制:模型复制方法参照文献[1-2]。造模前禁食6~8 h,DN组尾静脉注射STZ 55 mg/kg,NC组尾静脉注射等量的无菌柠檬酸-柠檬酸钠缓冲液。72 h后尾静脉采血检测各组大鼠血糖值,以血糖值≥16.7 mmol/L为糖尿病动物模型(DM模型)大鼠复制成功。1周后,对各组大鼠行尿蛋白定性检测,结果阳性视为DN模型构建成功。10周后乙醚麻醉大鼠,处死前1 d称重,留取24 h尿液;股动脉穿刺采血,离心后取血清;0.9% NaCl冲洗肾脏至苍白色,称重并记录肾重(mg)/体质量(g)比值即肾脏指数(kidney index, KI);一侧肾脏固定于4%中性甲醛溶液中行病理学相关检测;另一侧肾于-80 ℃保存备用。
1.2.2 生化指标的检测:氧化酶法测血清葡萄糖(blood glucose, BG)浓度;邻苯三酚比色法测尿蛋白浓度,尿蛋白浓度与24 h尿量乘积为24 h 尿蛋白(24 h urine protein, 24 h UP);酶分析法检测血清肌酐水平。
1.2.3 免疫组织化学染色:按照免疫组织化学染色说明书进行:脱蜡、水化、阻断内源性过氧化物酶、抗原修复、滴加一抗、二抗孵育、DAB显色、复染、梯度乙醇脱水。自然晾干后,用二甲苯稀释后的中性树胶封片,光学显微镜下观察并拍照保存。
1.2.4 细胞的分组:待NRK-52E细胞增殖汇合度至90%时,弃上清,0.25%胰蛋白酶消化,待细胞变圆加入DMEM培养基,吹打均匀,离心,加培养基重悬。将NRK-52E细胞随机分为正常糖组(NG,葡萄糖5.5 mmol/L)、高糖组(HG,葡萄糖30 mmol/L)和高糖加5-Aza-CdR (80 μmol/L)组(5-Aza-CdR组),3组细胞置37 ℃、5% CO2温箱培养48 h,提取蛋白和RNA备用。
1.2.5 Western blot检测蛋白:用BCA蛋白浓度测定试剂盒测蛋白浓度,制备上样蛋白样品,SDS-PAGE分离,并转至PVDF膜,5%脱脂牛奶封闭1 h,一抗孵育,浓度分别为β-actin(1∶4 000)、Dnmt3a(1∶500)、Dnmt3b(1∶500)、Sfrp1(1∶500)、col-Ⅲ(1∶500)及col-Ⅳ(1∶1 000);4 ℃冰箱孵育过夜;1%脱脂牛奶配置的二抗室温孵育1 h,TBST洗膜后,ECL 液显色,Bio-Rad凝胶成像系统扫描检测PVDF膜上的目的蛋白曝光度,Image Lab 5.1图像分析软件分析蛋白信号的相对含量,以β-actin为内参,计算各目标蛋白的相对含量。
1.2.6 RT-qPCR检测mRNA:Trizol法提取各组NRK-52E细胞总RNA,按照RevertAidTMFirststrand cDNA Synthesis Kit说明书反转录cDNA,按照Talent qPCR PreMix(SYBR Green)说明书行RT-qPCR,引物序列见表1。mRNA的相对表达量用2-△△Ct方法分析。
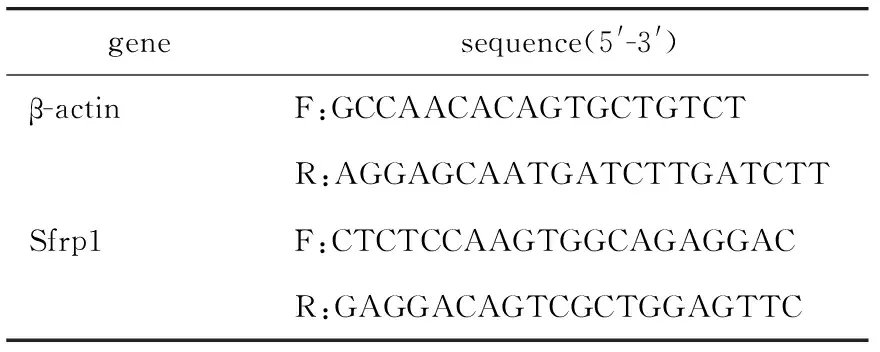
表1 RT-qPCR引物序列Table 1 Sequence of primers used in RT-qPCR
1.3 统计学分析
SPSS17.0和GraphPad Prism5统计软件,数据以均数±标准差(x±s)表示,两组间比较先进行正态性检验,再采用独立样本t检验;相关性分析采用Pearson相关分析。
2 结果
2.1 各组大鼠肾脏指数及相关生化指标
与NC组比较,DN组大鼠KI较高(P<0.05);DN组大鼠BG、24 hUP、肌酐水平较NC组升高(P<0.05)(图1)。提示DN模型大鼠复制成功。

*P<0.05 compared with NC group图1 两组大鼠KI、BG、24 h UP、肌酐水平比较Fig 1 Comparison of kidney index, blood glucose, 24 h urinary protein and creatinine levels between the two groups of rats(x±s,n=8)
2.2 免疫组织化学检测结果
可清晰检测出Sfrp1蛋白在肾脏组织中的表达位置和表达量。可见Sfrp1蛋白阳性表达呈棕红色,细胞核呈蓝色。结果显示,NC组Sfrp1阳性表达主要分布于肾小管上皮细胞,而DN组大鼠Sfrp1表达不明显(图2)。
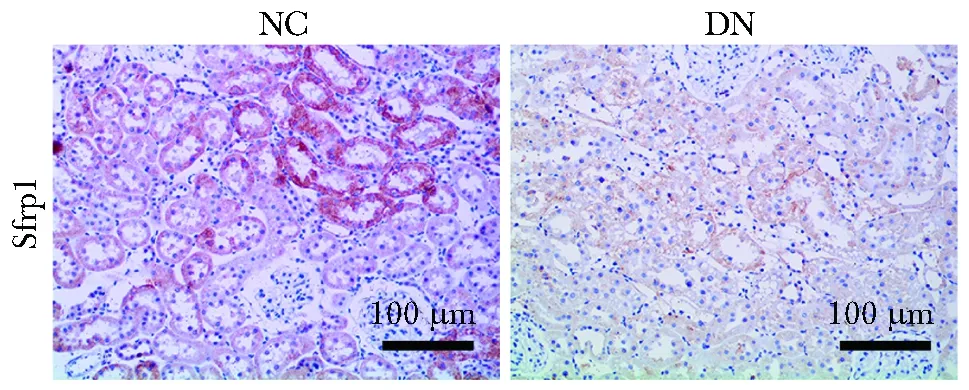
图2 两组大鼠肾脏组织中Sfrp1的表达Fig 2 Expression of Sfrp1 in kidney tissues between the two groups of rats
2.3 5-Aza-CdR干预高糖培养的NRK-52E细胞后,Sfrp1表达恢复
与NC组比,HG组Sfrp1蛋白表达减少(P<0.05),而给予5-Aza-CdR干预后,Sfrp1蛋白表达较HG组增多(P<0.05)(图3)。RT-qPCR结果与蛋白表达水平结果趋向一致(P<0.05)(图4)。

*P<0.05 compared with NC group; #P<0.05 compared with HG group图3 各组细胞中Sfrp1蛋白表达量的比较Fig 3 Comparison of Sfrp1 protein expression in each group(x±s,n=3)

*P<0.05 compared with NC group; #P<0.05 compared with HG group图4 各组细胞中Sfrp1 mRNA 表达量的比较Fig 4 Comparison of Sfrp1 mRNA expression in each group(x±s,n=3)
2.4 5-Aza-CdR干预高糖培养的NRK-52E细胞后,Dnmt3a和Dnmt3b蛋白表达减少
与NC组比,HG组Dnmt3a和Dnmt3b蛋白表达增多(P<0.05),而与HG组比,5-Aza-CdR组Dnmt3a和Dnmt3b蛋白表达减少(P<0.05)(图5)。
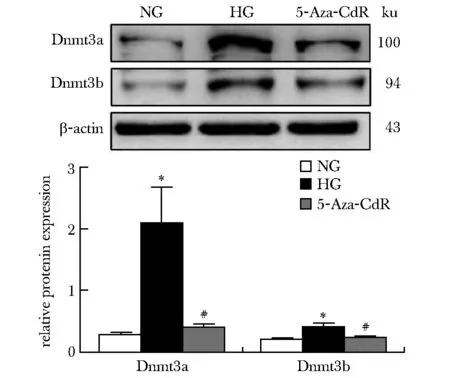
*P<0.05 compared with NC group; #P<0.05 compared with HG group图5 各组细胞中Dnmt3a、Dnmt3b蛋白表达量的比较Fig 5 Comparison of Dnmt3a, Dnmt3b protein expression in each group(x±s,n=3)
2.5 5-Aza-CdR干预高糖培养的NRK-52E细胞后,col-Ⅲ和col-Ⅳ蛋白表达减少
与NC组比,HG组col-Ⅲ和col-Ⅳ蛋白表达增多(P<0.05);而与HG组比,5-Aza-CdR组col-Ⅲ和col-Ⅳ蛋白表达减少(P<0.05)(图6)。

*P<0.05 compared with NC group; #P<0.05 compared with HG group图6 各组细胞中相关蛋白表达的比较Fig 6 Comparison of related proteins expression in each group(x±s,n=3)
2.6 Sfrp1与Dnmt3a、Dnmt3b、col-Ⅲ及col-Ⅳ蛋白表达量呈负相关
肾小管上皮细胞中Sfrp1与Dnmt3a(r=-0.937,P<0.05)、Dnmt3b(r=-0.965,P<0.05)、col-Ⅲ(r=-0.694,P<0.05)及col-Ⅳ(r=-0.888,P<0.05)均呈负相关(图7)。
3 讨论
随着全球人口老龄化的加速,DM已成为影响人类健康的重大问题。DN是DM的主要微血管并发症。研究表明,表观遗传机制所介导的基因调控与DN的发生发展密切相关[8-9]。表观遗传学涉及DNA甲基化、组蛋白修饰、微小RNA、染色质重塑等[10]。近年来DNA甲基化受到研究者的广泛关注。
Dnmts是DNA甲基化过程中的关键酶,通过其催化作用参与DNA甲基化修饰[11-12]。在哺乳动物中,Dnmt1、Dnmt3a和Dnmt3b具有催化活性,其异常表达可影响DNA甲基化水平和后期转录合成[4]。本课题组前期研究结果发现[7],在糖尿病肾脏疾病大鼠肾组织中, Dnmt1、 Dnmt3a、 Dnmt3b、 Dnmt3l表达增高。其中,Dnmt3a和Dnmt3b与Sfrp1的相关性更明显。本次体外实验结果显示Dnmt3a、Dnmt3b与Sfrp1呈负相关,与前期结果一致。

A.correlation between Sfrp1 and Dnmt3a; B.correlation between Sfrp1 and Dnmt3b; C.correlation between Sfrp1 and col-Ⅲ; D.correlation between Sfrp1 and col-Ⅳ图7 Sfrp1与Dnmt3a、Dnmt3b、col-Ⅲ、col-Ⅳ蛋白表达相关Fig 7 Correlation between Sfrp1 and protein expression of Dnmt3a, Dnmt3b, col-Ⅲ and col-Ⅳ
研究发现[13-14],Sfrp1在直肠癌、肾癌等肿瘤疾病中处于高甲基化水平,低表达状态。本次实验以NRK-52E细胞为研究对象,将细胞分为NC、HG和5-Aza-CdR组。结果发现,5-Aza-CdR组Dnmt3a和Dnmt3b表达较HG组降低,且在一定程度上恢复了Sfrp1的表达。同时5-Aza-CdR组NRK-52E细胞纤维化程度降低到接近正常细胞水平,提示Dnmt3a和Dnmt3b可能与Sfrp1甲基化有关,并影响肾脏纤维化的发生。此次实验结果显示col-Ⅲ、col-Ⅳ与Sfrp1呈负相关。提示,Sfrp1表达降低可能导致肾脏纤维化时细胞外基质沉积增多。
综上所述,5-Aza-CdR可能通过抑制Dnmt3a、Dnmt3b的表达,改善肾脏纤维化,其机制可能与抑制Sfrp1甲基化,恢复Sfrp1表达有关,但Dnmt3a、Dnmt3b与Sfrp1的具体作用位点仍需进一步实验研究。
