肠上皮Depdc5/mTORC1信号轴调控小鼠小肠上皮稳态
2022-08-17张新格王庆志杨晨妍熊熙文
张新格,马 洁,王庆志,辛 悦,杨晨妍,熊熙文*
(新乡医学院 1.法医学院; 2.基础医学院 人体解剖与组织胚胎学系, 河南 新乡 453000)
小肠上皮细胞(intestinal epithelial cells, IECs)为被覆于小肠黏膜表面各种不同类型的细胞组成的单层上皮细胞,这些细胞呈指状突入肠腔形成绒毛,凹陷呈杯状下陷深入间质形成隐窝[1]。隐窝基部少量肠道干细胞(intestinal stem cells,ISCs)分裂生成高度增殖的祖细胞,称为短暂扩增(transit-amplifying,TA)细胞,其中分化为吸收细胞(柱状细胞)、分泌细胞(例如杯状细胞、簇细胞)沿着绒毛-隐窝轴向上迁移,调节营养摄取、消化与吸收;而分化为潘氏细胞迁移到隐窝底部,通过分泌防御素等多种抗菌物质,维持肠道微生物的平衡[2]。因此小肠上皮不仅是体内营养物质转运的主要场所,在维持机体内稳态和防止感染、炎性反应中起着至关重要的作用。
哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR)是磷脂酰肌醇激酶相关蛋白激酶家族中的一个丝氨酸/苏氨酸蛋白激酶,具有两个不同的蛋白质复合物的催化亚基,分别称为mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)[3]。NPRL2、NPRL3和DEPDC5共同形成的GATOR1复合物,是mTORC1信号通路的负向调节器[4-5]。 mTOR的汇聚和整合取决于营养、生长因子、能量和环境压力对细胞的刺激信号,通过激活下游信号调节细胞增殖,影响胚胎干细胞和早期胚胎的发育,并且与肿瘤、癫痫、肥胖及代谢紊乱等疾病的发生发展密切相关。Depdc5作为mTORC1上游的抑制基因[6],抑制mTORC1的活性影响机体的代谢,Depdc5敲除介导的mTORC1激活对哺乳动物肠道上皮细胞的影响及调控机制目前尚不清楚。本研究通过用Cre-LoxP系统构建IECs特异性敲除mTORC1上游的抑制基因Depdc5的小鼠,探究Depdc5-mTORC1信号通路过度激活对肠上皮形态、功能、增殖、分化等方面的影响。
1 材料与方法
1.1 材料
1.1.1 动物:Depdc5floxed小鼠源于胚胎干细胞(embryonic stem cell,ESC)细胞系,将其植入囊胚并通过假孕鼠繁育,获取嵌合小鼠,再从嵌合小鼠通过基因鉴定,得到Depdc5floxed小鼠。本研究将Depdc5flox/flox小鼠与villin-Cre小鼠杂交,产生了Depdc5flox/flox:villin-Cre小鼠,简称IKO小鼠(图1)。将Depdc5flox/flox小鼠作为对照组。通过提取小鼠尾巴组织的DNA进行基因型鉴定。实验用鼠均饲养在SPF级动物房。动物实验经新乡医学院实验动物管理委员会审批后进行。

图1 Depdc5flox/flox:Villin-Cre(IKO)小鼠构建Fig 1 Construction of Depdc5flox/flox:Villin-Cre (IKO)mouse
1.1.2 试剂:Actinin抗体(Proteintech公司);PS6、S6抗体(CST公司);DEPDC5、DCLK1、溶菌酶(Lysozyme)、Ki67抗体(Abcam公司);Trizol试剂(Invitrogen公司);Prime ScriptTMRT Master Mix(Perfect Real Time)和 SYBR® Premix Ex TaqTM(TliRNaseH Plus)(Vazyme Biotech公司);山羊抗兔IgG/辣根酶标记(北京中杉金桥生物技术有限公司);cDNA合成试剂盒(TaKaRa公司)。
1.2 方法
1.2.1 动物的分组及处理: 将小鼠分为4组,5只/组,即对照组、IKO组、rap-Ctrl组、rap-IKO组。雷帕霉素(rapamycin) 5 mg(mTORC1的抑制剂)先充分溶解于10 mL DMSO中,再溶于10% PEG和10% Tween-80各1 mL的混合溶液中,以2 mg/kg的剂量通过腹腔注射给药7 d。
1.2.2 Western blot检测肠道组织DEPDC5、S6及PS6蛋白表达:小鼠禁食4 h(即上午9点禁食,13点取材),分别取各组小鼠小肠及结肠组织2 cm研磨后提取蛋白并定量50 μg,在配置好的SDS-PAGE凝胶上分离,转移到NC膜上。5% 脱脂牛奶在室温中孵育1 h,条带分别放入DEPDC5(1∶1 500)、PS6(1∶7 000)、S6(1∶3 000)、actinin(1∶4 000)一抗稀释液中4 ℃孵育过夜。第2天用HRP偶联的二抗(抗兔)室温孵育1 h。洗涤后暗室曝光显影。
1.2.3 RT-qPCR检测小肠组织中Depdc5、Dclk1、Trpm5、Muc2的mRNA表达水平: 取0.5 cm小肠组织采用Trizol提取法提取组织总RNA。利用酶标仪在260 nm处吸光度法来测定RNA浓度,利用紫外分光光度计260/280 nm比值(1.8~2.0)来测定RNA的纯度。使用cDNA合成试剂盒将提取出来的RNA反转为cDNA。采用SYBR Green Master Mix在ABI Step One Plus实时荧光定量PCR系统中进行定量分析。按照如下条件上机:95 ℃,30 s;95 ℃,10 s;60 ℃,30 s,40 个循环。最后使用 2-ΔΔCt方法计算表达水平的倍数变化。RT-qPCR反应所用具体引物见表1。

表1 RT-qPCR反应相关引物Table 1 RT-qPCR related gene primer sequence
1.2.4 免疫组化(immunohistochemical, IHC)染色检测肠道上皮簇细胞、潘氏细胞、增殖细胞:小肠组织经 4 %多聚甲醛固定,常规石蜡包埋、切片,以DCLK1、溶菌酶、Ki67兔抗多克隆抗体作为一抗对标本进行免疫组织化学染色。以高压锅抗原修复,Triton X-100破膜后3%过氧化氢封闭。PBS漂洗5 min后,5%山羊血清封闭1 h,孵育DCLK1(1∶100)、溶菌酶(1∶800)、Ki67(1∶200)4 ℃过夜。第2天滴加山羊抗兔IgG/辣根酶标记二抗孵育1 h,DAB试剂显色。在光学显微镜下分析并拍照,用Image J 软件对簇细胞,潘氏细胞,增殖细胞进行统计分析。
1.2.5 阿尔新蓝染色检测肠道上皮杯状细胞:石蜡切片脱蜡、水化处理后,阿尔新蓝及中性红染色,脱水透明后封片。用Image J 软件对杯状细胞进行统计分析。
1.2.6 苏木精-伊红染色(HE染色)检测组织形态: 石蜡切片脱蜡、水化行HE染色后封片。用 Image J软件对绒毛长度和隐窝深度进行统计分析。
1.3 统计学分析
采用Graph Pad Prism软件进行统计学分析,数据用均数±标准差(x±s)表示,两两比较采用t检验。
2 结果
2.1 IECs特异性敲除Depdc5激活mTORC1信号通路
结果显示(图2A,B),IKO组小鼠小肠、结肠组织中Depdc5的mRNA和蛋白表达均明显低于对照组,并且IKO组小鼠小肠和结肠组织中mTOR信号通路下游靶点磷酸化S6(PS6)的蛋白表达明显高于对照组(P<0.05)(图2B)。
2.2 IKO组小鼠小肠上皮中簇细胞、潘氏细胞和杯状细胞数量减少
IKO组小鼠小肠组织中Dclk1、Trpm5和Muc2的mRNA水平显著低于对照组(P<0.05)(图3A)。同时IHC结果显示IKO小鼠IECs中簇细胞及潘氏细胞的细胞数量均减少约50% (P<0.05)(图3B~C),杯状细胞数量减少约40% (P<0.05)(图3D)。

A.mRNA level of Dclk1, Trpm5, Lysozyme and Muc2 detected by qPCR;B.number of clusters cells detected by IHC staining indicated by the arrow(×200);C.number of Paneth cells detected by IHC staining indicated by the arrow(×400);D.number of goblet cells detected by alcian blue staining dicated by the arrow(×200);*P<0.05,**P<0.01 compared with control group图3 Depdc5敲除后簇细胞、潘氏细胞和杯状细胞数量减少Fig 3 Number of cluster cells, Paneth cells and goblet cells decreased after Depdc5 knockout(x±s,n=5)

A.mRNA level of Depdc5 was detected to evaluate the knockout efficiency in IECs; B.proten level of DEPDC5, PS6 and S6 detected by Western blot;*P<0.01, **P<0.001 compared with control group图2 IECs中Depdc5敲除后mTORC1激活Fig 2 mTORC1 was over-activated after knocking out Depdc5 in IECs (x±s,n=5)
2.3 IKO组小鼠小肠上皮中增殖细胞数目增加
对照组小鼠及IKO组小鼠的小肠绒毛长度(villius height)无差异。IKO小鼠小肠隐窝的深度(crypt depth)较对照组显著增加(P<0.05)(图4A)。细胞增殖标志物Ki67的IHC染色显示,IKO组小鼠隐窝中Ki67阳性细胞数量显著增加(P<0.05)(图4B)。
2.4 Rapamycin通过抑制mTORC1调控IECs的分化
rap-IKO组和rap-Ctrl组小鼠小肠组织中PS6的表达均较Ctrl组明显下降(P<0.05)(图5A),且rap-IKO组小鼠和rap-Ctrl组小鼠小肠隐窝深度无显著差异,两组小鼠IECs中增殖细胞、簇细胞、潘氏细胞和杯状细胞之间的数量差异也消失(图5B~D)。

A.villus length (×200) and crypt depth (×400) detected by HE staining (marked by red line); B.number of proliferating cells deteced by IHC staining (indicated by the arrow) (×400);*P<0.05 compared with control group图4 Depdc5调控细胞的增殖Fig 4 Depdc5 regulates cell proliferation(x±s, n=5)
3 讨论
作为细胞内重要的能量感受蛋白,mTOR信号通路的长期过度活化可促进机体的异常代谢和细胞的异常增殖,因此mTOR信号通路过度激活与肥胖、胰岛素抵抗等能量代谢性疾病及癌的发生发展密切相关[7]。有报道指出高脂高胆固醇饮食、脂肪酸、氨基酸等能量物质均可过度激活IECs中的mTORC1信号通路进而促进IECs中脂滴形成、引起炎性反应、促进IECs的坏死性凋亡及癌变,提示各种外因引起的mTOR信号通路过度激活均可使IECs的生理功能发生紊乱[8-9]。Depdc5敲除介导的mTORC1信号通路过度活化是否可影响IECs的分化仍不清楚,本实验利用Cre/loxp系统建立IECs特异性敲除Depdc5的小鼠模型探究mTORC1过度活化对小肠表型的影响。
在本研究中,IKO组小鼠小肠组织中mTORC1信号通路下游的PS6表达明显上调,提示IKO组小鼠IECs中mTORC1信号通路明显活化。此外本研究发现mTORC1过度活化后小鼠IECs中的杯状细胞、簇细胞及潘氏细胞明显减少,隐窝中增殖细胞明显增多。杯状细胞合成分泌的黏蛋白是构成肠道黏液的主要成分,完整的肠道黏液屏障使IECs免受肠道内容物及病原生物的损伤[10]。IKO组小鼠小肠组织中Muc2mRNA水平减少,IHC结果显示杯状细胞减少,均提示IKO组小鼠肠道黏液屏障功能可能被破坏。有报道指出长期高脂饮食,杯状细胞和潘氏细胞的细胞数量减少,ISCs数量增加并促进肿瘤干细胞池的扩大,增加癌发病率[11]。在本研究中Depdc5敲除介导的mTORC1过度激活小鼠小肠隐窝深度增加,隐窝内增殖细胞增多,增多的增殖细胞是否更易诱发癌变也将在今后进一步探究。上述表型均表明IKO组小鼠IECs稳态被破坏。
为了进一步确认这些表型是因为mTORC1的过度激活所导致,使用mTORC1的抑制剂rapamycin来处理小鼠并分析其表型。发现rapamycin处理后,能基本挽回(rescue)Depdc5敲除所引起的分泌细胞减少及增殖细胞增多等表型。这与另一研究,敲除mTORC1上游的另一负性调节因子Tsc2后发现小鼠IECs中杯状细胞和潘氏细胞的数量明显减少较相似[12],上述研究均表明IECs的分化与mTORC1的过度活化相关。但本研究发现肠道干细胞分化为簇细胞的数目也减少。
本研究表明Depdc5敲除介导的mTORC1信号通路的过度活化是导致IKO组小鼠肠道表型改变的主要原因。本研究的发现或许有助于进一步理解肠道疾病的发病机制,为研究肠道疾病的发生发展及治疗提供了新的角度。
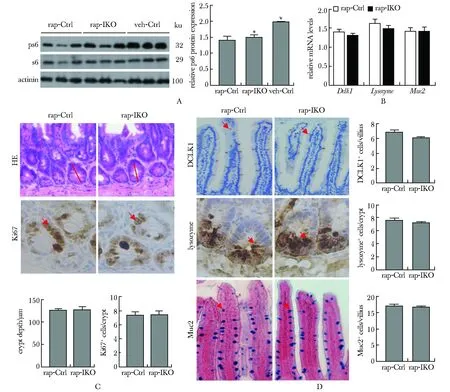
A.expression of PS6 detected by Western blot;B.mRNA level of Dclk1, Lyz1 and Muc2 detected by qPCR;C.depth of the crypts detected by HE staining (marked by the red line); the number of proliferating cells detected by IHC staining (shown by the red arrow) (×400) (on the bottom);D.number cluster cells (×200), Paneth cells (×400) deteced by IHC staining and the number of goblet cells (×200) deteced by Alcian blue staining (shown by the red arrow);*P<0.05 compared with rapamycin control group图5 雷帕霉素抑制mTORC1调控IECs的分化Fig 5 Rapamycin inhibited mTORC1 to regulate the differentiation of IECs(x±s, n=5)
