PTOV1表达水平对结直肠癌患者预后的影响
2022-08-17谢思安陈奕阳徐俊玄宁婷婷朱圣韬张澍田
谢思安,陈奕阳,徐俊玄,宁婷婷,张 楠,朱圣韬,张澍田*
(首都医科大学北京友谊医院 1.消化内科; 2.检验科,北京 100050)
结直肠癌(colorectal cancer,CRC)是全球范围内常见的恶性肿瘤之一,也是全球因肿瘤死亡的主要原因之一[1]。根据2020年全球癌统计,CRC已成为全球第三大最常见肿瘤,也是癌相关死亡的第二大原因。尽管CRC诊断方法和治疗战略不断改进,但2020年仍造成全球约93万人死亡[2]。鉴于CRC早期临床症状不明显,因此寻找新的敏感的CRC诊断生物标志物有助于早期诊断和评估疾病预后。
前列腺肿瘤过表达1(prostate tumor over-expressed 1,PTOV1)是2001年在前列腺癌组织过表达基因差异筛查项目中首次发现的新基因。因其在正常前列腺组织中基本未检出或表达极低,而在前列腺癌组织中高度表达,故命名为PTOV1[3]。在前列腺癌中,PTOV1表达水平与细胞增殖指数呈正相关,是影响前列腺癌进展的关键因素。同时,在侵袭性较强的肿瘤中,PTOV1的表达水平与肿瘤分级及预后相关,提示该蛋白可能是肿瘤侵袭性疾病的一种新的标志物[4]。然而,PTOV1在CRC中的差异表达及临床意义尚不清楚。
本研究基于生物信息学和生物学实验验证分析发现,在结直肠癌组织和细胞系中,PTOV1的表达异常升高且与CRC患者不良预后相关,并通过细胞实验探讨PTOV1表达水平对CRC细胞增殖能力的影响,为CRC的早期诊断和治疗提供新的生物标志物和治疗靶点。
1 材料与方法
1.1 材料
1.1.1 实验材料: DMEM高糖培养基(Hyclone公司);胎牛血清及0.25%胰蛋白酶(Gibco公司);蛋白分子质量标志物、BCA蛋白定量试剂盒及Trizol(Thermo Fisher Scientific 公司);Lipofectamine2000转染试剂、OPTI-MEM培养基(Invitrogen 公司);青链霉素混合液(华中海威公司);siRNA(苏州吉玛生物科技有限公司);M-MLV反转录酶(Promega 公司); 2×SYBR Mix(康润诚业公司);引物(上海生工生物工程股份有限公司);RIPA裂解液(北京碧云天公司);EdU检测试剂盒(CellLight 公司);抗GAPDH抗体、抗PTOV1抗体(Proteintech公司)。
1.1.2 细胞系: 人正常结肠上皮细胞系NCM460、结肠癌细胞系HCT116、HT29、SW480、HCT15和RKO(中国科学院细胞型库及上海生物化学与细胞生物学研究所)。
1.2 方法
1.2.1PTOV1在CRC组织及细胞系中的表达分析: 由UCSC Xena数据库中获得包括mRNA测序数据和患者临床信息的TCGA-COADREAD数据集,包含638例CRC组织和51例癌旁组织中的mRNA表达数据,用以分析PTOV1在结直肠癌组织及正常对照组织间的表达差异。由GEO数据库中获得GSE6988和GSE20842数据集,2个数据集分别包含53、65个结直肠癌组织和28、65个癌旁组织。由表达图谱数据库获取59种不同的CRC细胞系中的表达数据,用以分析PTOV1在不同细胞系中的表达差异。
1.2.2PTOV1在CRC中的表达与预后分析: 基于TCGA-COADREAD数据库的mRNA表达数据和对应的临床数据信息,根据PTOV1表达中位值分为高表达组和低表达组,绘制K-M生存曲线,用以评价PTOV1对结直肠癌患者预后的影响。使用SPSS26.0软件建立PTOV1表达量以及临床病理特征与结直肠癌患者总生存期的多因素回归模型,筛选出对CRC患者预后有显著影响的因素。
1.2.3 细胞系培养及siRNA转染处理:将细胞系培养于含10%胎牛血清及青链霉素的高糖DMEM培养基中,每2~3 d传代1次。应用实验的细胞系在细胞解冻后传代至少2代。使用Lipofec-tamine2000转染试剂和100 nmol/L siRNA转染。siRNA序列如下:siRNA-PTOV1:5′-GAGCAGGAGC AACAGCAAC-3′,siNC:5′-UGCUGUUGCUCCUGC UCCA-3′。
1.2.4 RT-qPCR检测 mRNA: 使用Trizol提取总RNA,按照说明书进行反转录,7500Fast实时热循环仪进行RT-qPCR。以GAPDH为内参,使用2- △△Ct方法评估mRNA的相对表达。引物序列如下:PTOV1:5′-GAAGATGCAATGACCGGGGA-3′,5′-CT AAAGCCCATGTAACCCTCTG-3′;GAPDH:5′-GGAG CGAGATCCCTCCAAAAT-3′,5′-GGCTGTTGTCATAC TTCTCATGG-3′。
1.2.5 Western blot检测蛋白:使用RIPA细胞裂解液收集并裂解细胞,提取总蛋白。测定蛋白浓度并调匀各样本蛋白浓度后,将等量的蛋白加入各泳道。经PTOV1、GAPDH抗体及同种属第二酶标抗体孵育后,使用凝胶成像分析仪采集图像。
1.2.6 集落形成检测细胞增殖能力:转染后的细胞以5×102个/孔接种于6孔板上培养14 d。4%多聚甲醛固定后,使用0.5%的结晶紫孵育30 min。随后使用菌种计数仪观察获取图像,用IMAGEJ软件对图像进行计数。
1.2.7 EdU形成检测细胞增殖能力:CRC细胞系接种于24孔板上,按照EdU 染色试剂盒操作说明书进行Apollo染色,使用 Hoechst 33342在黑暗中染色后,荧光显微镜观察细胞荧光并拍照。IMAGEJ软件计算Apollo/Hoechst阳性率。
1.3 统计学分析
本文实验数据采用GraphPad Prism 5软件进行统计分析和可视化。实验数据使用均数±标准差(x±s)表示,并采用配对样本t检验分析数据。
2 结果
2.1 PTOV1在结直肠癌中表达水平的生物信息学分析
基于TCGA结直肠癌转录组数据集中638例结直肠癌组织和51例癌旁组织数据分析显示:结直肠癌组织中PTOV1表达显著下调 (图1A),在51组配对结直肠癌与癌旁组织中,PTOV1在结直肠癌组织中的mRNA表达显著低于癌旁组织(图1B)。GEO数据库中获取了2个结直肠癌的基因表达数据集均显示,CRC组织中PTOV1mRNA表达显著上调(图1C~D)。在59个结直肠癌细胞系中,PTOV1呈高表达状态(图1E)。
2.2 PTOV1在结直肠癌细胞系中高表达
与正常结肠上皮细胞系相比,结肠癌细胞系中的PTOV1的蛋白和 mRNA水平均显著上调(图2A~B)。
2.3 PTOV1在结直肠癌中的表达与预后分析
PTOV1的表达水平与CRC患者的总体生存时间(overall survival, OS)、 无病生存时间(disease-free survival,DFS)和无进展生存时间(progression-free survival,DFS)呈现显著负相关性(P<0.05),高水平的PTOV1与CRC患者不良预后相关。多因素Cox生存分析显示,年龄、T分型和PTOV1表达是CRC患者不良预后的独立预测因素(P<0.05)(图3)。综上,PTOV1是一个预后不良因素和独立的预后标志。

A.PTOV1 mRNA expression levels in CRC and normal tissue samples analyzed in the TCGA databases; B.PTOV1 mRNA expression levels in CRC and paired normal tissue samples analyzed in the TCGA databases; C,D.PTOV1 mRNA expression levels in CRC and normal tissue samples analyzed in the GEO databases; E.PTOV1 expression in 59 different colorectal cancer cell lines, *P<0.001; PTOV1.prostate tumor over-expressed 1; CRC.colorectal cancer图1 PTOV1在结直肠癌中表达水平的生物信息学分析Fig 1 Bioinformatics analysis of PTOV1 expression in colorectal cancer

A,B.protein and mRNA expression of PTOV1 in colorectal cancer cells lines (HT29, HCT116, RKO, SW480 and HCT15) and normal colon endothelial cell line (NCM460); *P<0.05 compared with NCM460;PTOV1.prostate tumor over-expressed 1图2 PTOV1在结直肠癌细胞系中高表达Fig 2 High expression level of PTOV1 in colorectal cancer cell lines
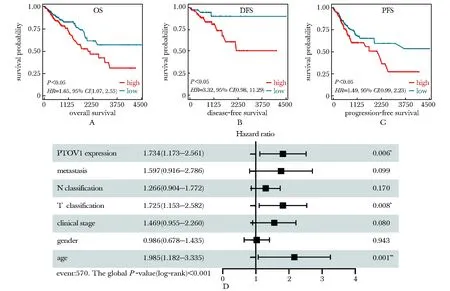
A-C.survival curves of OS, DFS and PFS in the colorectal cancer (n=368, n=132, n=363); D.forest plot illustrated the results of multivariate cox regression analyses; PTOV1.prostate tumor overexpressed 1; OS.overall survival; DFS.disease-free survival; PFS.progression-free survival图3 PTOV1对结直肠癌预后的影响Fig 3 Prognosis capability of PTOV1 in colorectal cancer
2.4 敲低PTOV1表达抑制CRC细胞增殖
通过转染特异性siRNA,在使得PTOV1在SW480细胞中表达降低 (图4A~B)。PTOV1表达降低可抑制细胞增殖率,与正常对照组相比,敲低PTOV1表达组的集落数量和EdU阳性细胞明显减少(图4C~E)。上述结果表明PTOV1作为一种致癌基因促进了CRC细胞增殖。
3 讨论
结直肠癌作为世界范围内的恶性肿瘤之一,由于CRC早期缺乏特异性的临床症状或有效的生物标志物,所以其预后较差[5]。虽然内镜筛查的普及和可用的多模式治疗显著提高了CRC患者的生存时间,但治疗结果和预后仍不令人满意。因此,寻找特异性和敏感性高的预后生物标志物是结肠直肠癌早期发现和辅助治疗的最有效途径之一。
PTOV1作为癌基因在前列腺癌组织中的表达显著升高,其表达水平与前列腺癌预后和进展显著相关。在近年来的研究中,肝癌、乳腺癌、食管癌、宫颈癌等多种肿瘤均显示,肿瘤组织中PTOV1表达明显增高,作为预后的肿瘤生物标志物和癌蛋白,在肿瘤发展过程中发挥着重要作用[6-8]。此外,在侵袭性较强的肿瘤中,PTOV1表达水平与肿瘤分级及预后相关,提示该蛋白是多种肿瘤潜在的预后标志物[9],然而PTOV1在结直肠癌中的作用还尚未阐明。本研究表明,PTOV1在结直肠癌中表达显著升高并且与结直肠癌患者的不良预后相关。这提示PTOV1可能是结直肠癌潜在的致癌基因或重要的预后因素,并在CRC进展过程中起到重要的调控作用。
多项研究表明,PTOV1是一种有丝分裂蛋白,以周期依赖的方式在细胞核和细胞质之间穿梭,在细胞周期调控中起决定性作用[10]。在静息状态下,PTOV1主要位于核周。在S期初期,PTOV1部分转位到细胞核,而在有丝分裂末期,PTOV1离开细胞核[11]。此外,也有报道称,PTOV1通过激活Wnt/β-catenin、NF-kappa B和cJUN通路促进肿瘤细胞增殖[8,12]。本研究中发现抑制PTOV1表达显著抑制CRC细胞集落形成数及EdU阳性细胞数,降低CRC细胞增殖能力。这一发现也进一步证实PTOV1是细胞增殖过程中调控分子。但PTOV1调控CRC细胞增殖的分子机制还有待进一步探索。

A,B.the protein and mRNA expression level of PTOV1 in SW480 cells with transfected PTOV1 siRNA; C.colony formation assays of SW480 after PTOV1 knockdown; D,E.representative image of EdU incorporation and quantification of EdU-positive cells treated by PTOV1 knockdown; scale bar=200 μm; *P<0.05 compared with NC; PTOV1.prostate tumor over-expressed 1图4 PTOV1促进结直肠癌细胞增殖Fig 4 PTOV1 facilitated CRC cell proliferation
综上,本研究综合生物信息学分析和生物学实验验证PTOV1是一个与结直肠癌预后不良相关的癌基因,可能与其促进CRC细胞增殖相关,这一发现为进一步研究PTOV1在结直肠癌发生发展中的调控作用提供了新的视角与线索。
