miR-499通过靶向TGF-α抑制人骨肉瘤细胞系Saos2迁移和促凋亡
2022-08-17邱明宪张慧荣张金萍张清泉
王 磊,邱明宪,张慧荣,张金萍,赵 静,康 肖*,张清泉
(1.河北省衡水市第四人民医院, 河北 衡水 053000; 2.河北省衡水市人民医院, 河北 衡水 053000)
骨肉瘤(osteosarcoma,OS)是儿童、青少年较常见的高度恶性肿瘤[1],近年来,随着医疗水平的发展,骨肉瘤的治疗手段得到了一定提高,但是预后仍然差强人意,5年内生存率低于30%[2]。其发病机制的分子机制也未得到充分的探讨。
微小RNA(microRNA,miRNA),其属于内源性的非编码RNA,通过与目标基因 mRNA 的3′-UTR 区域部分序列互补相结合,参与调控多种生物学进程[3]。近年来miRNA功能调控为骨肉瘤治疗提供了新的研究方向,在骨肉瘤发展过程中,已证实多种miRNA与其发生发展相关,其中miRNA-206通过靶向Notch3抑制骨肉瘤的转移[4];过表达miRNA-188-5p能明显抑制骨肉瘤细胞增殖能力,阻滞细胞周期的进展[5],多种miRNA已经证实与骨肉瘤的发病机制有关,在这些miRNAs中,目前 miR-499在骨肉瘤恶性增殖和远处转移中的确切生物学功能尚不清楚。转化生长因子-α(transforming growth factor-α,TGF-α)作为表皮生长因子受体(epithelial growth factor receptor,EGFR)的配体,据报道TGF-α基因与许多类型的癌有关[6]。本研究初步证实了miR-499以及靶基因TGF-α对骨肉瘤细胞的生物功能调控作用,揭示了miR-499作为抗癌因子在骨肉瘤中的调控机制。
1 材料与方法
1.1 材料
1.1.1 样本及动物:组织样本采集自衡水市第四人民医院经病例确诊的28例骨肉瘤手术患者手术切除的肿瘤标本及癌旁组织标本,研究中所有样本均得到了本院伦理委员会批准(2020)伦审第(53)号,并已取得了患者的知情同意;SPF级BALB/c裸鼠28只,4~9周,体质量15~20 g。
1.1.2 试剂(盒):人骨肉瘤细胞系(Saos2中国科学院上海细胞库);RT-qPCR试剂盒、BCA蛋白质分析试剂盒、R转录试剂盒[自赛默飞世尔科技(中国)有限公司];Transwell 小室(Coring公司);TGF-α抗体、GAPDH抗体(内参)、Ki67抗体、辣根过氧化物酶标记的二抗(Abcam公司)。
1.2 方法
1.2.1 细胞的分组及处理:使用含10%胎牛血清,100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基,培养人成骨肉瘤细胞系(Saos2)。转染前24 h将增殖状态良好的细胞接种密度按5×105个/孔接种于6孔板,随后参照转染试剂LipofectamineTM2000 试剂说明书对细胞进行转染。
1.2.2 RT-qPCR检测TGF-α的mRNA水平:使用Trizol从细胞系或组织中提取总RNA,总RNA经R转录试剂盒合成cDNA,其中U6为miR-499的表达水平的内参,GAPDH为TGF-α的mRNA表达水平的内参,参照RT-qPCR试剂盒制造商指示,进行PCR反应,RT-qPCR结果以2-△△Ct值形式得到。
1.2.3 Western blot检测TGF-α蛋白:用放射免疫沉淀法缓冲液从组织或细胞中分离总蛋白,蛋白浓度采用BCA法检测,等量(40 μg)提取的蛋白用10% SDS-PAGE分离,然后蛋白转至PVDF膜上,5%的奶粉(脱脂)于37 ℃封闭1 h。加入一抗TGF-α抗体(1∶500),GAPDH抗体(1∶1 000),其中GAPDH为内参。4 ℃,过夜。加入辣根过氧化物酶标记的兔二抗(1∶1 000),室温孵育1 h。TBST洗涤3次,加入显影剂1 min,然后使用ImageJ2X软件进行免疫印迹分析。
1.2.4 双荧光素酶报告基因实验: 通过TargetScan发现miR-499在TGF-α基因3’-UTR上的潜在结合位点,构建TGF-α野生型3′-UTR荧光素酶报告基因质粒pMIR-TGF-α-wt和突变型报告基因质粒pMIR-TGF-α-mut,将野生型或突变型报告基因质粒与miR-NC、miR-499 mimic、NC-inhibitor或miR-499抑制剂共转染进Saos2细胞。转染24 h后,测量各组细胞的荧光素酶活性。
1.2.5 免疫组化检测TGF-α蛋白: 将骨肉瘤组织和癌旁组织置于65 ℃烤片,梯度脱蜡、水化。进行抗原修复。加入5%的正常羊血清封闭15 min。加入5%的正常羊血清封闭15 min。随后加入一抗TGF-α抗体(1∶100)、Ki67抗体(1∶100),4 ℃过夜。加二抗(1∶200),37 ℃孵育30 min。采用DAB显色后,苏木精室温复染2 min,而后进行脱水和中性树脂封片。采用正置显微镜观察切片。
1.2.6 Transwell侵袭实验检测Saos2细胞迁移: 转染后,收集各组细胞,Matrigel凝胶于4 ℃条件下过夜,将Saos2细胞浓度调整为1×106个/mL。在上室加入100 μL细胞悬液;将含有10%的胎牛血清600 μL培养基添加到下室中;然后于恒温箱中孵育24 h。将小室置于95%乙醇中固定 5 min;染色(0.5%结晶紫溶液)10 min后,用棉签轻轻擦拭滤膜上层细胞后显微镜下观察该膜下层细胞。
1.2.7 TUNEL实验检测Saos2细胞凋亡: 在4%多聚甲醛中固定各组人成骨肉瘤细胞系Saos2细胞30~60 min,在0.3% H2O2中孵育(37 ℃,20 min),采用PBS清洗3次后滴入50 μL的生物素标记溶液,孵育(37 ℃下60 min)。结束后清洗(PBS)1次,滴加0.1~0.3 mL标记反应终止液,37 ℃,30 min,滴加DAB(0.2~0.5 mL)显色液,苏木精染色液染色细胞核。用95%乙醇脱水5 min,随后于无水乙醇中脱水2次(3 min/次),最后甲苯透明 2次(5 min/次),显微镜下观察切片。
1.2.8 构建骨肉瘤裸鼠移植瘤模型: 将裸鼠随机分为miR-NC组(n=7),miR-499 mimic组(n=7),NC-inhibitor组(n=7)和miR-499 inhibitor组(n=7)。Saos2细胞转染后,调整细胞浓度为5×107个/mL,使用注射器向每只裸鼠右后肢腋部注射1×107个/只细胞悬液,21 d后腹腔注射水合氯醛麻醉(0.01 mL/g体质量)并引颈脱臼处死裸鼠,从皮下去除其肿瘤组织及甲醛固定。
1.3 统计学分析
本研究所有数据使用SPSS Statistics 22.0统计软件进行统计学分析,数据以均数±标准差(x±s)表示,两组数据间的比较采用t检验,3组或3组以上的比较采用One-way Anova。
2 结果
2.1 骨肉瘤组织中miR-499和TGF-α的表达水平差异
与癌旁组织相比,骨肉瘤组织中miR-499的表达显著降低(P<0.01),而TGF-α的mRNA表达则相反显著升高(P<0.01)。TGF-α蛋白在骨肉瘤组织中蛋白表达和阳性信号明显高于癌旁正常组织(P<0.01)。TGF-α可能是miR-499的靶基因(P<0.01)。miR-499模拟物或抑制物转染成功(P<0.01)双荧光素酶报告基因实验发现,pMIR-TGF-α-wt质粒与miR-499模拟物共转染进Saos2细胞时,荧光素酶活性明显降低。而转染miR-499抑制物则能明显增强pMIR-TGF-α-wt质粒的荧光素酶活性(图1)。
2.2 miR-499抑制TGF-α促进Saos2细胞的生物学功能
TGF-α促进了Saos2细胞迁移(P<0.01),抑制细胞凋亡(P<0.01),而miR-499模拟物则显著抑制了Saos2细胞迁移(P<0.01),促进了细胞凋亡(P<0.01)。共转染miR-499+TGF-α后,细胞数量相比Saos2组有所降低,同时Saos2细胞凋亡率明显增加(P<0.01)(图2)。
2.3 miR-499和TGF-α在骨肉瘤裸鼠移植瘤模型中的调控机制
miR-499过表达可下调TGF-α mRNA的蛋白表达,而miR-499抑制物则结果相反,增强TGF-α mRNA和蛋白的表达水平(图3)。miR-499 模拟物组可明显抑制骨肉瘤的生长且瘤中TGF-α的阳性指标显著减少,而miR-499抑制剂可明显促进骨肉瘤的生长且TGF-α的阳性指标显著增加(图4)。
3 讨论
在骨肉瘤中miRNAs通过调控靶基因起到抑癌或者促癌作用[7]。与健康志愿者相比骨肉瘤患者血清中miR-411表达相对较高,并且上调miR-411可以促进骨肉瘤细胞的增殖迁移[8]。另外一项研究则发现miR-646在骨肉瘤中发挥抑癌作用,同时过表达miR-646可以抑制细胞增殖、迁移和侵袭[9]。多项研究已经探究了miRNA在骨肉瘤中的调控机制,本研究首次发现miR-499在骨肉瘤组织中呈现低表达,在以往的研究中,miR-499可以抑制肝细胞癌HepG2细胞的侵袭和迁移[10],但暂时尚未发现miR-499在骨肉瘤中的相关报道。
miRNAs根据其调控肿瘤中靶基因的不同,从而发挥促癌或抑癌作用,因此探究miR-499的潜在靶基因,是明确miR-499在骨肉瘤中的工作机制的重要环节[11]。本研究通过生信软件发现miR-499在TGF-α的3′-UTR上具有潜在的结合位点,发现TGF-α是一种癌基因。并采用双荧光素酶报告基因实验的结果也证实了TGF-α确为miR-499的靶基因,且在体内实验中验证了miR-499能负调控TGF-α mRNA和蛋白表达水平。在骨肉瘤相关研究中TGF-α在骨肉瘤异常高表达并且受miRNA-376c调控[12],这与本研究结果类似,本研究发现TGF-α可以促进人骨肉瘤细胞Saos2迁移能力并抑制凋亡率。
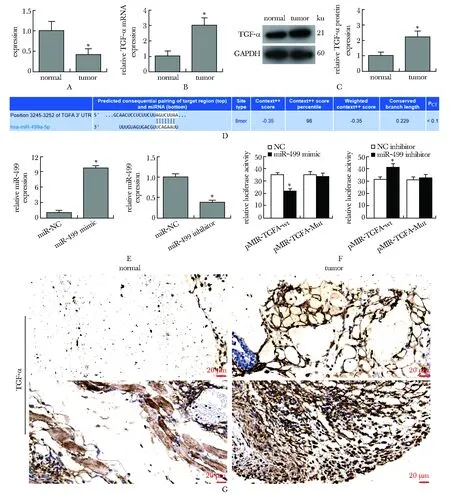
A,B.RT-qPCR was used to detect the expression of miR-499 and TGF-α mRNA in osteosarcoma and normal adjacent tissues; C.Western blot was used to detect TGF-α protein expression; D.TargetScan performs bioinformatics prediction; E.miR-499 was transfected; F.double luciferase reporter gene assay; G.the expression of TGF-α in tumor tissues was higher than that in normal adjacent tissues, the upper and lower figures show the positive expression of TGF-α in the tissues of different research subjects, and the positive degree is different. The percentage of TGFA antibody-positive cells in the lower figure is significantly higher, suggesting that the protein expression and positive signal of TGF-α in osteosarcoma tissues are enhanced;scale bar=20 μm; *P<0.01 compared with normal图1 骨肉瘤组织中的表达变化Fig 1 Expression changes in osteosarcoma tissues
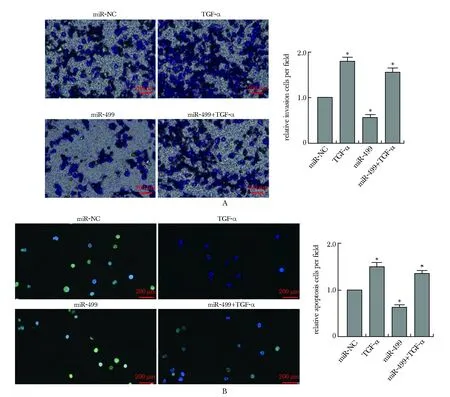
A.Transwell was used to detect the cell migration; B.UNEL assay was used to detect the apoptosis rate of cells;scale bar=200 μm; *P<0.01 compared with miR-NC图2 miR-499/TGF-α轴对Saos2细胞生物学功能调控Fig 2 miR-499/TGF-α axis regulated the biological function of Saos2 cells
肿瘤的发生过程源于原癌基因激活以及抑癌基因突变,因此从细胞水平探究人骨肉瘤细胞增殖、迁移等恶性生物学行为,对于诊断以及控制癌细胞进展有重要意义。因而本研究将进一步深入探究miR-499在骨肉瘤中的作用。体外细胞实验中发现,miR-499能有效的抑制骨肉瘤Saos2的迁移和促进癌细胞凋亡,而TGF-α则恰恰相反促进了Saos2迁移能力和抑制了凋亡率,同时miR-499抑制TGF-α作为癌基因的调控作用,miR-499抑制了TGF-α的促进迁移和抑制凋亡的作用,初步证实了miR-499通过负调控TGF-α在骨肉瘤中发挥抑制作用。
综上所述,miR-499/TGF-α轴参与骨肉瘤的发生发展,抑制骨肉瘤Saos2细胞迁移和促进凋亡,致力于为骨肉瘤诊断、治疗提供新方向。

A,B.TGF-α mRNA expression was detected by RT-qPCR; C,D.expression of TGF-α protein was detected by Western blot;*P<0.01 compared with miR-NC图3 miR-499/TGF-α轴的调控机制Fig 3 Regulatory mechanism of miR-499/TGF-α axis

A.tumor growth curve of each group; B.tumor weight of mice in each group; C.immunohistochemistry of osteosarcoma xenograft in nude mice; scale bar=200 μm, *P<0.01 compared with miR-NC图4 miR-499 mimic和miR-499抑制剂对裸鼠移植骨肉瘤的影响Fig 4 Effects of mir-499 mimic and mir-499 inhibitor on osteosarcoma transplantation in nude mice
