红景天苷通过调控PI3K/AKT/Nrf2通路对高糖诱导的心肌细胞的保护作用及机制研究
2022-09-07翁菲菲冯文化郭青榜李如男李强
翁菲菲,冯文化,郭青榜,李如男,李强
糖尿病是世界范围内发病和死亡的主要原因,并增加了心血管并发症的风险[1]。持续高糖状态可引起氧化应激、炎症、内质网应激、细胞凋亡等,导致心脏收缩和舒张功能障碍以及糖尿病性心肌病的发生[2]。最近在糖尿病动物模型中的研究表明心肌细胞功能下降是心力衰竭的重要中介机制[3]。因此,保护心肌细胞在糖尿病心肌病的治疗中具有重要的作用。红景天苷(SAL)是被誉为“高原人参”的传统藏药红景天的主要有效成分之一,其具有抗氧化应激、抗衰老、抗炎、调节免疫等多种药理作用[4]。近年来,其对中枢神经系统、心血管系统、肝肾、肿瘤的作用也备受关注[5]。张彦燕等[6]研究发现SAL能够抑制高糖诱导的平滑肌细胞表型转化。磷脂酰肌醇-3激酶(PI3K)/蛋白激酶b(AKT)信号通路参与细胞增殖、分化、凋亡和葡萄糖转运等过程,与扩张型心肌病的发生发展密切相关。此外PI3K/AKT通路的激活可能导致核因子促红细胞生成素2相关因子2(Nrf2)表达上调,是一个重要的抗氧化途径[7]。然而,SAL的保护作用是否通过PI3K/AKT/Nrf2信号通路介导尚不清楚。因此,本研究旨在探讨PI3K/AKT/Nrf2信号通路在SAL预防高糖诱导的心肌损伤中的作用,以期为SAL防治糖尿病心肌病的药理学活性提供实验依据。
1 材料和方法
1.1 实验细胞大鼠心肌细胞株 H9c2购自中国科学院上海细胞库。
1.2 实验材料红景天苷(S A L i d r o s i d e,SAL)购自南京郎朗科技销售公司,批号:10339-51-9,质量分数≥98.0%;特异性PI3K抑制剂LY294002(批号:NSC293100)购自美国 MedChemExpress公司;Dulbecco改良Eagle高糖培养基(DMEM)、葡萄糖购自美国 Sigma公司;CCK-8 试剂盒、2',7'-二氯荧光素二乙酸酯(2',7'-dichlorofluorescein diacetate,DCFH-DA)购自美国Sigma-Aldrich公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和半胱天冬酶-3(caspase-3)检测试剂盒购自南京建成生物工程研究所;RIPA细胞裂解液、蛋白酶抑制剂、蛋白定量试剂盒购自美国Thermo Fisher Scientific公司;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)凋亡检测试剂盒购自瑞士Roche公司;免疫印迹一抗磷酸化 (p)-AKT(Ser473)、AKT、糖原合成酶激酶3β(GSK-3β)、p-GSK-3β(Ser256)、Nrf2购自美国ABGENT公司;免疫印迹二抗IgG 购自Abcam公司。
1.3 实验方法
1.3.1 细胞培养与分组将H9c2心肌细胞置于在DMEM培养基(含有10%胎牛血清)中,在95%空气和5%CO2、饱和湿度、37℃的环境中培养。每隔2~3 d更换新鲜培养基,当细胞接近80%时传代至新的培养基。将H9c2细胞分为空白组、高糖组、高糖+SAL组、高糖+SAL+LY294002组。空白组细胞用含有5.5 mmoL/L葡萄糖的细胞培养液常规培养;其余3组细胞用含有33.3 mmoL/L葡萄糖的细胞培养液培养;另外高糖+SAL组在更换为高糖培养液前2 h加入29.6 mmol/L SAL进行预处理。而高糖+SAL+LY294002组则在加入SAL前加入10 μmol/L LY294002预处理2 h。
1.3.2 细胞增殖活性检测取常规DMEM培养液常规培养H9c2细胞接种在96孔板中(3000个/孔),分别加入不同浓度的SAL(终浓度:0、1.09、3.29、9.87、29.6、88.8、266.4 mmol/L)[8],培养2 h后,更换为含有正常葡萄糖(5.5 mmoL/L)或高糖(33.3 mmoL/L)的培养液,于37 ℃、体积分数为5%CO2培养箱中继续培养24 h,每孔加入10 μl CCK-8溶液,混匀,继续孵育4 h后,终止培养,弃去培养液,于490 nm波长下测吸光度值(OD)。计算细胞存活率(%)=(OD实验组/OD空白组)×100%
1.3.3 细胞凋亡情况检测使用TUNEL凋亡检测试剂盒对H9c2细胞的凋亡情况进行荧光检测。各组H9c2细胞进行爬片,用4%多聚甲醛固定后,加入TDT溶液37℃避光孵育60 min,而后用PBS缓冲液冲洗2次,各10 min。与DAPI(蓝色)融合的TUNEL阳性细胞(绿色)为凋亡细胞。
1.3.4 细胞内氧化应激标志物检测收集各组经处理后的细胞(1500 r/min离心10 min),用含有蛋白酶抑制剂的裂解缓冲液裂解细胞制备成10%的细胞匀浆,放置在-20℃,反复冻融3次,用显微镜观察细胞是否完全破碎,如不完全则继续冻融2次,再以4000 r/min离心15 min。BCA法定量蛋白浓度,用试剂盒检测MDA、SOD、GSH-Px3含量。
1.3.5 ROS含量检测各组心肌细胞离心后用含有蛋白酶抑制剂的裂解缓冲液裂解并收集上清液,加入10 μmol/L的DCFH-DA溶液于37℃避光孵育1 h,用流式细胞仪检测在500 nm和525 nm的激发和发射波长下DCF的荧光值,每个样本至少分析3×104个细胞,结果表示为空白组的平均荧光强度(MFI)的倍增变化。
1.3.6 蛋白免疫印迹法(western blot)用预冷的R I P A 裂解液提取各组心肌细胞总蛋白后,将蛋白通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到聚偏氟乙烯膜上。用5%脱脂牛奶封闭1 h后,将膜与针对p-AKT(Ser473)(1:250)、AKT(1:250)、p-GSK-3β(Ser256)(1:1000)、GSK-3β(1:1000)、Nrf2(1:2000)和β-actin(1:2000)的一抗在4℃下孵育一夜,用免疫印迹二抗IgG孵育。采用增化学发光法(ECL)对蛋白条带进行灰度扫描分析,以β-actin为内参检测各组蛋白的相对表达量。
1.4 统计学处分析采用SPSS 19.0统计软件进行分析,实验结果以平均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 SAL对高糖作用下心肌细胞H9c2增殖活性的影响在正常糖环境下,SAL对H9c2细胞存活率几乎无影响(P>0.05)。在高糖环境下,与空白组相比,高糖组H9c2细胞的存活率显著降低(P<0.05);加入不同浓度SAL预处理后,H9c2细胞的存活率较高糖组升高(P<0.05),且呈剂量依赖性;但当SAL浓度≥29.6 mmol/L时,H9c2细胞的存活率变化不明显,故选择29.6 mmol/L浓度用于后续实验,图1。
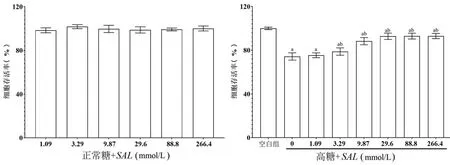
图1 SAL对正常糖或高糖环境下心肌细胞H9c2存活率的硬性
2.2 高糖作用对H9c2心肌细胞PI3K/AKT通路的影响经western blot法检测,与空白组相比,高糖组细胞p-AKT/AKT蛋白相对表达量降低(P<0.05),图2。

图2 高糖作用对H9c2心肌细胞PI3K/AKT通路相关蛋白磷酸化的影响
2.3 SAL对高糖作用下H9c2心肌细胞凋亡的影响与空白组(3.32±0.41%)相比,高糖组(23.07±3.12%)细胞凋亡率显著升高(P<0.05);与高糖组比较,高糖+SAL组(11.82±2.30%)细胞凋亡率则显著降低(P<0.05);与高糖+SAL组相比,高糖+SAL+LY294002组(17.44±3.09%)细胞凋亡率则显著增加(P<0.05),图3。

图3 SAL能够抑制高糖作用下H9c2心肌细胞的凋亡
2.4 SAL对高糖作用下心肌细胞H9c2氧化应激相关因子的影响与空白组相比,高糖组细胞培养上清中MDA的含量显著升高,同时SOD和GSH-Px的含量显著降低(P<0.05);与高糖组相比,高糖+SAL组细胞培养上清中MDA的含量显著降低,同时SOD和GSH-Px的含量显著升高(P<0.05);然而与高糖+SAL组相比,高糖+SAL+LY294002组细胞培养上清中MDA、SOD和GSH-Px含量则被逆转(P<0.05),表1。

表1 SAL对H9c2心肌细胞培养上清中MDA、SOD、GSH-Px含量的影响(n=8)
2.5 SAL对高糖作用下H9c2心肌细胞中ROS生成的影响与空白组(MFI:4386.23±452.64)相比,高糖组细胞中ROS含量显著增加(MFI:35876.59±768.45);与高糖组相比,高糖+SAL组细胞中ROS的含量则显著降低(MFI:12069.23±852.64),(P<0.05);与高糖+SAL组相比,高糖+SAL+LY294002组细胞中ROS的含量则有所升高(MFI:21084.23±1352.64),(P<0.05),图4。

图4 SAL能够抑制高糖作用下H9c2心肌细胞中ROS的生成
2.6 高糖作用对H9c2心肌细胞PI3K/AKT/Nrf2通路的影响经western blot法检测,与高糖组相比,高糖+SAL组细胞p-AKT/AKT、p-GSK-3β/GSK-3β和Nrf2蛋白表达显著升高(P<0.05);与高糖+SAL组相比,高糖+SAL+LY294002组细胞中p-AKT/AKT、p-GSK-3β/GSK-3β和Nrf2蛋白表达则被逆转(P<0.05),图5。
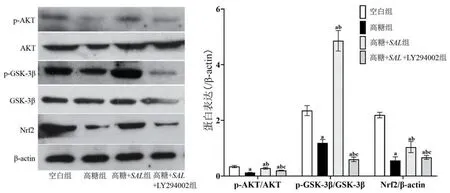
图5 SAL能够激活高糖作用下H9c2心肌细胞中PI3K/AKT/Nrf2信号传导通路
3 讨论
糖尿病性心肌病最初被描述为在没有冠状动脉疾病、高血压和心脏瓣膜疾病的情况下发生心力衰竭的人类病理生理状况。高血糖是糖尿病最重要的特征,被认为是微血管(如视网膜病变)或大血管并发症(如糖尿病性心肌病)发生的危险因素[9]。高糖导致的心肌细胞凋亡是糖尿病性心肌病发展的病变基础。因此,本研究通过高糖诱导H9c2心肌细胞建立糖尿病心肌病体外细胞模型。目前关于糖尿病性心肌病的发病机制尚不明确,且缺乏有效的预防手段[10]。从植物中分离有效的活性成分已经成为慢性疾病防治领域的重要途径之一。SAL是一种从红景天中提取的苯丙素苷,有助于身体适应各种压力,调节免疫状态等,而不会产生不利的副作用。本研究中我们发现,SAL对高糖诱导心肌细胞凋亡具有一定保护作用,主要表现为抑制ROS产生,降低细胞凋亡率并显著提高细胞活力。初步探讨其作用机制时,我们发现PI3K/AKT信号通路在高糖作用下处于抑制状态,而SAL可通过激活PI3K/AKT信号通路,抑制Nrf2蛋白降解,进而上调抗氧化基因的表达,促进细胞内SOD和GSH-Px等抗氧化因子的合成和分析,从而对高糖诱导的H9c2细胞产生保护作用。
SAL是中药红景天的主要活性组分,有良好的抗炎、抗肿瘤、抗氧化、免疫调节等作用[4]。心肌细胞增殖能力下降,细胞数量过度减少是糖尿病心肌病发病机制之一。例如,SAL能够抑制过氧化氢(H2O2)诱导的SH-SY5Y人神经母细胞瘤细胞和大鼠海马神经元的损伤[11]。同时,也能够保护心肌细胞免受谷氨酸毒性,以及钙超载和LPS诱导的大鼠心肌细胞凋亡[12]。因此上述数据均说明SAL可能是一种潜在的治疗或预防心血管疾病发生、进展的药物。AKT是一种丝氨酸/苏氨酸激酶,在细胞增殖和存活中起重要作用。急性激活AKT可以抑制有害刺激诱导的心肌细胞坏死和凋亡。在本研究中,我们首先证实高糖作用下,H9c2细胞AKT蛋白磷酸化水平降低,说明PI3K/AKT信号通路被抑制可能是导致H9c2细胞凋亡的主要机制之一。
持续性高糖状态会导致ROS过度产生,进而影响心肌收缩和舒张功能。NADPH氧化酶被认为是高糖诱导心肌细胞产生ROS的主要来源。在生理条件下,NADPH氧化酶产生的ROS可被抗氧化防御系统有效地抑制,但是若过度激活则可进一步导致氧化应激性损伤、线粒体功能障碍和抗氧化基因表达受损。而Nrf2/抗氧化应答元件信号通路在体外预防心肌细胞氧化损伤中发挥着重要作用[13]。Nrf2属于碱性亮氨酸拉链(BZIP)转录因子Cap‘n’Collar(CNC)家族。在非应激条件下,Nrf2通过泛素-蛋白酶体途径以keap1依赖的方式持续降解。在氧化性或亲电性应激信号的存在下,Nrf2蛋白降解下降,使其在胞核中大量积累,从而上调许多细胞保护酶II相解毒酶和抗氧化基因的表达,这些因子共同抑制心肌细胞中的氧化性压力,有助于维持心脏收缩和舒张功能[14]。而PI3K/AKT通路是调节Nrf2核积累的重要途径之一,如Tsai等[15]证实抗氧化剂通过上调PI3K/AKT/Nrf2通路,保护高血糖诱导的ROS产生及其介导的心肌细胞凋亡。在本研究中,我们也证实高糖处理可以降低p-PI3K和p-AKT蛋白表达,这些结果也提供了高糖抑制PI3K/AKT通路激活的证据。此外与高糖组相比,高糖+SAL组细胞生存活性增加,且呈剂量依赖性;凋亡率和细胞中ROS合成量降低,同时p-AKT/AKT、p-GSK-3β/GSK-3β和Nrf2蛋白表达升高,说明SAL对高糖诱导的H9c2细胞损伤有一定的保护作用,其作用机制与激活PI3K/AKT/Nrf2信号通路有关。同时,为了明确PI3K/AKT/Nrf2信号通路在SAL心肌保护过程中发挥的作用,我们设置了挽救实验,在高糖+SAL的基础上,增加特异性PI3K抑制剂LY294002预处理,结果表明,与高糖+SAL组相比,高糖+SAL+LY294002组细胞生存活力、凋亡率、ROS生成量均被部分逆转,说明激活PI3K/AKT/Nrf2信号通路是SAL抑制高糖诱导的H9c2细胞凋亡的作用途径之一,可能还有其他的分子通路参与了SAL心肌保护作用,这是本研究的局限性之一。此外我们仅在体外细胞模型上进行了研究,结果可能与临床患者的实际情况有所不同。
总之,本研究证实SAL对高糖诱导的H9c2细胞凋亡具有一定的保护作用,可以降低细胞内ROS的生成,抑制细胞凋亡,并提高细胞存活能力,其作用机制之一可能与激活激活PI3K/AKT信号通路,抑制Nrf2蛋白降解,进而促进细胞内SOD和GSH-Px等抗氧化因子合成有关。这些发现为预防糖尿病性心肌病的发生提供了一种潜在的天然药物化合物-SAL,但还需更多工作以证实该结论的可靠性。
