环磷酰胺诱导大鼠卵巢功能不全及差异表达基因分析
2022-08-17张玉林张觇宇
张玉林,邹 姮,张觇宇*
(1.重庆医科大学附属第一医院 妇科,重庆 400016; 2.重庆医科大学附属第二医院 妇产科 生殖医学中心,重庆 400010;3.教育部生殖与发育国际合作联合实验室,重庆 400010)
近年来,年轻人群恶性肿瘤的发病率逐渐增加[1]。通常对于年轻患者的治疗方式主要是手术和辅助化疗相结合。而化疗对于育龄期女性最为显著的副作用为早发性卵巢功能不全(premature ovarian insufficiency,POI)和不孕。不同种类的化疗药物可引起轻到重度的POI甚至卵巢早衰(premature ovarian failure,POF)。POI/POF是40岁前出现停经、低雌激素及高性腺激素水平的一类疾病[2],极大地影响患者的生活质量,已经成为临床亟待解决的问题。
研究表明烷基化剂如环磷酰胺(cyclophosphamide,CTX)对卵巢功能损伤较强,顺铂、阿霉素次之[3-4]。CTX是常用的化疗药物,可用于多种癌治疗。CTX可损伤静止的原始卵泡和非静止的生长卵泡,导致POI,但具体的机制尚不清楚。因此,本研究旨在建立稳定CTX致大鼠POI模型,通过转录组测序探讨其潜在分子机制,为寻找预防及保护药物提供理论依据。
1 材料与方法
1.1 主要材料
SPF级8~10周龄SD雌性大鼠(重庆医科大学实验动物中心)。环磷酰胺(江苏盛迪有限公司);戊巴比妥钠(上海思域化工科技有限公司);E2、FSH、AMH Elisa Kits(上海抚生实业有限公司);Direct-zol RNA miniPrep Kits(ZYMO research, California, USA);Illumina HiSeq测序仪(Illumina HiSeq 2000平台)。
1.2 方法
1.2.1 大鼠的分组及处理:将具有规律动情周期的大鼠随机分为4组,每组14只,第1天腹腔注射记为d1,共15 d。对照组0.9%氯化钠溶液(d1~d15),低剂量CTX组 (d1 50 mg/kg, d2~d15 8 mg/kg), 中剂量CTX组 (d1 100 mg/kg, d2~d15 8 mg/kg)和高剂量CTX组(d1 200 mg/kg, d2~d15 8 mg/kg)。每天观察大鼠一般情况、生存状态,绘制生存曲线,选取最适剂量构建POI模型。构模2周后处死大鼠进行后续实验。动物饲养在动物中心,所有动物实验均按照重庆医科大学动物伦理委员会的指导原则进行。
1.2.2 酶联免疫吸附试验(ELISA)检测E2、AMH及FSH水平:戊巴比妥钠腹腔麻醉后经腹主动脉穿刺采血。按照ELISA试剂盒说明书测定血清雌二醇(estradiol,E2)、抗米勒氏管激素(anti-Müllerian hormone,AMH)和促卵泡激素(follicle-stimulating hormone, FSH)水平。
1.2.3 阴道涂片检测动情周期:在构模前、中、后,每日上午9时行阴道涂片,连续至少7 d。涂片用苏木精和伊红染色(HE),在光镜下观察。动情周期的阶段由上皮细胞(有核和角质化)和白细胞的比例和/或外观判定。规律的动情周期 (4~6 d:前期1 d, 发情期1~2 d,后期1 d,间期1~2 d);不规则的周期包括间期延长或发情期延长(连续3~4 d发情期,或4~5 d间期)和不规则的周期(>4 d发情期或>5 d间期或无周期性)[5]。
1.2.4 卵巢的HE染色:只有含有清晰可见细胞核的卵母细胞的卵泡被计数。每个标本统计1个完整卵巢的5张切片。
1.2.5 提取卵巢组织RNA及测序:Direct-zol RNA miniPrep试剂盒提取大鼠卵巢中的总RNA。使用Illumina HiSeq测序仪进行mRNA测序。
1.2.6 差异表达基因的筛选及功能富集分析:采用FPKM值对基因表达进行归一化。DESeq2软件包获得差异表达基因(differentially expressed genes,DEGs)。GO和KEGG分析DEGs的潜在功能及参与通路,筛选标准均为校正后P<0.05。
1.2.7 蛋白互作、关键基因及富集分析:通过String数据库对DEGs行蛋白互作网络分析(Protein Protein Interaction network, PPI network),在Cytoscape平台完成PPI网络的可视化并筛选出节点最高的14个关键基因,通过DAVID平台对14个基因进行GO及KEGG富集分析。筛选标准为P<0.05且FDR<0.05。
1.3 统计学分析
计量资料以均数±标准差(x±s)表示,两组比较采用独立样本t检验。计数资料采用构成比(%)表示,两组比较采用卡方检验。所有分析均采用SPSS 18.0软件进行。
2 结果
2.1 大鼠生存情况
中、高剂量组大鼠毛发暗淡,水摄入和活动量明显下降,出现血尿及恶病质。中剂量CTX组给药第8、9、10天分别死亡1、3、5只。由于大鼠大量死亡,第10天停止注射CTX,第11、12天分别死亡1只,余3只。高剂量CTX组第8、9、10天分别死亡2、4、3只,第10天停止注射,第11、14天分别死亡1只,余3只。低剂量CTX组仅1只死亡。对照组无大鼠死亡(图1A)。后续采用低剂量CTX构建模型。与对照组相比,模型组大鼠体质量显著下降(图1B)。
2.2 E2、AMH、FSH的表达水平
与对照组相比,模型组E2、AMH明显降低(P<0.05)(图2A~B),而FSH明显升高(P<0.01)(图2C)。

A.survival curve; B.body weights; *P<0.05,**P<0.01,***P<0.001 compared with control group图1 大鼠生存曲线及体质量变化Fig 1 Survival curve and body weight(x±s,n=13)

A.E2; B.AMH; C.FSH; *P<0.05,**P<0.01 compared with control group图2 性激素水平Fig 2 Sex hormone concentration(x±s,n=6)
2.3 动情周期
给药中模型组53.8%(7/13)出现异常的动情周期,其中30.8%(4/13)间期延长,23.1%(3/13)无规律。给药后,模型组大鼠仍有46%(6/13)表现异常的动情周期,分别有23.1%(3/13)表现为发情期延长及无规律,而对照组大鼠均有规律的动情周期(图3)。
2.4 卵巢、子宫大体及卵巢重量
模型组卵巢及子宫较对照组变小,卵巢重量明显减轻(P<0.05)(图4)。
2.5 卵巢组织学
对照组卵泡数较多,各级卵泡可见,而模型组卵巢纤维化明显,卵泡数较少,闭锁卵泡增加。与对照组相比,模型组窦前卵泡、窦卵泡减少(P<0.01,P<0.05),而闭锁卵泡增加(P<0.01)(图5)。
2.6 大鼠卵巢RNA-seq
对照组与模型组之间有829个上调和1 473个下调的DEGs,其功能主要涉及离子通道及跨膜转运,DEGs主要富集于神经活性配体-受体相互作用通路、cAMP信号通路、钙信号通路、轴突导向通路、催产素信号通路、胰岛素分泌通路、醛固酮合成及分泌通路等(图6A~C)。

A.proestrus; B.estrous; C.metestrus; D.diestrus; E.estrous cycles before (0 week), during (1 week) and after CTX (3 weeks); *P<0.05,**P<0.01 compared with the control group图3 动情周期Fig 3 Estrous cycles(%,n=13)
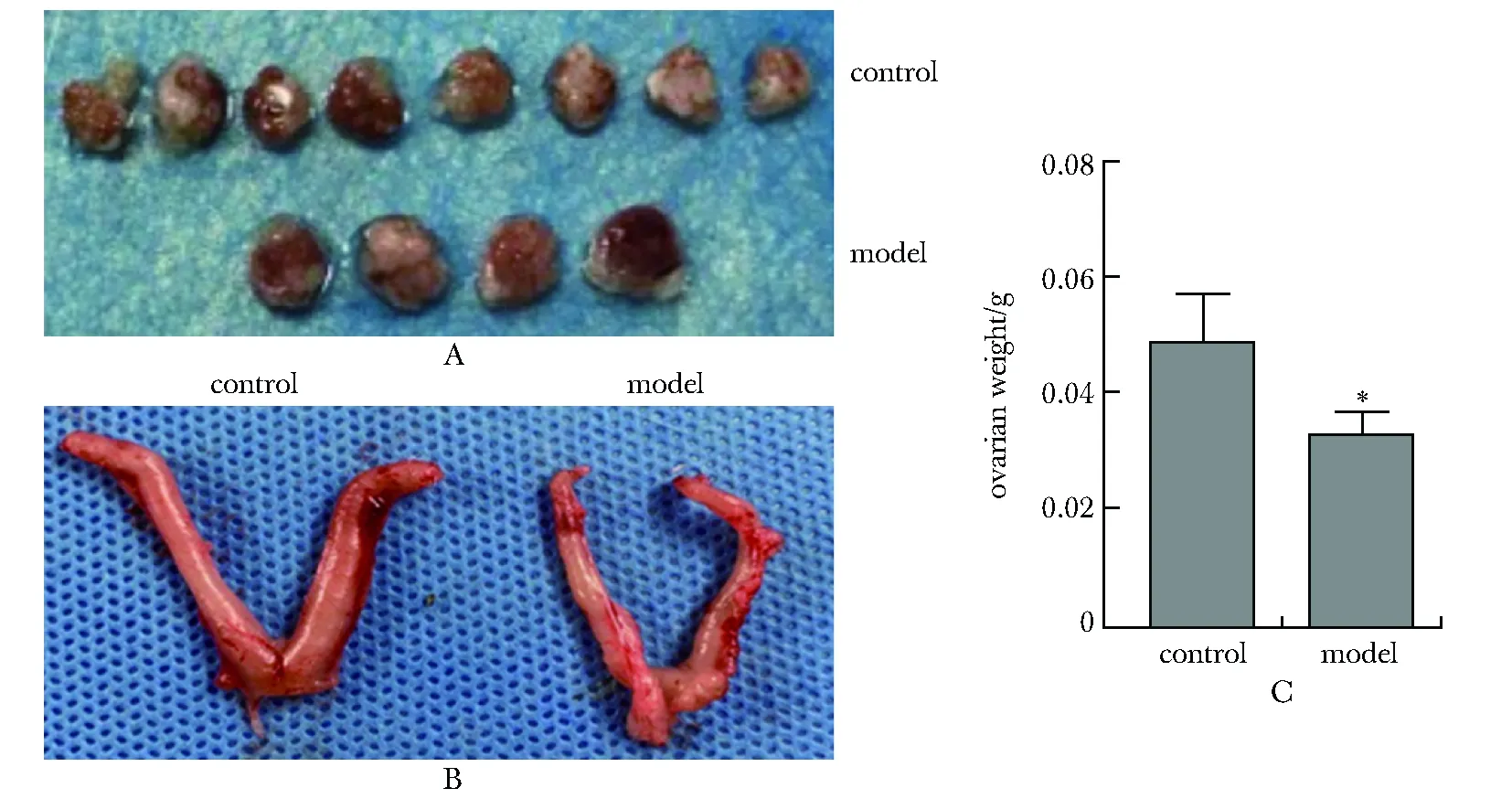
A.ovary; B.uterus; C.ovarian weights; *P<0.05 compared with the control group图4 卵巢、子宫大体形态及卵巢重量Fig 4 Gross appearance of ovary,uterus and ovarian weights(x±s,n=13)

A,B.ovary morphology of control group(×40,×100); C,D.model group(×40,×100); E.count of preantral follicles; F.antral follicles; G.atretic follicles(G); *P<0.05,**P<0.01 compared with the control group图5 卵巢HE染色Fig 5 Histological changes of ovaries (x±s,n=9)
2.7 差异基因的PPI分析、关键基因筛选及富集分析
通过绘制DEGs的蛋白质互作图,根据节点的大小筛选出14个关键基因(CASR、PVALB、TH、NTRK2、GRIN1、CAMK2A、SHH、GRIN2A、LEP、GNG7、FRAS1、ALPPL2、ALPP和SLC17A7),主要富集于酒精中毒及安非他命中毒通路(图6D,7)。
3 讨论
每年全球有多达百万女性罹患癌,约10%在育龄期,其中90%早期癌患者在治疗后可以存活。早期癌主要实施保留生育功能手术并辅以化疗。CTX为临床常用的化疗药物,可以同时损伤静止的原始卵泡及生长期卵泡,导致POI甚至POF。首先,CTX可损伤原始卵泡,导致DNA断裂、凋亡。其次,CTX可以损伤生长卵泡的卵母细胞及支持细胞,导致卵泡闭锁。第三,CTX可通过Akt信号通路使原始卵泡过度激活、耗竭。第四,CTX可损伤卵巢间质和血管,导致卵泡损失[3]。目前CTX引起POI的机制仍不完全清楚,而且目前仍缺乏统一的CTX诱导大鼠POI的建模方法。
本实验中,中、高剂量CTX引起大鼠明显的毒副作用、死亡率高。低剂量CTX对卵巢内分泌功能、卵巢组织均有显著的影响,因而采用此方案构建大鼠POI模型是可行的。
卵巢组织的mRNA测序显示两组间的DEGs显著富集于下述通路。神经活性配体-受体相互作用通路与生殖、性腺发育及排卵有关[6]。cAMP信号通路参与窦卵泡的类固醇生成[7]。钙信号通路对卵泡的成熟发挥重要的作用[8]。轴突导向通路基因的缺失可能与不孕有关[9]。通过DEGs的蛋白互作图,筛选出14个关键基因。瘦素(leptin, LEP)编码的蛋白与其受体结合,参与调节免疫和炎性反应、血管生成、生殖等。POI患者的血清LEP水平较正常妇女明显降低[10]。Sonic Hedgehog信号分子(sonic hedgehog signaling molecule,SHH)参与早期胚胎过程,SHH信号通路参与颗粒细胞的信号传导[11]。神经营养因子(neurotrophic factors,NTs)有助于卵泡的形成和发育。神经营养受体酪氨酸激酶2(neurotrophic receptor tyrosine kinase 2,Ntrk2)是NT-4/5和BDNF的高亲和力受体,是卵泡组装、生长和存活所需的信号蛋白。卵母细胞特异性缺失Ntrk2会导致卵母细胞死亡、卵泡丧失和不育症。缺乏Ntrk2的卵母细胞对PI3K-AKT介导的促性腺激素无反应[12]。溶质载体家族17成员7(solute carrier family 17 member 7,Slc17a7)与谷氨酸转运有关。
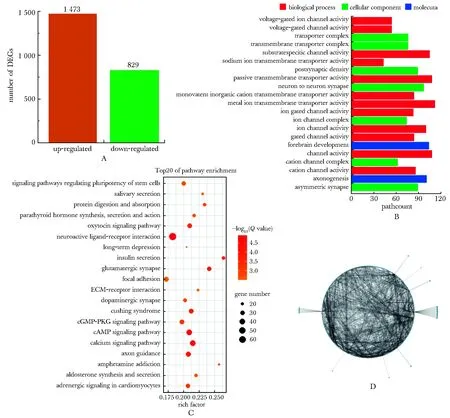
A.screening of DEGs; B.GO analysis; C.KEGG analysis;D.PPI network图6 卵巢mRNA测序Fig 6 mRNA sequencing of ovaries(x±s,n=3)
谷氨酸离子受体NMDA型亚基1(glutamate ionotropic receptor NMDA type subunit 1,GRIN1)及GRIN2A属于谷氨酸受体信号通路,谷氨酸神经递质激活GRIN2A,调节GnRH神经元中的Ca2+,引起GnRH分泌[13]。钙调蛋白依赖性蛋白激酶Ⅱα(calcium dependent protein kinase Ⅱ alpha,CAMK2A)参与钙信号传导机制,作用于垂体分泌促性腺激素[14]。钙敏感受体(calcium-sensing receptor,CaSR)是一种G蛋白偶联受体,维持血清Ca2+稳态,在卵泡的存活及成熟中发挥重要作用[15]。小清蛋白(parvalbumin,Pvalb)是高亲和力钙结合蛋白,表达于生长卵泡的被膜细胞,在去垂体的成年大鼠中,Pvalb与产类固醇激素的被膜细胞均消失,提示Pvalb参与卵巢类固醇激素的代谢[16]。卵巢受下丘脑-垂体轴调控,机制十分复杂,高通量测序增加了POI的调控网络版图,可能为POI研究发挥重要作用。
综上所述,本研究建立了CTX诱导的大鼠POI模型,初步探讨了CTX诱导的大鼠POI模型的损伤机制,为后续深入的机制研究提供了方向。
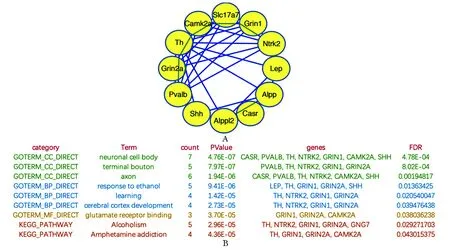
A.PPI networks of hub genes; B.GO and KEGG analysis图7 Hub基因及其GO、KEGG分析Fig 7 Hub genes and GO and KEGG analysis
