核糖核酸酶A家族成员2基因与胶质瘤免疫浸润水平及临床预后的关系分析△
2022-08-10于海明卢武李玉姬张思也
于海明,卢武,李玉姬,张思也
湖南省人民医院重症医学科,长沙 410000
神经胶质瘤是中枢神经系统(central nervous system,CNS)最致命的原发性脑肿瘤。美国约有30%的CNS肿瘤被诊断为神经胶质瘤[1],其中,恶性肿瘤占81%[2]。世界卫生组织(World Health Organization,WHO)根据组织学特征将胶质瘤分为Ⅰ~Ⅳ级[3]。弥漫性低级别(WHOⅠ~Ⅱ级)胶质瘤称为低级别胶质瘤(low-grade glioma,LGG)[4]。由于其增殖速度快和高侵袭性,这些LGG将在几个月内发展成胶质母细胞瘤(glioblastoma,GBM)(WHOⅢ~Ⅳ级)[5]。GBM是最常见的恶性胶质瘤,临床预后差,很少患者生存时间超过14个月[6]。因此,研发帮助判断胶质瘤临床预后的生物标志物是非常必要的。核糖核酸酶A家族成员2(ribonuclease A family member 2,RNASE2)是免疫系统的重要调控因子,是多种肿瘤的预后标志物[7-9],但其在胶质瘤中与免疫浸润及预后的关系仍未有研究。本研究通过生物信息学分析RNASE2基因在胶质瘤组织与正常组织中的表达差异,并评估其与胶质瘤预后、免疫浸润水平的关系,现报道如下。
1 资料与方法
1.1 RNASE2基因的筛选过程
下载癌症基因组图谱(The Cancer Genome Atla,TCGA)数据库中胶质瘤组织测序数据163个和脑组织测序数据44个,进行差异表达基因分析,得到7649个差异表达的基因(P<0.05);根据预后数据进行生存分析,取差异最显著的前500个预后基因(P<0.05)。免疫基因来自IMMPORT数据库(https://www.immport.org/shared/genelists)中的细胞因子,共456个。三者采用韦恩在线分析(http://bioinformatics.psb.ugent.be/cgi-bin/liste/Venn)取交集。
1.2 RNASE2基因的表达水平分析
RNASE2基因在中国胶质瘤基因组图谱(Chinese Glioma Genome Atlas,CGGA)和 TCGA 数据库泛癌中的表达采用肿瘤免疫评估资源(Tumor Immune Estimation Resource,TIMER)数据库(http://timer.comp-genomics.org/)和UALCAN数据库(http://ualcan.path.uab.edu/analysis.html)进 行 分 析 。RNASE2基因在TCGA数据库中胶质瘤组织和脑组织中的mRNA表达量及其与预后的分析均应用基因表达谱动态分析(Gene Expression Profiling Interactive Analysis,GEPIA)(http://gepia.cancer-pku.cn/about.html)软件进行分析。RNASE2基因在CGGA数据库中GMB和脑组织中的表达量分析采用数据库自带软件(http://www.cgga.org.cn/)进行分析。
1.3 RNASE2与免疫浸润的关系分析
RNASE2基因表达与大量免疫浸润细胞的相关性分析应用TIMER2.0数据库基因模块进行分析。
1.4 RNASE2及相关基因的京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)及基因本体论(gene ontology,GO)分析
采用Linkedomics软件(http://www.linkedomics.org/admin.php)中的Pearson相关分析法对TCGA数据库中胶质瘤(n=489)与RNASE2基因转录水平的相关性进行分析,并采用基因集富集分析(gene set enrichment analysis,GSEA)进行GO功能富集分析及KEGG信号通路分析。
1.5 统计学分析
采用TCGA、CGGA、TIMER、UALCAN、GEPIA、Linkedomics等软件分析统计数据。以P<0.05为差异有统计学意义。
2 结果
2.1 RNASE2基因在胶质瘤中的表达水平
首先将胶质瘤表达差异显著基因(n=7649)、预后差异显著基因(n=500)、免疫细胞因子(n=456)取交集,得到7个交集基因,选择RNASE2作为后续研究对象。采用TIMER分析RNASE2在TCGA数据库泛癌中的表达,结果显示RNASE2在胶质瘤中表达较高(P<0.001)(图1)。GEPIA分析显示,RNASE2基因在GMB和LGG中的表达水平均高于癌旁组织,差异均有统计学意义(P<0.05)(图2)。UALCAN分析显示,RNASE2基因在GMB中的表达水平明显高于癌旁组织,差异有统计学意义(P<0.001)(图3)。
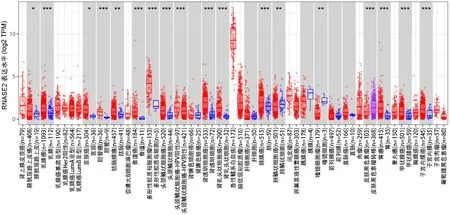
图1 RNASE2在TCGA数据库泛癌中的表达
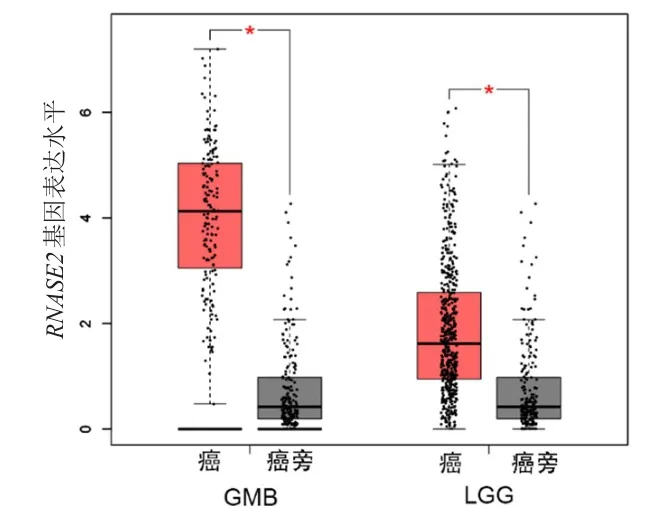
图2 GEPIA分析RNASE2基因在GMB、LGG及相应癌旁组织中表达水平的比较
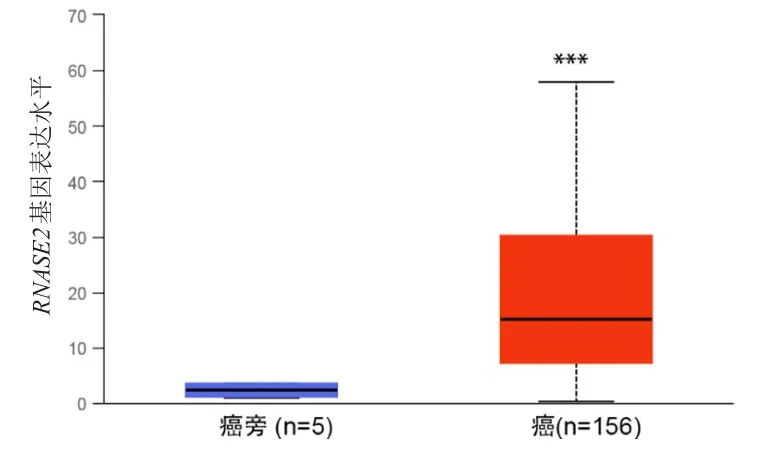
图3 UALCAN分析RNASE2基因在GMB(n=156)及癌旁组织(n=5)中表达水平的比较
2.2 RNASE2表达与临床特征的关系
CGGA分析显示,RNASE2基因表达水平在WHOⅡ级、WHOⅢ级、WHOⅣ级胶质瘤中依次递增,差异有统计学意义(P<0.001)(图4);此外,RNASE2基因在复发胶质瘤中的表达水平明显高于原位胶质瘤,差异有统计学意义(P<0.01)(图5)。
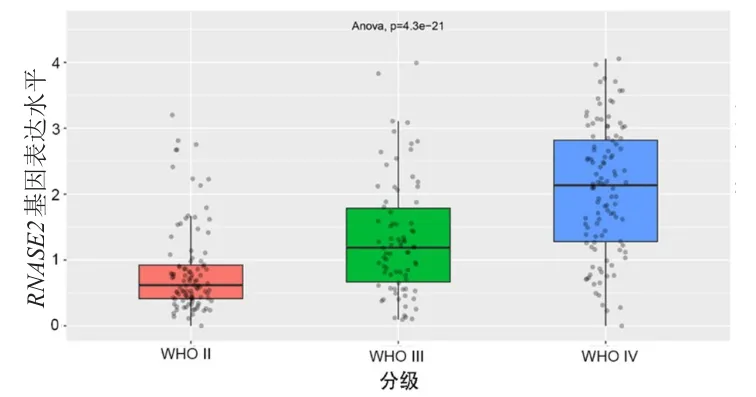
图4 CGGA分析RNASE2基因在不同WHO分级胶质瘤中的表达水平比较
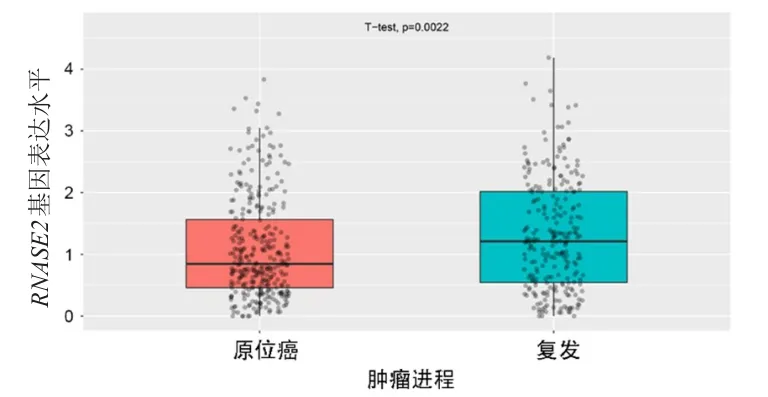
图5 CGGA分析RNASE2基因在复发及原位胶质瘤中的表达水平比较
2.3 RNASE2表达与预后的关系
采用GEPIA2与CGGA分析RNASE2与预后的关系,结果显示,RNASE2低表达的GMB和LGG患者生存情况均明显优于RNASE2高表达的GMB和LGG患者,差异均有统计学意义(P<0.01)。(图6、图7)
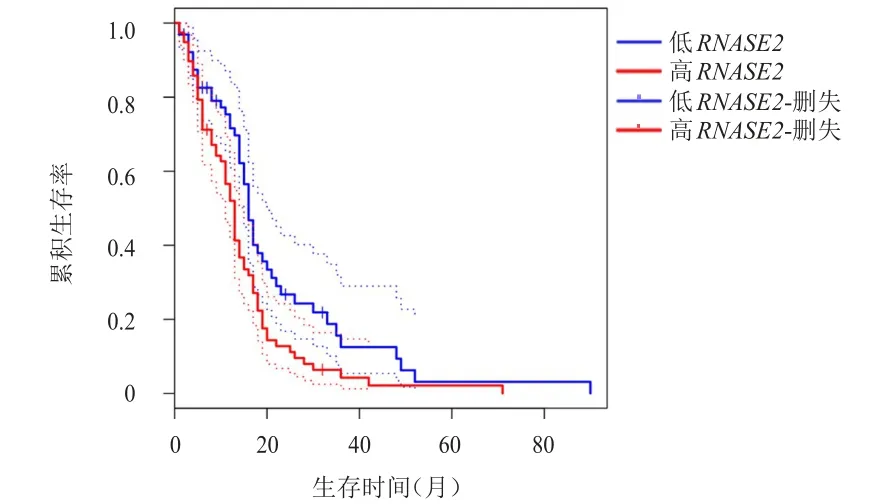
图6 RNASE2低表达(n=65)与高表达(n=81)GMB患者的生存曲线

图7 RNASE2低表达(n=257)与高表达(n=257)LGG患者的生存曲线
2.4 RNASE2表达与免疫浸润的关系
RNASE2mRNA表达水平与CD8+T细胞呈负相关,与调节性T细胞呈正相关(P<0.05)。(图8)
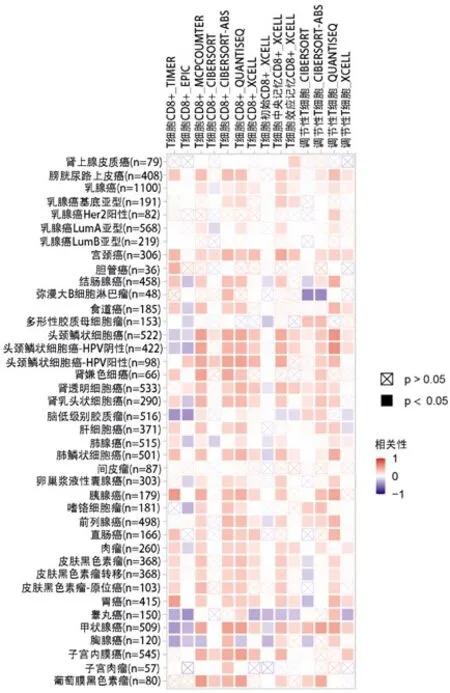
图8 RNASE2 mRNA表达与免疫浸润的相关性
2.5 RNASE2的基因富集分析
使用Linkedomics的LinkFinder模块分析TCGA数据库中胶质瘤患者的mRNA测序数据。结果显示,6235个基因与RNASE2呈负相关,5807个基因与RNASE2呈正相关。与RNASE2相关的前50位显著正性基因和前50位显著负性基因详见图9、图10。RNASE2与免疫基因Toll样受体1(Toll-like receptor 1,TLR1)呈正相关(r=0.773,P<0.001);RNASE2与ARVCFδ连环蛋白家族成员(ARVCFdeltacateninfamilymember,ARVCF)呈负相关(r=-0.471,P<0.001)。

图9 与RNASE2相关的前50位显著正性基因表达热图

图10 与RNASE2相关的前50位显著负性基因表达热图
此外,通过GSEA进行KEGG通路分析,结果显示,与RNASE2相关的差异表达基因主要富集在免疫(Fc γ介导的吞噬作用)、核因子κB(nuclear factor-κB,NF-κB)信号通路等中(图11)。GO分析结果与KEGG结果类似,RNASE2差异表达基因主要富集在免疫、炎症[急性炎症反应、白细胞介素-8(interleukin-8,IL-8)生成]相关的生物过程(嗜中性粒细胞介导的免疫)和分子功能(胶原黏附、细胞因子受体活性)。为了进一步研究RNASE2在胶质瘤中可能的分子机制,利用Linkedomics对miRNA进行富集分析,结果显示RNASE2与(CAGCAGG)miRNA-370相关(图12)。
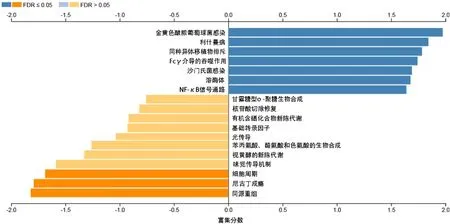
图11 GSEA分析RNASE2差异表达基因KEGG富集通路
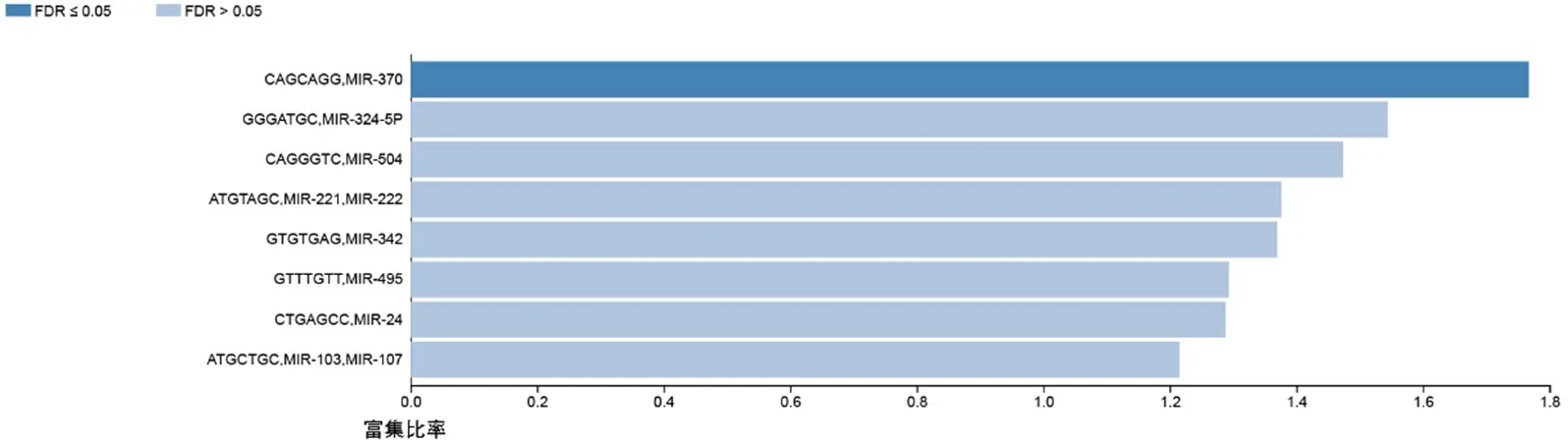
图12 RNASE2的miRNA靶基因分析
3 讨论
目前,大多数胶质瘤患者的预后很差,即使采用综合治疗策略。胶质瘤的治疗耐药性已被广泛报道,与其独特的代谢机制和周围复杂的免疫抑制微环境密切相关[10-11]。因此,迫切需要探索可靠的预后生物标志物和个性化治疗策略。本研究发现,RNASE2表达在胶质瘤中显著增加,且与预后、复发有关。RNASE2可作为评价胶质瘤预后与复发的潜在标志物。
RNASE2作为核糖核酸酶A家族的一员,可以作为细胞因子参与免疫及肿瘤的预后[7,12-13]。Ostendorf等[13]的一项研究指出,Toll样受体8对合成细菌和原生动物RNA的免疫传感需要RNASET2和RNASE2的协调处理。在胃癌中,RNASE2与预后呈正相关,可作为潜在的评估胃癌预后及免疫浸润的标志物[7]。RNASE2还被证明为肺动脉高压及免疫浸润的标志物[14]。在肾透明细胞癌中,RNASE2与预后相关[15]。在另一项研究中,RNASE2可作为肾透明细胞癌预后的评价指标[9]。上述研究结论进一步佐证了RNASE2作为胶质瘤预后的标志物。
免疫浸润会导致胶质瘤中免疫微环境破坏,促进免疫逃逸的发生,因此,本研究评估RNASE2水平是否与胶质瘤的免疫浸润相关。调节性T细胞是CD4+T细胞的一个亚群,在胶质瘤中发挥促进肿瘤免疫逃逸的作用。随着胶质瘤恶性程度的增加,调节性T细胞比例增加[16]。多项研究说明调节性T细胞的高表达预示不良预后[17-18]。在本研究中,RNASE2基因的表达与调节性T细胞比例呈正相关,RNASE2低表达时,调节性T细胞比例低,预后更好(未提供)。本研究还发现RNASE2的表达与CD8+T细胞呈负相关。CD8+T细胞可分化为细胞毒性T细胞,抵抗外来病原体的入侵[19]。Kane等[20]证明CD8+T细胞介导的免疫编辑抑制小鼠胶质瘤基因组进化和免疫逃逸。
此外,对RNASE2的相关性基因分析发现,RNASE2与ARVCF基因表达呈负相关,与TLR1表达呈正相关。ARVCF表达下调时可抑制p53诱导的肿瘤细胞凋亡[21]。TLR1能够调节脑肿瘤微环境中的免疫反应[22]。为探讨RNASE2影响患者生存的可能机制,本研究对RNASE2差异表达基因进行了GO和KEGG富集分析,结果提示存在多种免疫相关通路。此外,GSEA富集分析进一步揭示了多种免疫相关功能和途径的富集。因此,推测RNASE2可能通过调节肿瘤免疫发挥促癌作用,如调节性T细胞、CD8+T细胞介导的免疫等,这在之前的研究中没有发现。
本研究发现了一个新的胶质瘤预后基因RNASE2,它也与免疫密切相关。这一结果在以往国内外研究中未见报道,因此本研究可能会影响胶质瘤未来的诊断和治疗。然而,本研究也有一些局限性。本研究未对RNASE2在胶质瘤细胞中的功能和潜在机制进行评估。此外,RNASE2与肿瘤免疫微环境之间的关系仍有待进一步验证。最后,RNASE2在一些特殊类型的胶质瘤(如弥漫性中线胶质瘤)中的作用仍有待进一步讨论。
