离子色谱法测定盐酸二甲双胍药物中二甲胺的含量
2022-08-08储韫婧邵方娴陈民辉冯芳中国药科大学药物分析教研室南京98江苏省食品药品监督检验研究院南京009
储韫婧,邵方娴,陈民辉*,冯芳(. 中国药科大学药物分析教研室,南京 98;. 江苏省食品药品监督检验研究院,南京 009)
盐酸二甲双胍是治疗二型糖尿病的首选药[1],能有效降低患者血糖,改善胰岛素抵抗,并对糖尿病并发症糖尿病视网膜病变有效[2-3],对糖尿病相关的肾脏并发症也有改善作用[4-5]。盐酸二甲双胍由盐酸二甲胺和双氰胺通过加热缩合反应合成[6],二甲胺具有毒性,对皮肤及眼睛有刺激损伤作用[6],易与亚硝酸盐生成基因毒性杂质N-亚硝基二甲胺(N-nitroso dimethylamine,NDMA)[7]。控制盐酸二甲双胍药物中二甲胺的含量,有利于降低患者的用药风险。目前国内外药典均有盐酸二甲双胍及其制剂的收载,其中美国药典43 版[8]、日本药局方18 版[9]和《中国药典》2020年版[10]均未对二甲胺杂质进行限度控制,仅欧洲药典10.1 版[11]和英国药典2021 版[12]中收载了盐酸二甲双胍中二甲胺(杂质F)的检测方法及限度,限度均规定为0.05%。二甲胺没有紫外吸收,且极性强[13],在反相色谱柱上没有保留,采用柱前衍生化使二甲胺形成具有紫外吸收的衍生化产物,同时改善二甲胺在反相色谱柱上的色谱行为,从而满足高效液相色谱法[6,14]的检测要求。欧洲药典和英国药典以2,4-二硝基氟苯为柱前衍生化试剂,采用高效液相色谱法对二甲胺进行测定。柱前衍生化法前处理过程复杂,衍生化试剂具有毒性。气相色谱检测法[15]和气相质谱联用法[16]可以实现二甲胺的直接检测,但药物中二甲胺常以盐酸二甲胺形式存在,样品制备时需要使用强碱性溶液将盐酸二甲胺转化成二甲胺[7],操作烦琐且易损伤色谱柱,定量限只能达到微克级别[7,17]。液相质谱联用法[17]适用于二甲胺的检测,操作简便,灵敏度高,但需要使用特殊的HILIC 亲水色谱柱以改善二甲胺的保留行为,过低质量数的分子离子峰易受干扰。近年来,离子色谱也广泛应用于二级胺和三级胺的检测[18],离子色谱法[19-21]测定药物中二甲胺,不需要进行衍生化,且灵敏度高,但离子色谱法用于盐酸二甲双胍片剂及缓释制剂中盐酸二甲胺检测尚未见报道。本研究旨在建立一种简便、准确且灵敏度高的分析方法用于检测盐酸二甲双胍及其制剂中盐酸二甲胺的含量。
1 仪器与试药
1.1 仪器
ICS-6000 离子色谱仪(配有CDRS-600 4 mm 阳离子抑制器、ICS-6000 DC-6 电导检测器、ST16R 型冷冻离心机,美国赛默飞世尔公司);XA205 型号电子天平(梅特勒·托利多公司);Mili-Q 纯水仪(美国Millipore 公司);IKA MS3 digital 涡旋振荡器(德国IKA 公司)、CPX8800H-C型超声波清洗器(必能信超声有限公司)。
1.2 试药
盐酸二甲胺对照品(批号:183726M-YX-01,纯度:100%,STD);乙腈(色谱纯,美国Honeywell 公司);超纯水(电阻率为18.2 MΩ,美国Millipore 公司);钾元素标准溶液(GSB1304-1733-2004,1000 µg·mL-1)、钠元素标准溶液(GSB1304-1738-2004,1000 µg·mL-1)、钙元素标准溶液(GSB1304-1720-2004,1000 µg·mL-1),(国家有色金属及电子材料分析测试中心);氯化铵(批号20190516,国药集团化学试剂有限公司);盐酸二甲双胍原料药、胶囊、盐酸二甲双胍片与缓释片均为市售样品。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取盐酸二甲胺对照品90.4 mg(约相当于二甲胺50 mg)置20 mL 量瓶中,用10%乙腈溶液溶解并稀释至刻度,即得对照品储备液。精密移取对照品储备液适量,用10%乙腈溶液稀释成含二甲胺5 µg·mL-1的原料、胶囊及片剂的对照品溶液;用50%乙腈溶液稀释成含二甲胺2.5 µg·mL-1的缓释片对照品溶液。
2.1.2 系统适用性溶液 分别以10%乙腈溶液和50%乙腈溶液作为溶剂,配制含K+、Na+、Ca2+、DMA、NH4+各1 µg·mL-1的混合溶液。
2.1.3 原料、胶囊及片剂系列标准曲线溶液 精密移取对照品储备液适量,用10%乙腈溶液稀释成含二甲胺分别为0.050、0.10、1.0、5.0、10 和50 µg·mL-1的原料、胶囊及片剂的系列标准曲线溶液。
2.1.4 缓释片系列标准曲线溶液 精密移取对照品储备液适量,用50%乙腈溶液稀释成含二甲胺分别为0.025、0.050、0.50、1.0、2.5 和5.0µg·mL-1的缓释片的系列标准曲线溶液。
2.1.5 原料及胶囊供试品溶液 取原料药或胶囊内容物适量(约相当于盐酸二甲双胍200 mg),精密称定,置15 mL 离心管中,加入1.0%乙腈溶液2 mL,超声10 min,涡旋1 min,10 000 r·min-1离心5 min,精密量取上清液1 mL 置10 mL 量瓶中,加水稀释至刻度,混匀,作为盐酸二甲双胍原料和胶囊的供试品溶液。
2.1.6 片剂供试品溶液 取本品粉末适量(约相当于盐酸二甲双胍200 mg),精密称定,置15 mL 离心管中,加入10%乙腈溶液2 mL,超声20 min,涡旋10 min,10 000 r·min-1离心8 min,精密量取上清液1 mL 置10 mL 量瓶中,加水稀释至刻度,混匀,滤过,取续滤液作为盐酸二甲双胍片的供试品溶液。
2.1.7 缓释片供试品溶液 取本品粉末适量(约相当于盐酸二甲双胍200 mg),精密称定,置50 mL 离心管中,加入5.0%乙腈溶液20 mL,涡旋30 min,10 000 r·min-1离心8 min,精密量取上清液5 mL 置10 mL 量瓶中,加水稀释至刻度,混匀,滤过,取续滤液作为盐酸二甲双胍缓释片的供试品溶液。
2.2 色谱条件及系统适用性
采用阳离子交换柱Dionex IonPac CG12A(4 mm×50 mm)为保护柱、Dionex IonPac CS12A(4 mm×250 mm)为分析柱,甲磺酸溶液为淋洗液,梯度洗脱:0 ~10 min(10 mmol·L-1),10 ~11 min(10 →30 mmol·L-1),11 ~28 min(30 mmol·L-1),28 ~29 min(30 →10 mmol·L-1),29 ~35 min(10 mmol·L-1),流速1.0 mL·min-1,柱温30℃,抑制电导检测,抑制电流88 mA,检测器温度35℃,抑制器温度20℃,进样体积25µL。理论塔板数按二甲胺峰计大于5000,各峰之间的分离度均大于1.5(见图1)。出峰顺序为Na+→NH4+→二甲胺→K+→Ca2+。
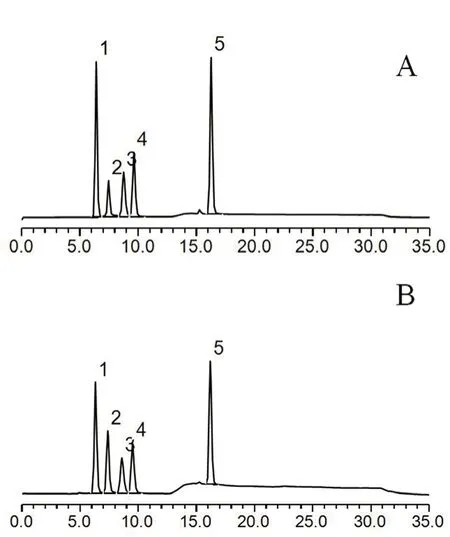
图1 二甲胺测定的系统适用性色谱图Fig 1 System suitability for the determination of DMA
2.3 专属性
将空白溶液、对照品溶液及不同剂型的供试品溶液注入色谱仪,记录色谱图(见图2)。二甲胺峰与相邻色谱峰分离度较好,分离度均大于1.5,且空白不干扰DMA 检测,方法专属性良好。
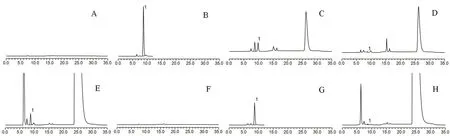
图2 二甲胺测定的专属性色谱图Fig 2 Specificity for the determination of DMA
2.4 检测限、定量限和线性关系
分别取原料、胶囊及片剂的系列标准曲线溶液和缓释片的系列标准溶液,照“2.2”项下色谱条件进样分析,记录色谱图,以峰面积(Y)对质量浓度(X)进行回归,绘制标准曲线。将原料、胶囊及片剂的系列标准曲线溶液和缓释片的系列标准溶液分别逐级稀释,以信噪比为3(S/N=3)和信噪比为10(S/N=10)计算二甲胺的检测限(LOD)和定量限(LOQ)。结果见表1。

表1 二甲胺定量限、检测限和线性范围Tab 1 LOD,LOQ and linearity of DMA
2.5 进样精密度试验
分别取原料、胶囊及片剂的对照品溶液和缓释片的对照品溶液,照“2.2”项下色谱条件注入离子色谱仪并记录色谱图,连续进样6 次,峰面积的RSD分别为0.20%和0.20%,表明该方法的进样精密度良好。
2.6 重复性试验
制备原料药、胶囊、片剂及缓释片供试品溶液,平行配制6 份,按标准曲线法计算二甲胺的含量和RSD值。原料药、胶囊及缓释片中二甲胺的含量均低于0.01%,RSD均小于4.0%。片剂中的二甲胺含量小于0.04%,RSD小于2.0%,表明该方法重复性良好。
2.7 回收试验
向不同剂型的供试品中分别加入50、100 和150 µg 的二甲胺溶液,制备供试品溶液,得到不同剂型低、中和高浓度的加标样品,每个浓度平行配制3 份,进样分析,计算回收率,结果表明该方法的准确度良好(见表2)。

表2 盐酸二甲双胍原料药及制剂中二甲胺的回收率(n =3)Tab 2 Recovery of dimethylamine in metformin hydrochloride and its preparations (n =3)
2.8 稳定性试验
取各供试品溶液和对照品溶液,分别在0、2、4、6、8、12、24 h 测定。结果各供试品溶液和对照品溶液二甲胺的峰面积RSD均小于2.0%,说明溶液稳定性良好。
2.9 样品测定结果
对6 批原料药、3 批胶囊、9 批片剂及3 批缓释片进行加速试验考察,结果原料药、胶囊、片剂及缓释片中二甲胺的含量均不超过0.05%。其中原料药及胶囊中二甲胺的含量不超过0.002%,片剂中二甲胺的含量在0.006%~0.045%,缓释片中二甲胺的含量在0.002%~0.005%。加速6个月内,原料和各剂型中二甲胺含量增加均不超过0.01%。
3 讨论
3.1 样品处理方法的优化
杨芹等[20]将盐酸二甲双胍用水稀释后直接进样测定,二甲胺能够有效提取,但盐酸二甲双胍在水中易溶,样品中高浓度的盐酸二甲双胍会降低柱效。同时盐酸二甲双胍缓释片在水中发生溶胀,难以获得澄清的供试品溶液。文献报道的盐酸二甲胺的定量限为0.0328 µg·mL-1,为进一步提高检测灵敏度,考虑使用一种溶剂降低供试品溶液中的盐酸二甲双胍含量,而不影响二甲胺的提取[20]。盐酸二甲双胍在乙腈中几乎不溶或不溶,而盐酸二甲胺在乙腈中略溶,能满足试验要求,因此考虑用含少量水的乙腈溶液作提取溶剂。比较了不同含水量的乙腈溶液,结果表明1%乙腈溶液作为原料及胶囊的提取溶剂,10%乙腈溶液作为片剂的提取溶剂,5%乙腈溶液作为缓释片的提取溶剂,能完全提取样品中的盐酸二甲胺。但盐酸二甲胺在乙腈中的稳定性差,室温下1.5 h内稳定,试验发现增加溶剂中的含水量能够提高盐酸二甲胺的稳定性,盐酸二甲胺在50%乙腈溶液和10%乙腈溶液中室温放置,24 h 内稳定。考虑实际试验中操作的便利,将样品用提取溶剂处理后再用水稀释,增加供试品的稳定性。
3.2 色谱条件的优化
Dionex IonPac CS12A 是高容量阳离子交换色谱柱,该色谱柱的离子交换基团除了羧基还添加了膦酸基,增加了离子的选择性[22],适用于快速分离一价和二价阳离子以及铵,并且对0 ~100%乙腈水溶液作溶剂的样品耐受,能够满足本试验的要求。为了达到最优的分离条件,用含二甲胺及环境中易存在的阳离子K+、Na+、Ca2+、NH4+的混合溶液,考察不同的淋洗液浓度(10、15、20 mmol·L-1)、流速(0.8、1、1.2 mL·min-1)及柱温(25、30、35℃)条件下二甲胺与相邻离子的分离情况,结果表明在各淋洗液浓度、流速和柱温条件下二甲胺与相邻离子NH4+和K+分离度均能满足要求(分离度大于1.5)。选择最优条件,淋洗液浓度为10 mmol·L-1,流速为1 mL·min-1,柱温为30℃。
3.3 盐酸二甲胺限度的制订
加速试验研究过程中同时考察了各样品中NDMA 的检出情况,结果发现二甲胺在加速试验6 个月内随时间的延长而含量升高,但均不超过0.05%,除了缓释片中的NDMA 随二甲胺的增大而增大,其他样品中均未检出NDMA,表明二甲胺并不是NDMA 产生的单一影响因素,建议参考欧洲药典10.1 版中盐酸二甲胺的限度规定,将盐酸二甲双胍中盐酸二甲胺的限度拟订为0.05%。
4 结论
本文建立了检测盐酸二甲双胍原料药及其制剂中二甲胺含量的方法,并进行了考察,结果表明该方法操作简便,灵敏度高,可以准确检测盐酸二甲双胍原料药及其制剂中二甲胺的含量,可用于盐酸二甲双胍原料药及其制剂的质量控制。
