菟丝子不同炮制品指纹图谱及多指标成分定量研究
2022-08-08李国卫孙冬梅胡绮萍索彩仙何嘉莹童培珍陈向东曹斯琼广东一方制药有限公司广东省中药配方颗粒企业重点实验室广东佛山528244
李国卫,孙冬梅,胡绮萍,索彩仙,何嘉莹,童培珍,陈向东,曹斯琼(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
菟丝子为旋花科植物南方菟丝子Cuscuta australisR.Br. 或菟丝子Cuscuta chinensisLam.的干燥成熟种子[1],其性味甘、温,归肝、肾、脾经,为常用补益中药。文献研究表明,菟丝子含有金丝桃苷、槲皮素、异槲皮苷等黄酮类化学成分,具有改善心肌缺血、调节机体免疫等多种功效[2-5]。传统中医认为菟丝子生品可养肝明目,多用于目暗不明;菟丝子经盐制后可以引药入肾,能增强补肾固涩作用,常用于阳痿、遗精、胎动不安等。
菟丝子临床使用的饮片有菟丝子、盐菟丝子、炒菟丝子,其中菟丝子、盐菟丝子为2020年版《中国药典》收载品种,炒菟丝子为地方习用炮制品。现菟丝子的文献研究大部分集中在药材的化学成分和质量控制、真伪鉴别等方面[6-9],缺乏对生品及炮制品的系统研究。本研究以菟丝子生品和盐菟丝子、炒菟丝子两种炮制品进行比较研究,通过36 批样品建立了菟丝子药材的超高效液相色谱(UPLC)特征图谱,结合相似度、主成分分析(PCA)和正交偏最小二乘法-判别分析(OPLSDA)探讨影响菟丝子药材和炮制品的差异成分,同时建立了菟丝子药材中8 个指标性成分的含量测定方法,以期控制菟丝子及其炮制品的质量。
1 仪器与材料
Waters H-Class 超高效液相色谱仪(美国Waters公司);Agilent SB 色谱柱(100 mm×2.1 mm,1.8 μm);XP-26 型百万分之一天平、ME204E 型万分之一天平(瑞士Mettler 公司);KQ-500DE 型超声波清洗器(昆山市超声仪器有限公司);甲醇、乙腈为色谱纯(Merk);水为纯化水;其余试剂为分析纯。
绿原酸(批号:110753-202018, 含量:96.10%)、金丝桃苷(批号:111521-201809,含量:94.90%)、异槲皮苷(批号:111809-201403,含量:92.90%)、槲皮素(批号:100081-201509,含量:96.80%)(对照品,中国食品药品检定研究院);紫云英苷(批号:wkq17032404)、异绿原酸A(批号:wkq20020403)、新绿原酸(批号:wkq18030107)(对照品,含量均为98%,四川省维克奇生物科技有限公司);隐绿原酸对照品(批号:DSTDY003501,含量:98%,成都德斯特生物技术有限公司)。所用药材经广东一方制药有限公司魏梅主任中药师鉴定为旋花科植物南方菟丝子Cuscuta australisR.Br.的干燥成熟种子,见表1。

表1 药材信息来源Tab 1 Source of samples
2 方法与结果
2.1 样品炮制
2.1.1 炒菟丝子 《山东省中药饮片炮制规范》2012年版[10]:“取净菟丝子置热锅内,文火炒至微黄,有香气逸出时,取出,放凉”。
2.1.2 盐菟丝子 《中国药典》2020年版[1]:“取净菟丝子,照盐炙法(加盐水拌匀,闷透,置炒制容器内,文火加热,炒至微鼓起,取出,放凉)。”
2.2 色谱条件
以Agilent SB 色谱柱(100 mm×2.1 mm,1.8 μm)为色谱柱;以乙腈(A)-0.1%磷酸溶液(B)为流动相,梯度洗脱(0 ~9 min,7%→11%A;9 ~15 min,11%→14%A;15 ~20 min,14%A;20 ~25 min,14%→25%A;25 ~30 min,25%→27%A;30 ~35 min,27%→93%A);流速为0.3 mL·min-1;柱温为40℃;检测波长为360 nm。
2.3 混合对照品溶液制备
取新绿原酸、金丝桃苷、绿原酸、异槲皮苷、隐绿原酸、异绿原酸A、紫云英苷和槲皮素对照品适量,精密称定,加甲醇制成质量浓度分别为161.112、604.668、200.753、62.798、130.6536、210.834、60.449、100.128 μg·mL-1的混合对照品溶液。
2.4 供试品溶液制备
取样品粉末(过四号筛)约0.5 g,精密称定,置具塞锥形瓶中,加70%甲醇50 mL,加热回流30 min,放冷,补重,摇匀,过滤,即得。
2.5 指纹图谱的建立及分析
2.5.1 精密度试验 取同一供试品溶液,连续进样6 次,以金丝桃苷为参照峰,计算各特征峰相对保留时间和相对峰面积的RSD均<2.0%,表明仪器精密度良好。
2.5.2 稳定性试验 取同一供试品溶液,分别于0、2、4、6、8、12 h 进样测定,以金丝桃苷为参照峰,计算各特征峰相对保留时间和相对峰面积的RSD均<2.0%,表明供试品溶液在12 h 内稳定性良好。
2.5.3 重复性试验 取样品粉末约0.5 g,平行6份,按“2.4”项下方法制备供试品溶液,进样测定,以金丝桃苷为参照峰,计算各特征峰相对保留时间和相对峰面积的RSD均<2.0%,表明该方法重复性良好。
2.5.4 指纹图谱的生成 取36 批样品,按“2.4”项下方法制备供试品溶液,进样测定,分别记录UPLC 特征图谱。采用指纹图谱相似度软件进行结果分析,菟丝子共确定10 个共有峰(见图1),炒菟丝子和盐菟丝子共确定12 个共有峰(见图2~3),其中峰11、峰12 为炮制后产生。5 号峰(金丝桃苷)分离度好,峰形对称,2020年版《中国药典》规定其为评价菟丝子质量的指标性成分,故以5 号峰(金丝桃苷)为参照峰(即为S 峰)。
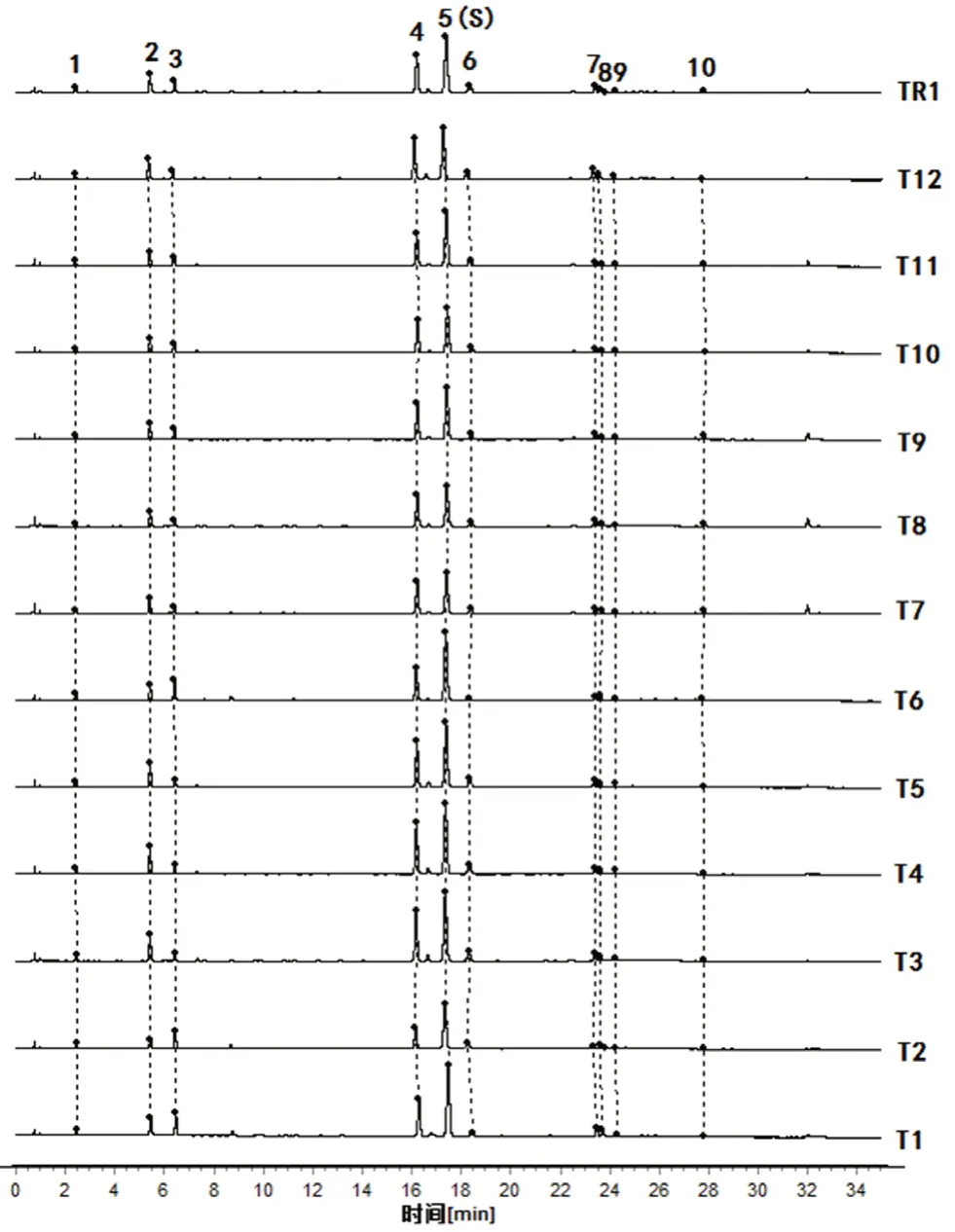
图1 12批菟丝子UPLC 指纹图谱共有峰Fig 1 Common peaks in the UPLC fingerprints of 12 batches of Cuscuta australis R.Br.

图2 12批炒菟丝子UPLC 指纹图谱共有峰Fig 2 Common peaks in the UPLC fingerprints of 12 batches of friedprocessed Cuscuta australis R.Br.
2.5.5 色谱峰指认 通过各对照品保留时间和紫外吸收光谱对共有峰的化学成分进行归属,指认了其中8 个特征峰,分别为峰2 绿原酸(最大吸收波长325 nm),峰5(S)金丝桃苷(最大吸收波长254 nm),峰6 异槲皮苷(最大吸收波长255 nm),峰7 紫云英苷(最大吸收波长264 nm),峰8 异绿原酸A(最大吸收波长327 nm),峰10槲皮素(最大吸收波长254 nm),峰11 新绿原酸(最大吸收波长325 nm),峰12 隐绿原酸(最大吸收波长323 nm)。结果见图4。

图4 菟丝子及其炮制品UPLC 色谱图Fig 4 UPLC chromatograms of Cuscuta australis R.Br. and its processed product
2.5.6 相似度评价 采用指纹图谱相似度软件对36 批样品进行相似度评价,结果见表2。说明同一工艺的样品之间相似度较高,炮制工艺较为稳定。
2.6 多元统计分析
为研究菟丝子炮制前后指纹图谱中总体化学成分的变化,统计36 批样本中12 个色谱峰的峰面积,并将其除以每个样品的称样量,以消除称样量差异造成的影响[11]。
2.6.1 PCA 将36 批样品的色谱峰峰面积数据导入SIMCA 14.1 软件进行分析。提取到两个主成分,累积贡献率达到70.50%,见表3。提取前两个主成分做得分图,见图5。36 批样品得到了较好的划分,第一类(T1 ~T12)为菟丝子,主要分布在第一、四象限,第二类(CT1 ~CT12)为炒菟丝子,主要集中在第二、三象限,第三类(YT1 ~YT12)为盐菟丝子,在第一、二、三象限中均有分布,其中YT6 散落在第四象限。PCA结果表明菟丝子生品与炮制品能较好区分,但两种炮制品分布较为集中,为更好地考察化学计量学方法能否将菟丝子及两种炮制品完全区分,进一步采用OPLS-DA 法对样品进行分析。

图5 主成分得分分布图Fig 5 Principal component score distribution
表3 特征根、各主成分的贡献率Tab 3 Contribution rates of characteristic roots and principal components

图3 12批盐菟丝子UPLC 指纹图谱共有峰Fig 3 Common peaks in UPLC fingerprint of 12 batches of saltprocessed Cuscuta australis R.Br.

表236 批样品相似度评价结果Tab 2 Similarity evaluation of 36 batches of samples
2.6.2 OPLS-DA 将36 批样品数据导入SIMCA-P 14.0 软件进行分析,建立3 组OPLS-DA 模型,见图6。结果显示,菟丝子与炒菟丝子、菟丝子与盐菟丝子、炒菟丝子与盐菟丝子的R2X分别为:0.970、0.912、0.964,R2Y分别为:0.924、0.938、0.842,说明建立的3 组模型能有效解释3 种菟丝子之间的差异;Q2分别为0.569、0.890、0.522,说明模型具有一定的预测能力。通过提取OPLS-DA 模型中12 个变量的VIP 值图(见图7),对12个色谱峰峰面积VIP 值大小进行排列,结果显示F12、F11、F1、F4 的VIP 值均大于1,其中F12为隐绿原酸,F11 为新绿原酸,F1 和F4 为未知成分,有待进一步指认。上述结果说明以上4 种化学成分对菟丝子生品与炮制品分类具有显著的影响,是区分生品与炮制品质量差异的主要标志物。
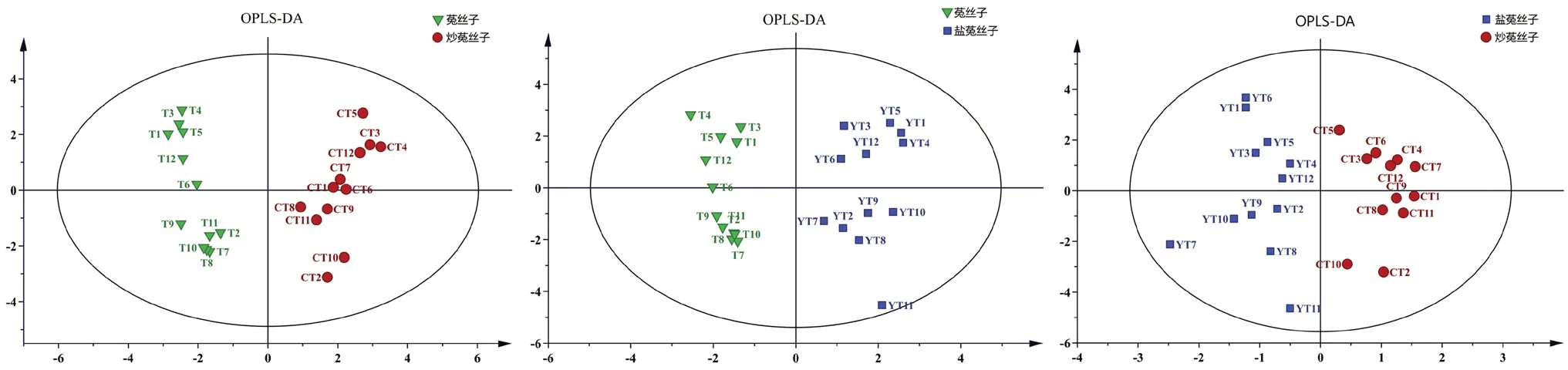
图6 OPLS-DA 得分图Fig 6 Chart of OPLS-DA score
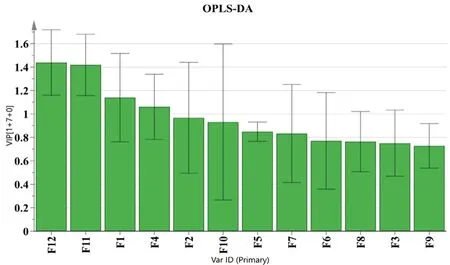
图7 12个化学成分的VIP 值Fig 7 VIP values of 12 chemical components
2.7 多指标含量测定
文献研究发现,菟丝子主要药效成分除常见的黄酮类化合物外,还有酚酸类等化合物[12-13],具有多种功效,如保肝、抗衰老、抗氧化、免疫调节等作用[14],在进行指纹图谱研究的同时,选择黄酮类成分中的金丝桃苷、异槲皮苷、紫云英苷、槲皮素,以及具备抗炎作用的酚酸类物质绿原酸、新绿原酸、隐绿原酸和异绿原酸A 作为菟丝子的质量控制指标,为菟丝子药材和不同炮制品的质量评价提供参考。
2.7.1 系统适用性考察 取“2.3”项下混合对照品溶液,按“2.2”项下色谱条件进样测定,记录色谱图。结果新绿原酸、异槲皮苷、绿原酸、紫云英苷、隐绿原酸、金丝桃苷、异绿原酸A 和槲皮素与相邻色谱峰的分离度均大于1.5,拖尾因子在1.00 ~1.05。
2.7.2 线性关系考察 取“2.3”项下混合对照品溶液,加甲醇稀释制得6 个不同质量浓度的对照品溶液,以峰面积为纵坐标(Y),质量浓度(μg·mL-1)为横坐标(X)进行线性回归,结果各个对照品的线性关系良好,见表4。

表4 回归方程及线性范围Tab 4 Regression equation and linearity
2.7.3 精密度试验 取“2.3”项下混合对照品溶液,连续进样6 次,8 个成分的峰面积RSD分别为1.1%、0.98%、0.81%、1.1%、1.2%、1.2%、0.87%、1.1%(n=6),表明方法精密度良好。
2.7.4 稳定性试验 取同一供试品溶液,分别在室温下放置0、2、4、6、8、12 h 进样测定,记录峰面积。8 个成分的峰面积RSD分别为1.0%、1.1%、0.78%、0.98%、1.3%、1.2%、1.3%、1.8%(n=6),表明供试品溶液在12 h 内稳定性良好。
2.7.5 重复性试验 取样品约0.5 g,平行6 份,按“2.4”项下方法制备成供试品溶液,进样测定,记录峰面积,按外标法计算含量。结果8 个成分的含量RSD分别为0.87%、0.98%、1.0%、1.3%、1.4%、1.0%、1.9%、1.2%(n=6),表明方法重复性良好。
2.7.6 加样回收率考察 精密称取已知含量的炒菟丝子(CT10)0.25 g,平行6 份,加入与样品中含量等量的对照品,按“2.4”项下方法制备供试品溶液,进样测定,计算加样回收率。新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异槲皮苷、紫云英苷、异绿原酸A、槲皮素平均加样回收率分别为95.52%、94.11%、97.24%、93.41%、93.90%、93.88%、93.92%、96.56%,RSD分别为1.5%、0.94%、1.2%、0.47%、2.3%、2.8%、1.3%、1.7%,符合方法学要求。
2.7.7 含量测定结果 精密称取36 批样品,按“2.4”项下方法制备成供试品溶液,进样测定,结果见表5。菟丝子生品及两种炮制品的8 个成分含量存在差异,RSD值在24.9%~92.6%。

表5 含量测定结果(mg·g-1)Tab 5 Content determination (mg·g-1)
2.7.8 方差分析 以上述8 个含量测定指标为检验变量,菟丝子、炒菟丝子和盐菟丝子作为分组变量,通过Shapiro-Wilk 检验法对36 批药材样品的8 个成分数据进行正态分布验证,结果显示金丝桃苷、异槲皮苷、紫云英苷和异绿原酸A 的sig.值小于0.05,不服从正态分布,故采用非参数检验法(秩和检验)进行分析。对菟丝子生品和两种炮制品的8 个指标进行两两比较(Kruskal-Wallis 法)。新绿原酸、绿原酸、隐绿原酸和槲皮素在菟丝子和炒菟丝子以及菟丝子和盐菟丝子间均有显著差异(P<0.05),而在炒菟丝子和盐菟丝子间则无显著差异;金丝桃苷在菟丝子和炒菟丝子间具有显著差异(P<0.05)。上述结果说明菟丝子生品和炮制品含量存在一定差异。
3 分析与讨论
3.1 指纹图谱及多元统计结果分析
菟丝子经加热炮制后特征峰F11、F12、F1和F4 产生了变化,其中,F11 和F12 为菟丝子炮制后产生的特有峰,经指认分别为新绿原酸和隐绿原酸,可作为区分菟丝子生品和炮制品的特征成分,而炒菟丝子与盐菟丝子的指纹图谱则无明显差异,表明菟丝子生品与炮制品存在一定差异,建立的方法可对其进行区分。
3.2 多指标含量结果分析
新绿原酸和隐绿原酸为炒菟丝子和盐菟丝子的特征峰,绿原酸、金丝桃苷、异槲皮苷、紫云英苷和异绿原酸A 在三者中的含量大小排序为:菟丝子>盐菟丝子>炒菟丝子,而槲皮素则在炒菟丝子中占比最高,其次为盐菟丝子、菟丝子。文献研究表明,绿原酸在加热情况下,容易生成新绿原酸和隐绿原酸[15],这可能是导致炒菟丝子和盐菟丝子中绿原酸含量降低的主要原因。加热炮制亦对金丝桃苷含量有显著影响,炮制温度和时间是关键因素[16]。菟丝子经炒黄、盐炙后槲皮素增加,可能是由于以槲皮素为苷元的黄酮苷类受热易分解生成槲皮素所致[17]。定量分析结果显示,菟丝子生品与炮制品在化学成分的含量上存在较大的差异,这与肖岚等[18]的研究结果一致。
3.3 炮制品间差异分析
在含量测定的8 个成分中,两种炮制品间的新绿原酸、绿原酸、隐绿原酸、金丝桃苷、异槲皮苷、紫云英苷以及异绿原酸A 含量数据差异较小,而槲皮素含量则相差一半。盐菟丝子炮制方法比炒菟丝子多了盐水闷润这个环节,炮制受热温度会存在一定差异,猜测这是导致两者间槲皮素含量存在差异的主要原因。本研究结果表明炒菟丝子与盐菟丝子在槲皮素成分上存在较大差异。
本研究从定性和定量两个方面对菟丝子、炒菟丝子和盐菟丝子进行了质量评价,通过多元统计分析手段研究菟丝子炮制前后指纹图谱中特征成分的变化,明确区分炮制前后的特征峰,并测定了8 个主要药效成分的含量,为优选菟丝子炮制工艺提供参考。