矮地茶对刀豆蛋白A致大鼠免疫性肝损伤的保护作用及机制探讨
2022-08-08韩冰程栋梁林世源陈卉张玮奉建芳吴卫桂林医学院药学院广西桂林5499广西中医药大学药学院南宁53000
韩冰,程栋梁,林世源,陈卉,张玮,奉建芳,吴卫*(. 桂林医学院药学院,广西 桂林 5499;. 广西中医药大学药学院,南宁 53000)
据世界卫生组织统计,全球肝脏疾病已达到13 亿,影响人类健康发展并构成全球主要的公共卫生问题之一[1]。病毒性肝炎、自身免疫性肝病、药物性肝损伤以及遗传性肝脏疾病是导致急性肝衰竭及死亡的主要病因。肝脏炎症和肝损伤是免疫细胞和细胞趋化、生长、凋亡因子相互作用的结果,在肝脏疾病的发展过程中起重要作用[2]。由于肝组织血供丰富、流速慢,免疫细胞易停留、作用于肝脏,释放促炎细胞因子及活性氧簇等分子,这些细胞因子和免疫应答之间的相互作用决定了肝脏病理的发展[3-4],如不加以干预治疗,会逐渐演变成肝癌,导致死亡。目前肝脏疾病治疗方式以对症治疗为主,肝移植逐渐在临床上应用,但肝源稀少、治疗费用高、技术设备要求高等限制了其应用[5-6],目前尚无特效治疗药物及手段。
矮地茶为紫金牛科植物紫金牛[Ardisia japonica(Thunb)Blume]的干燥全株,又名平地木、不出林等,广泛分布于长江流域以南各地[7]。《中国药典》2015年版一部记载矮地茶具有化痰止咳、清利湿热、活血化瘀的功效,用于新久咳嗽、湿热黄疸、经闭瘀阻、跌打损伤、风湿痹痛。矮地茶主要含有皂苷类、香豆素类、苯醌类和黄酮类等成分,具有止咳平喘、保肝抗炎、抗病毒、抗肿瘤等药理活性[8-12]。《本草纲目》记载其有治疗肝炎、急性肾炎、膀胱炎等功效。在广西、湖南等地区,民间常用矮地茶来治疗慢性肝炎,取得了良好的治疗效果。但其抗炎保肝作用机制及其药效物质基础尚不明确。
外界异物(病毒、药物、酒精、化学品)进入体内,引发机体自身免疫应答机制,分化大量炎症细胞,浸润肝脏组织是导致肝损伤的主要原因。刀豆球蛋白 A(Con-A)诱导的肝损伤与病毒性肝炎、自身性免疫性肝病和肝衰竭病理生理过程中的肝脏免疫反应极其相似,造模方法已成熟且应用较为广泛[13]。本文以Con-A 诱导的急性肝损伤SD 大鼠为病理模型,探究中药矮地茶对肝损伤的保护作用及机制,为矮地茶进一步开发及应用提供资料。
1 材料
1.1 动物
SPF 级雄性SD 大鼠78 只,4 ~5 周龄,体质量190 ~230 g [湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004],饲养环境室温(23±2)℃,湿度50%~60%。所有大鼠均自由进食饮水,适应性饲养一周。实验用所有动物均经桂林医学院实验动物伦理委员会审查批准(批准号:GLMC201703029)。
1.2 试药
矮地茶经桂林医学院吴卫教授鉴定为紫金牛科植物紫金牛的干燥全株;Con-A 试剂盒(批号:SLBT3093,美国Sigma 公司);血清丙氨酸转氨酶(ALT)试剂盒(批号:20201015)、天冬氨酸转氨酶(AST)试剂盒(批号:20201015)、碱性磷酸酶(ALP)试剂盒(批号:20201015)、丙二醛(MDA)试剂盒(批号:20200724)、超氧化物歧化酶(SOD)试剂盒(批号:20200723)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(批号:20200723)、CD4+试剂盒(批号:E-EL-R2459c)、CD8+试剂盒(批号:E-EL-R0219c)(南京建成生物工程研究所)。
1.3 仪器
KD-TS3A 全自动封闭式组织脱水机、KDBM Ⅱ生物组织冷冻包埋机KD-BL 冷冻台(浙江科迪仪器设备有限公司);生物组织摊片烤片机(湖北伯纳医疗科技有限公司);BX-51 正置荧光显微镜(日本Olympus 公司);iMark 酶标仪(美国Bio-Rad 公司);RE52CS-1 旋转蒸发仪(上海爱朗仪器有限公司);LC-10N-50A 冷冻干燥机(上海力辰邦西仪器科技有限公司);GL-88B 涡旋混合器(其林贝尔仪器制造有限公司);ES-A电子天平(天津德安特有限公司);UV-1800 PC紫外分光光度计(上海美普达仪器有限公司)。
2 方法
2.1 干膏制备
将中药矮地茶全草研磨成粗粉,干燥通风保存。精密称定干燥矮地茶粗粉400 g 4 份,置于2000 mL 圆底烧瓶内,做好标记。分别分批加入10 倍量体积的60%、70%、80%、90%乙醇,加热回流提取两次,首次2.5 h,末次1.5 h。各提取液分别减压浓缩,回收乙醇,冷冻干燥得矮地茶60%、70%、80%、90%乙醇提取物干膏40.08 g、40.26 g、39.86 g、40.38 g。每克干膏相当于生药量9.98 g、9.94 g、10.03 g、9.91 g。阴凉干燥处保存,待后续实验使用(给药浓度均以浸膏重量计)。
2.2 造模及给药
2.2.1 矮地茶不同溶剂提取物的药效学考察 将36 只SD 大鼠随机分为6 组,空白组、模型组及矮地茶干预组(60%、70%、80%、90%乙醇提取物),每组6 只。空白组和模型组灌服等体积生理盐水,矮地茶干预组分别灌服60%、70%、80%、90%乙醇提取物干膏(20 mg·kg-1),1次·d-1,连续给药7 d;末次给药2 h 后,除空白组外,各组大鼠均一次性尾静脉注射剂量为20 mg·kg-1的Con-A 进行造模。造模结束后的各组大鼠,均禁食不禁水12 h,称定大鼠体质量后取样。
2.2.2 矮地茶不同给药剂量的药效学考察 在确定矮地茶提取溶剂(80%乙醇)的基础上,进行给药剂量的考察。将30 只SD 大鼠随机分为5 组,空白组、模型组及矮地茶低、中、高剂量组(10、20、30 mg·kg-13 种给药剂量),每组6 只。空白组和模型组灌服等体积生理盐水,矮地茶干预组分别灌服对应剂量矮地茶,1 次·d-1,连续给药7 d;末次给药2 h 后,除空白组外,各组大鼠均一次性尾静脉注射20 mg·kg-1Con-A 造模。造模结束的各组大鼠,均禁食不禁水12 h,称定大鼠体质量后,异氟烷麻醉,开始取样。
2.3 血清ALT、AST、ALP 水平的测定
造模12 h 后,将各组SD 大鼠用异氟烷麻醉,酒精消毒,腹主动脉取血,使用肝素抗凝,3500 r·min-1离心10 min 后取上清液,-20℃冰箱保存待用。于一周内按试剂盒操作检测血清ALT、AST、ALP 水平。
2.4 肝脏指数、脾脏指数的测定
造模12 h 后,将各组大鼠用异氟烷麻醉,酒精消毒,腹主动脉取血后,取肝脏、脾脏称定质量,颈椎脱臼处死大鼠,计算肝脏指数、脾脏指数[肝脏或脾脏质量/体质量×100%]。
2.5 肝脏组织中 MDA、SOD、HYP、GSH-Px 水平的测定
剪取肝右小叶同一部位组织,于冰浴中用生理盐水制成10%肝组织匀浆并离心,取上清液,置-20℃冰箱保存待用。于一周内按试剂盒操作检测MDA、SOD、GSH-Px 水平。
2.6 HE 染色观察肝脏组织病理
取肝左叶同一部位组织,修剪为1 cm3大小组织块,中性甲醛固定,脱水、包埋、常规制备切片,HE 染色,光镜下观察病理切片并拍照。
2.7 ELISA 检测淋巴细胞中的CD4+、CD8+
剪取肝右小叶同一部位组织,于冰浴中用生理盐水制成10%肝组织匀浆并离心,取上清液,置于-20℃冰箱保存待用。根据试剂盒操作要求稀释成相应浓度肝组织匀浆进行CD4+、CD8+阳性细胞数量的测定。
2.8 统计学分析
应用GraphPad Prism 8 软件进行分析,血清与肝脏组织检测指标以(±s)表示,符合正态分布且方差齐性资料采用独立样本t检验;以P≤0.05 为差异有统计学意义。
3 结果
3.1 矮地茶不同溶剂提取物的药效学考察
3.1.1 不同溶剂提取物对肝损伤大鼠肝脾指数的影响 模型组较空白组肝脏、脾脏指数均显著升高(P<0.01,P<0.001);与模型组相比,60%、90%乙醇提取物肝脏指数均无明显差异。70%、80%乙醇组肝脏指数显著降低(P<0.05)。矮地茶各个浓度乙醇提物组脾脏指数较模型组均无明显差异(见表1)。

表1 矮地茶不同溶剂提取物对大鼠肝脏、脾脏指数的影响Tab 1 Effect of different extraction of Ardisiae japonicae herba on liver and spleen index in rats
3.1.2 不同溶剂提取物对肝损伤大鼠血清AST、ALT 的影响 与空白组相比,模型组大鼠血清AST、ALT 水平显著升高(P<0.0001);与模型组相比,矮地茶70%、90%乙醇提取物对AST、ALT 水平无降低作用;60%乙醇提取物物能够显著降低AST 水平但对ALT 水平无影响;80%乙醇提取物组AST、ALT 水平均显著降低(P<0.01,P<0.001),见图1。

图1 矮地茶不同溶剂提取物对大鼠血清AST、ALT 的影响Fig 1 Effect of different extraction of Ardisiae japonicae herba on the serum AST and ALT in rats
3.1.3 不同溶剂提取物对肝损伤大鼠肝组织病理变化的影响 HE 染色结果显示,模型组肝细胞索断裂且排列混乱,细胞肿胀,细胞膜边缘模糊,有炎性细胞浸润。80%乙醇提取物组肝索排列较模型组整齐,且细胞无明显肿胀(见图2)。

图2 矮地茶不同溶剂提取物对大鼠肝组织病理变化的影响Fig 2 Effect of different extraction of Ardisiae japonicae herba on hepatic tissue pathological features in rats
3.2 矮地茶80%乙醇提取物不同给药剂量的药效学考察
3.2.1 不同给药剂量对肝损伤大鼠肝脾指数的影响 与空白组相比,模型组肝脏、脾脏指数显著增大(P<0.001)。与模型组相比,矮地茶低、中剂量组能降低大鼠肝脏指数(P<0.05),高剂量组肝脏指数虽有降低但差异无统计学意义。矮地茶低、中、高剂量组脾脏指数与模型组相比均无显著差异(见表2)。

表2 不同给药剂量对大鼠肝脾指数的影响Tab 2 Effect of different doses on liver and spleen index in rats
3.2.2 不同给药剂量对肝损伤大鼠血清AST、ALT、ALP 的影响 如图3所示,与空白组相比,模型组血清AST、ALT、ALP 活性显著升高(P<0.001);与模型组相比,矮地茶低、中、高剂量组均能降低AST、ALT 活性(P<0.05,P<0.01,P<0.001);矮地茶低、中剂量组均能降低ALP 活性(P<0.01)。

图3 矮地茶不同给药剂量对大鼠血清AST、ALT、ALP 的影响Fig 3 Effect of different doses of Ardisiae japonicae herba on the serum AST,ALT and ALP in rats
3.2.3 不同给药剂量对肝损伤大鼠MDA、SOD、GSH-Px 的影响 如图4所示,与空白组相比,模型组肝组织GSH-Px、SOD 水平显著降低(P<0.001),MDA 水平显著升高(P<0.0001);与模型组相比,矮地茶低、中剂量组均能显著降低MDA 水平(P<0.05),高剂量组无改善;矮地茶低、中、高剂量组能显著升高SOD(P<0.001)及GSH-Px 活力水平(P<0.01,P<0.001),中剂量组最为明显。
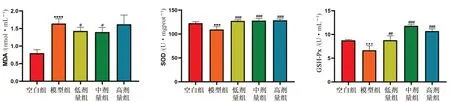
图4 矮地茶不同给药剂量对MDA、SOD、GSH-Px 的影响Fig 4 Effect of different doses of Ardisiae japonicae herba on MDA,SOD and GSH-Px
3.2.4 不同给药剂量对肝损伤大鼠肝组织CD4+、CD8+数量的影响 如图5所示,与空白组相比,模型组T 淋巴细胞CD4+、CD8+细胞数量均显著上升(P<0.05,P<0.001)。与模型组相比,矮地茶各干预组CD4+、CD8+细胞数量显著降低(P<0.05,P<0.01)。

图5 矮地茶不同给药剂量对CD4+、CD8+的影响Fig 5 Effect of different doses of Ardisiae japonicae herba on CD4+and CD8+
3.2.5 不同给药剂量对肝损伤大鼠肝组织病理变化的影响 如图6所示,模型组肝索排列紊乱,有肝索断裂迹象。细胞膜边缘模糊,且细胞肿胀明显,伴有大量炎性浸润。矮地茶各干预组肝索排列较为整齐,炎性浸润肉眼可见有所减轻,中剂量组的保护作用较其他组显著。

图6 矮地茶不同给药剂量对大鼠肝组织病理变化的影响Fig 6 Effect of different doses of Ardisiae japonicae herba on hepatic tissue pathological features in rats
4 讨论
中药矮地茶为南方地区民间草药,常用于治疗肝炎,但缺乏相应的理论研究。本文通过Con-A 诱导免疫性肝损伤大鼠动物模型,探讨矮地茶抗炎保肝的药效及作用机制,为民间用药的合理性提供理论依据。
本文主要以血清AST、ALT、ALP 水平和HE 病理切片以及肝组织MDA、SOD、GSH-Px、T 淋巴细胞亚群指标来初步探究矮地茶抗Con-A诱导肝损伤药效及保护作用机制。血清AST、ALT、ALP 可以反映肝细胞受损程度以及线粒体损伤的情况[14],AST 与ALT 存在于肝细胞质与线粒体,并作用于肝脏,当肝细胞受损,这两种酶便释放到血液中。本研究发现,矮地茶降低血清中AST、ALT、ALP 水平效果明显,证明对Con-A 诱导的肝损伤有一定的保护作用。
此前,已有研究证明肝损伤过程中氧化应激指标异常,MDA 为机体脂质过氧化物的最终产物,可严重破坏细胞膜结构,间接反映肝细胞损伤程度。SOD 是源于机体的活性物质,能消除机体在新陈代谢过程中产生的具有氧化性质的一类物质即活性氧(ROS),降低由ROS 引起的机体过氧化产生的肝损伤[15]。本研究发现大鼠经Con-A 诱导建模后,模型组肝组织中MDA 水平显著升高,SOD 活力水平显著降低,提示Con-A可能诱导肝组织细胞一系列氧化应激反应,抑制SOD 的活力,从而降低机体清除ROS 的能力,加重肝细胞损伤。GSH 是细胞抗氧化主要成分,在肝脏内合成最多,GSH-Px 酶以GSH 为底物,限制脂质过氧化,从而预防细胞膜受损,减少机体氧化反应产生的自由基对DNA 的损害,从而对肝脏起到保护作用。结果表明,Con-A 诱导SD 大鼠造模后,GSH-Px 活力显著降低,矮地茶干预后,能够有效降低MDA 水平,升高SOD 活力水平,上调GSH-Px 活力水平,推测矮地茶可能通过调控氧化应激反应来应对Con-A 诱导的肝损伤作用。
研究表明,Con-A 诱导肝损伤动物模型主要是通过活化T 淋巴细胞致免疫性肝损伤,Con-A刺激T 淋巴细胞,激活肝脏组织免疫反应,CD4+、CD8+两种T 淋巴细胞集聚肝门区,释放炎症因子攻击肝组织,致使肝细胞坏死、凋亡,肝组织受损[3,13]。CD4+为辅助T 细胞(Th 细胞)的总称,Th 细胞受刺激后会分化成Th0、Th1、Th2 等,这些被活化得的淋巴细胞会分泌IL-6、IL-10、TNF-α、IFN-γ等炎症因子,炎症因子浸润肝细胞导致损伤产生。本研究发现CD4+、CD8+两种T 淋巴细胞在模型组较空白组表达显著升高,矮地茶干预组能够降低CD4+、CD8+T 淋巴细胞表达,抑制T 淋巴细胞分化,调节T 淋巴细胞亚群,改善免疫功能紊乱,降低炎症因子对于肝脏组织的浸润,起到保护肝脏组织的作用。
综上,矮地茶80%乙醇提取物中20 mg·kg-1剂量组在降低AST、ALT、ALP、MDA、CD4+、CD8+水平,在升高GSH-Px、SOD 水平最为显著。本文通过Con-A 诱导免疫性肝损伤大鼠动物模型,探讨矮地茶抗炎保肝的药效及作用机制,为民间用药的合理性提供理论依据。
