山羊结肠小袋纤毛虫和A型产气荚膜梭菌混合感染的病原学分析
2022-08-06陈凌志黄紫贝徐康智孙启亮王彦红刘文博许金俊潘志明陶建平焦库华候照峰
陈凌志 , 黄紫贝 , 徐康智 , 李 俊 , 孙启亮 , 王彦红 , 刘文博 ,许金俊 , 潘志明 , 陶建平 , 焦库华 , 候照峰
(1.扬州大学兽医学院 , 江苏 扬州 225009 ; 2.江苏省动物重要疫病与人兽共患病防控协同创新中心 , 江苏 扬州 225009 ;3.江苏省人兽共患病学重点实验室 , 江苏 扬州 225009 ; 4.菏泽市食品药品检验检测研究院 , 山东 菏泽 274000)
江苏省南通市通州区某养殖户共饲养200只山羊,3月龄,近5 d内发病,发病率为15%(30/200),死亡4只,于2021年5月14日送至扬州大学动物医院就诊,该养殖户采用圈养结合放牧的饲养方式,圈舍为临时搭建而成,卫生条件较差,排泄物清理不及时,养殖户曾使用阿苯达唑伊维菌素驱虫,并已注射小反刍兽疫疫苗。患病山羊普遍食欲不振,腹泻,粪便带有黏液,气味略腥臭,并有少数眼球下陷,近2 d已注射土霉素,未见明显效果。本试验通过对腹泻山羊进行解剖检查、实验室诊断和病原学鉴定,确诊其为大量结肠小袋纤毛虫(Balantioidescoli)和产气荚膜梭菌(Clostridiumperfringens)的混合感染病例,该起病例报道及其病原学诊断方法可为养殖产业中山羊腹泻的防控工作提供理论指导。
1 材料与方法
1.1 主要试剂 产气荚膜梭菌测定用培养基,16S rDNA Bacterial Identification PCR Kit(TaKaRa公司),OxoidTMAnaeroGenTM厌氧袋(Thermo scientific公司)等。
1.2 解剖与显微镜检查 对病死羊只进行剖检,观察各实质器官病理变化。无菌采集山羊各段肠道黏膜和内容物,分别收集至洁净样品袋中送至实验室,用镊子挑取少量样品,与蒸馏水混匀涂片,盖玻片直接压片后,置于光学显微镜下观察。
1.3 细菌分离 采集肝脏、肾脏、小肠、盲肠等病变组织,无菌接种于绵羊血平板,分别在37 ℃需氧和厌氧条件下培养24 h。随后,挑取单菌落接种于产气荚膜梭菌测定用培养基,37 ℃厌氧培养24 h,并进行2次纯化,纯化后选取典型菌落观察生物学形态并进行革兰染色镜检。
1.4 分离菌16S rDNA鉴定 参照16S rDNA Bacterial Identification PCR Kit操作说明书,挑取单个菌落于200 μL超纯水中,100 ℃煮沸10 min,离心取上清5~10 μL作为模板,采用试剂盒提供的引物进行PCR扩增。PCR反应体系:PCRPremix25 μL,上游和下游引物各0.5 μL,DNA模板50~100 ng,加16S-free H2O至总体积50 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,50~55 ℃退火1 min,72 ℃延伸1.5 min,共30个循环;最后72 ℃延伸5 min。反应结束后取5 μL PCR扩增产物进行1.2%琼脂糖凝胶电泳分析,PCR纯化产物送至北京擎科生物科技有限公司测序。
1.5 分离菌16S rDNA遗传进化分析 将所得序列在NCBI网站进行BLAST搜索比对,分析所得序列与GenBank已公布序列的同源性,选取相同宿主和不同宿主源细菌16S rDNA序列,运用MEGA 5.0软件构建系统发育树,鉴定所分离细菌的种属。
1.6 细菌毒力分型鉴定 采用多重PCR方法鉴定分离菌毒素分型,参照参考文献[1]引物信息,由南京金斯瑞生物科技公司合成plc、iap、etx、netB、cpe和cpb共6对特异性引物,进行多重PCR扩增,PCR产物进行1%琼脂糖凝胶电泳,将目的片段送北京擎科生物科技有限公司进行测序比对,进一步确定产气荚膜梭菌分型。
1.7 药敏试验 通过Kirby-Bauer(K-B)纸片琼脂扩散法测定山羊分离菌对常见抗菌药物的耐药性[2],无菌操作将分离菌的纯培养物均匀涂抹于营养琼脂平板上,置于37 ℃培养箱中培养18~24 h后,测量抑菌圈直径。
2 结果
2.1 病死山羊剖检病变 送检病死山羊,剖检病变发现肺脏气肿、局部出血,肝脏肿大、淤血,胆囊异常肿大,胆汁浓稠,脾脏坏死、出血,肾脏水肿、质软,肠道组织表现出典型的病理变化,如肠管内大量水样稀便、黏膜出血等。
2.2 肠道黏膜与内容物显微镜检查 取各段肠道黏膜与内容物进行实验室显微镜检查,未发现球虫卵囊及线虫、吸虫、绦虫等虫卵或虫体节片等,但在结肠和盲肠内容物中观察到大量结肠小袋纤毛虫滋养体(图1)。山羊结肠小袋纤毛滋养体呈梨形或卵圆形,大小约45.85 μm × 112.33 μm,全身附有纤毛,虫体前端纤毛较长,后端钝圆、略尖,纤毛摆动呈规律的波浪状,使身体旋转或向前快速移动。
2.3 细菌分离与纯化 取病羊肝脏、肾脏、小肠和盲肠等组织病料,进行细菌分离培养。在有氧环境下培养24 h,绵羊血平板上未见双溶血菌落,而厌氧培养24 h后,可见边缘整齐、光滑湿润、圆形隆起、透明双溶血菌落。随后,于产气荚膜梭菌测定用培养基厌氧培养24 h后,形成典型的黑色菌落形态,挑取黑色单菌落进行2次纯化(图2),革兰染色镜检,显示分离菌为直杆状,两端钝缘,单个或成双的革兰阳性菌。

图2 细菌分离和纯化Fig.2 Bacteria isolation and purification
2.4 分离菌16S rDNA鉴定 采用16S rDNA Bacterial Identication PCR Kit对分离菌菌落DNA进行PCR扩增,扩增的DNA片段经琼脂糖凝胶电泳分析后进行测序验证。结果如图3所示,分离菌菌落经PCR扩增,产生1条约500 bp大小的特征条带。经测序验证,成功获得分离菌16S rDNA序列。

图3 16S rDNA的PCR扩增Fig.3 PCR amplification of 16S rDNA M:DL2 000 DNA Marker; P:阳性对照; 1:分离菌; N:阴性对照M: DL2 000 DNA Marker; P: Positive control; 1: Isolated strain; N: Negative control
2.5 分离菌16S rDNA遗传进化分析 将所得序列于NCBI数据库进行BLAST分析,显示本试验中山羊分离株16S rDNA序列与产气荚膜梭菌同源性均在99%以上,因此确定山羊分离株为产气荚膜梭菌,并命名为NTCPG1。选取分离于不同国家和地区的猪、鸡、鸭、山羊和绵羊来源的产气荚膜梭菌16S rDNA基因序列进行遗传进化分析,结果如图4所示,所有分离株共分为2个大的分支,本试验分离于山羊的产气荚膜梭菌NTCPG1株与来源于巴基斯坦的山羊分离株(GenBank:MW551947.1)、绵羊分离株(GenBank:MW556208.1)及来源于国内的猪源分离株(GenBank:KX094442.1)位列同一分支,且与分离于芬兰的猪源产气荚膜梭菌(GenBank:CP075903.1)亲缘关系最近。
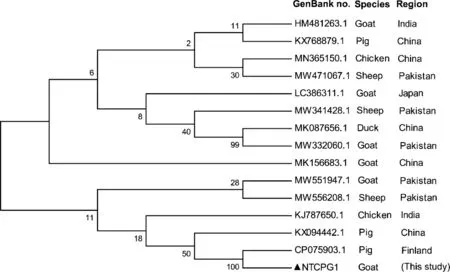
图4 16S rDNA系统发育树Fig.4 Phylogenetic tree of 16S rDNA▲:本试验分离的山羊产气荚膜梭菌分离株▲:C. perfringens isolated from goat in this study
2.6 毒力基因分型 多重PCR毒力基因分型中plc、iap、etx、netB、cpe基因和cpb基因片段大小分别对应324、461、656、738、233 bp和196 bp,电泳结果如图5所示,山羊分离株NTCPG1株仅出现1条324 bp左右目的条带,初步判定为plc基因,经测序验证确为plc基因,因此,山羊分离株NTCPG1株为A型产气荚膜梭菌。

图5 毒力基因的PCR扩增Fig.5 PCR amplification of virulence genes M:φX174-HaeⅢ digest DNA Marker; 1~4: 山羊分离株NTCPG1; N:阴性对照M: φX174-HaeⅢ digest DNA Marker; 1-4: NTCPG1 strain isolated from goat; N: Negative control
2.7 药敏试验 结果见表1,山羊NTCPG1分离菌对氨基糖苷类(妥布霉素、链霉素、新霉素、庆大霉素、卡那霉素),复方新诺明和氟苯尼考等抗生素耐药;而对青霉素类(阿莫西林、美洛西林),头孢菌素类(头孢曲松钠、头孢哌酮、头孢噻肟),喹诺酮类(环丙沙星、左氧氟沙星),多西环素和多黏菌素B等抗生素敏感。

表1 山羊NTCPG1分离菌药敏试验结果Table 1 Result of drug susceptibility test for NTCPG1 strain from goat
3 讨论
羊传染性腹泻是临床生产中较为常见的消化道疾病,该病由多种病原单独或混合感染引起,临床上常见病原如大肠埃希菌、沙门菌、魏氏梭菌、金黄色葡萄球菌、小反刍兽疫病毒、球虫、结肠小袋纤毛虫、蛔虫、绦虫等,均可导致腹泻症状,并造成较高病死率。本试验腹泻病羊经病原学分析和鉴定,诊断为结肠小袋纤毛虫滋养体和A型产气荚膜梭菌混合感染,该2种病原均属人兽共患病原。在以往的临床生产中,结肠小袋纤毛虫和产气荚膜梭菌单独感染的病例已有较多报道,但二者混合感染的病例分析较为少见。
结肠小袋纤毛虫可入侵人或动物大肠壁,引起以腹泻、脱水、消瘦和贫血为特征的肠道原虫病[3],该病呈全球性分布[4],且在国内大部分地区广泛流行,严重威胁人畜安全[5]。目前,有关结肠小袋纤毛虫的病例分析多见于猪,而羊结肠小袋纤毛虫少有报道[6-7]。研究发现,结肠小袋纤毛虫在宿主体内繁殖能力极强,动物摄入极少量包囊即可能造成严重感染[4],同时,该病原对高温、阳光、干燥等因素非常敏感,而对阴湿环境更为适应[7],因此,该病的发生多与饲养环境和卫生条件相关。本病例中病羊饲养场地为临时搭建而成,平时卫生条件较差,排泄物清理不及时等,为结肠小袋纤毛虫的感染创造了有利条件。
产气荚膜梭菌多存在于食物、污水、土壤及人、畜肠道中,能引起人类和畜禽的多种肠道疾病,同时也是畜禽坏疽性皮炎、肠毒血症和坏死性肠炎的主要病原[8]。目前已经证实产气荚膜梭菌至少存在19种以上毒素,其中最主要为α、β、ɛ、毒素[9],并依此分为A、B、C、D和E共5个毒素型[10-11]。尽管不同毒素的致病机制有所区别,但其致病性均很强[12],研究表明,产气荚膜梭菌可引起羔羊痢疾、肠毒血症、羊猝狙等疫病[13],感染羊只表现为发病急、病程短、死亡率高[14],尤其可引起膘情较好的羊急性死亡[15],这与本试验病例的发病特点一致。目前,羊源产气荚膜梭菌主要有A、B、C、D型,来源于国内不同地区的流行病学调查数据显示,A型羊源产气荚膜梭菌感染率最高,是肉羊体内的主要流行菌株[12,16],该型菌株可导致羊肠毒血症[16],病羊表现为多器官组织坏死、水肿或充血、出血等病变[17],与本试验NTCPG1株感染引起的病理变化相符。另外,本试验遗传进化分析结果显示,来源于不同国家不同宿主的产气荚膜梭菌16S rDNA序列同源性均较高,且NTCPG1株与猪源和羊源分离株亲缘关系较近,提示该菌存在跨地区跨物种的传播特性。本试验药敏试验结果发现,山羊NTCPG1分离菌主要对氨基糖苷类抗生素表现为多重耐药,这与分离自北京和山西等地的产气荚膜梭菌耐药表型一致[18],而与分离于陕西、青海、宁夏三地区呈磺胺类耐药表型的特点不尽一致[12]。尽管不同地区间存在差异,但以上结果均表明,山羊产气荚膜梭菌的多重耐药愈发严重,提示临床上应规范使用抗生素,并可合理的联合或交叉使用敏感药物进行预防治疗。
以往羊腹泻病例分析多为病原单独感染或多种细菌混合感染[19],鲜有寄生虫与其他病原混合感染的病例报道,这在一定程度上表明寄生虫在临床生产中的重要性和危害性未能引起足够重视。在实际临床生产中,结肠小袋纤毛虫感染非常普遍,主要以慢性感染或无症状感染为主,仅少数导致急性腹泻[20],但与其他病原混合感染时,可加速破坏肠道黏膜的免疫系统,造成宿主发病率和死亡率上升,并增加了治疗难度[4]。本试验中山羊病例在腹泻初期,曾采用抗生素注射治疗,但未见明显效果,在随后的治疗措施中,建议养殖场采用地美硝唑与环丙沙星联合用药,并加强圈舍清理和消毒,治疗后病羊腹泻情况得到明显改善,表明结肠小袋纤毛虫在该病的发生和发展中起到了重要作用。
