犊牛源大肠杆菌的分离鉴定与耐药性分析
2022-08-06张丹丹王栋才张元庆
梁 圆 , 张丹丹 , 程 景 , 李 博 , 靳 光 , 王栋才 , 张元庆
(1.山西农业大学动物医学学院 , 山西 太原 030031 ; 2.山西农业大学动物科学学院 , 山西 太原 030032)
大肠杆菌(Escherichiacoli,E.coli)是一种肠道常见菌,可引起犊牛腹泻、出血性肠炎等症状。目前抗生素仍是治疗大肠杆菌感染的重要手段,但随着养牛业规模化程度迅速提高,犊牛腹泻的发病率逐年上升,大量抗菌药物的不合理使用导致大肠杆菌耐药性问题频发,交叉耐药和多重耐药也愈发严重,临床治疗难度加大,给养殖场造成了重大的经济损失[1-2]。细菌为了更好的适应外部环境,可通过多种途径将抗菌药物对自身的影响最小化,其中对可移动基因元件(转座子、整合子、整合与接合元件)的研究越来越受青睐,整合子是一种存在于细菌染色体、质粒和转座子上的可移动基因元件,是耐药基因水平传播的重要媒介,它可以通过位点特异性重组整合耐药基因盒,使细菌产生耐药性[3-5]。
本研究采集晋北地区规模化牛场腹泻犊牛肛拭子分离鉴定大肠杆菌,开展药物敏感性、耐药基因和整合子-基因盒的检测,探究耐药表型与所携带耐药基因和整合子的相关性,为养殖场合理用药和牛源大肠杆菌耐药机制研究提供参考。
1 材料与方法
1.1 病料来源和主要试剂 2020年从晋北忻州、朔州和大同市3个养牛场无菌收集腹泻犊牛肛门拭子27份。伊红美蓝琼脂、麦康凯琼脂和Luria-Bertani(LB)肉汤,均购自金克隆生物技术有限公司;药敏纸片,购自杭州滨和微生物试剂有限公司;Ezup柱式细菌基因组DNA抽提试剂盒、2×TaqPCR Mix、DNA Marker等,均购自生工生物工程(上海)股份有限公司。
1.2 细菌分离及PCR鉴定 在放有肛门拭子的2 mL离心管中加入1.5 mL LB肉汤,于37 ℃培养4 h后,划线接种于麦康凯琼脂平板,37 ℃培养过夜,挑取粉红色单菌落接种于1 mL LB肉汤中,37 ℃培养3 h后划线接种于伊红美蓝琼脂平板,37 ℃培养过夜,挑取带金属光泽的紫黑色单菌落接种于LB肉汤增殖培养。
从GenBank下载大肠杆菌16S rRNA基因序列(OK148132.1),利用Primer-BLAST设计引物(F:5′-ACGCGAAGAACCTTACCTGG-3′/R:5′-CTCCAATCCGGACTACGACG-3′),以分离株培养液提取的基因组DNA为模板进行PCR鉴定,随机选择5份PCR产物测序。
1.3 分离株耐药表型检测 参照美国临床实验室标准化委员会(CLSI)推荐的纸片扩散法(K-B法)进行药敏试验,测定分离株对6类15种抗菌药物的敏感性。
1.4 分离株耐药基因检测 从GenBank下载大肠杆菌耐药基因序列(6类15种),包括β-内酰胺类:blaTEM、blaCTX-M-1;氨基糖苷类:aadA1、strA;磺胺类:sul1、sul2;喹诺酮类:GyrA、GyrB、ParC;氯霉素类:cat、FloR、cmlA;四环素类:tetA、tetB、tetM,利用Primer-BLAST在线设计引物,引物序列见表1。以分离株基因组DNA为模板,采用PCR检测上述各类耐药基因。
1.5 分离株整合子-基因盒检测 参照参考文献[6]合成Ⅰ、Ⅱ、Ⅲ类整合子的整合酶(Integrase,intI)基因引物及耐药基因盒结构的引物。以基因组DNA为模板,检测分离株整合子的携带情况,对携带整合子的菌株PCR扩增可变区,产物测序后结果经GenBank数据库序列比对,以分析可变区基因盒结构和3′保守区域。
1.6 耐药表型与耐药基因、整合子-基因盒的相关性分析 以在耐药基因阳性菌株中表型耐药菌株的占比计算耐药基因与耐药表型的符合率;利用SPSS 17软件采用Fisher确切概率法分析整合子与耐药表型的相关性,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 细菌分离及PCR鉴定 将采集的犊牛肛拭子培养液划线接种于麦康凯琼脂平板上,长出粉红色菌落;接种于伊红美蓝琼脂平板上,长出带绿色金属光泽的紫黑色菌落,再通过16S rDNA菌种鉴定,最后得到牛源大肠杆菌24株。
2.2 分离株耐药表型检测 药敏试验结果如图1所示,24株牛源大肠杆菌对6类15种抗菌药物呈现不同程度的耐药,对β-内酰胺类抗菌药耐药性最高,头孢噻肟、头孢唑林和氨苄西林耐药菌株占95.83%(23/24);对喹诺酮类抗菌药耐药性最低,诺氟沙星、环丙沙星和氧氟沙星耐药菌株占比分别为16.67%(4/24)、16.67%(4/24)、12.50%(3/24);对氨基糖苷类、四环素类和氯霉素类抗菌药耐药的菌株占比在16.67%~70.83%,其中对氨基糖苷类抗菌药耐药水平跨度较大,庆大霉素耐药菌株占62.50%(15/24),而对阿米卡星较敏感,耐药菌株占比为16.67%(4/24)。

图1 24株大肠杆菌对15种抗菌药物的耐药情况Fig. 1 Resistance of 24 strains of E.coli to 15 kinds of antibacterial drugsCTX:头孢噻肟; CZ:头孢唑林; AMP:氨苄西林; SM:链霉素; KM:卡那霉素; CN:庆大霉素; AK:阿米卡星; TMP:甲氧苄啶; SXT:复方新诺明; NOR:诺氟沙星; CIP:环丙沙星; OFX:氧氟沙星; TET:四环素; DO:多西环素; C:氯霉素; 下同CTX:Cefotaxime; CZ:Cephazolin; AMP:Ampicillin; SM:Streptomycin; KM:Kanamycin; CN:Gentamicin; AK:Amikacin; TMP:Trimethoprim; SXT:Compound sulfamethoxazole; NOR:Norfloxacin; CIP:Ciprofloxacin; OFX:Ofloxacin; TET:Tetracycline; DO:Doxycycline; C:Chloramphenicol. The same as below

表1 耐药基因引物Table 1 Primers for resistance genes
24株牛源大肠杆菌中,对3类及3类以上抗菌药物耐药的多重耐药菌占70.83%(17/24),对所测试抗菌药物全部敏感的菌株占4.17%(1/24),有3株菌对14种抗菌药物都耐药。多重耐药集中分布在4~6重,4重耐药占比最高,为33.33%(8/24),多重耐药谱型共有14种,以CTX+CZ+AMP+TMP+SXT+SM+TET+CN占比最高,为12.50%(3/24)(表2)。

表2 大肠杆菌分离株的多重耐药谱型Table 2 Type of multi-drug resistance of E.coli isolates
2.3 分离株耐药基因检测 采用PCR检测24株大肠杆菌对6类15种耐药基因的携带情况,结果如图2所示,6类耐药基因均有检出,共检测到13种耐药基因,检出率分别为:β-内酰胺类耐药基因blaTEM(79.17%)、blaCTX-M-1(79.17%);氨基糖苷类aadA1(8.33%)、strA(75.00%);磺胺类sul1(62.50%)、sul2(70.83%);喹诺酮类GyrA(95.83%)、GyrB(100%)、ParC(83.33%);氯霉素类cat(4.17%)、FloR(37.50%);四环素类tetA(66.67%)、tetB(8.33%),没有检测到tetM和cmlA耐药基因。
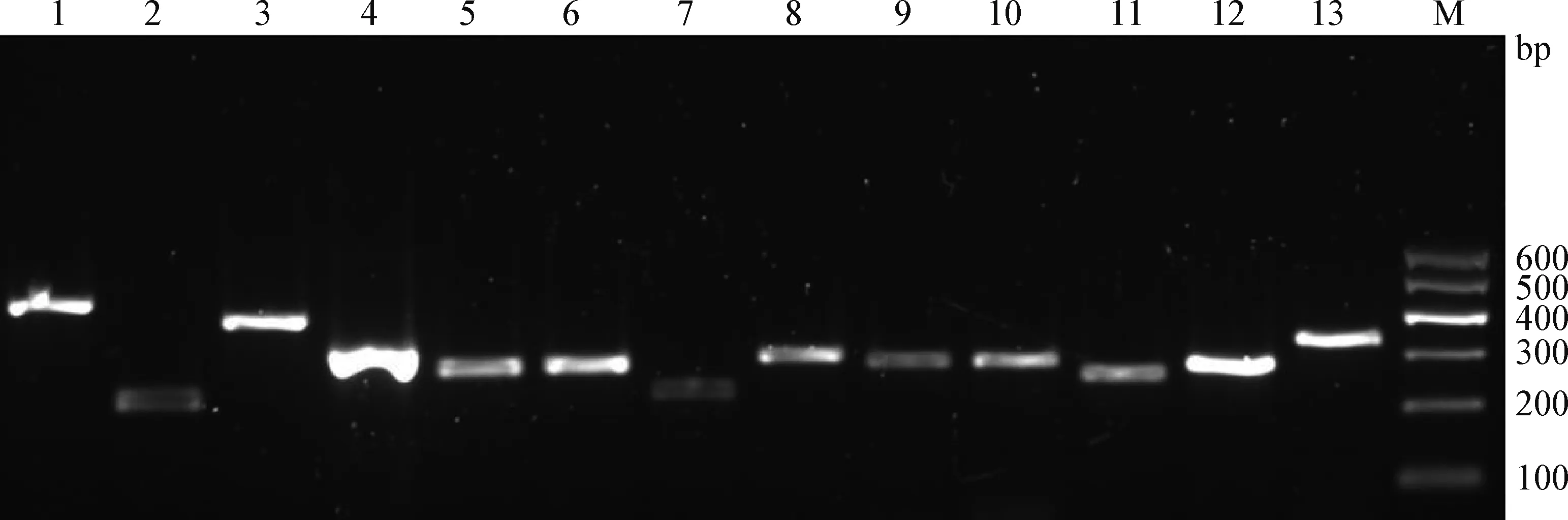
图2 大肠杆菌耐药基因的PCR扩增Fig.2 PCR amplification of E.coli resistance genesM:DL600 Marker; 1~13:blaCTX-M-1、blaTEM、strA、aadA1、sul1、sul2、GyrA、GyrB、ParC、tetA、tetB、cat、FloR
2.4 分离株整合子-基因盒检测 24株大肠杆菌中,检出有19株携带Ⅰ类整合子(图3A),检出率为79.17%(19/24),未检出Ⅱ、Ⅲ类整合子。

图3 Ⅰ类整合子-基因盒的PCR扩增Fig.3 PCR amplification of class I integron-gene cassetteA:整合酶基因的PCR扩增(M:DL600 Marker; 1:Ⅰ类整合酶阳性株); B:可变区基因盒的PCR扩增(M:DL2 000 Marker; 1~9:Ⅰ类整合酶阳性菌株可变区)A:PCR amplification of integrase gene(M:DL600 Marker; 1:intI1-positive isolates); B:PCR amplification of gene cassette in variable region(M:DL2 000 Marker; 1-9:Variable region of intI1-positive isolates)
对19株Ⅰ类整合子阳性菌株进行可变区PCR扩增,共有9株分离菌扩增出可变区片段(图3B),将PCR产物测序后比对分析,结果显示,共有3种不同的基因盒排列,其中有5株分离菌基因盒结构为dfrA17-aadA5,有3株分离菌为单基因基因盒(dfrA7),有1株分离菌同时含有2种基因盒(dfrA1-aadA1和dfrA7);对3′保守区域序列分析,显示9株分离菌均为典型结构qacEΔ1+sul1。
2.5 分离株耐药基因与耐药表型的相关性分析 计算耐药基因与耐药表型的符合率,结果显示,7个耐药基因(β-内酰胺类:blaTEM、blaCTX-M-1;磺胺类:sul1、sul2;四环素类:tetA、tetB;氯霉素类:cat)与耐药表型符合率为100%,耐药基因FloR和strA与耐药表型符合率分别为77.78%和50.00%,而喹诺酮类耐药基因(GyrA、GyrB、ParC)与耐药表型符合率都较低,分别为15.00%、14.28%、11.76%。
2.6 分离株多重耐药表型与整合子-基因盒的相关性分析 采用Fisher确切概率法对24株大肠杆菌按多重耐药菌株数与整合子阳性菌株数进行检验,结果如表3所示,整合子阳性菌株的多重耐药发生率极显著高于整合子阴性菌株(P<0.01)。

表3 Ⅰ类整合子和大肠杆菌多重耐药性相关性分析Table 3 Correlation of class I integrons and multi-drug resistance in E.coli
分离株携带5种不同的基因盒,赋予了对氨基糖苷类(aadA1、aadA5)和甲氧苄啶(dfrA1、dfrA7、dfrA17)的耐药性,分析分离株的基因盒排列类型与对应的耐药表型,发现携带相同基因盒排列的菌株在耐药表型组合上有较大差异;但基因盒阳性菌株表型上对氨基糖苷类和磺胺类的某种药物耐药时,菌株一定携带着与表型相对应的基因盒。
3 讨论
细菌耐药性已成为世界突出的公共卫生问题,尤其养殖业中存在不合理使用抗生素,甚至将其作为促生长剂使用的现象,大大加快了耐药性的出现,目前很多研究已证实大肠杆菌耐药性正逐年升高[7]。本研究检测分离的24株大肠杆菌对临床常用的6大类15种抗菌药的敏感性,发现分离株耐药情况严重,对氨苄西林、头孢噻肟等β-内酰胺类抗菌药耐药率在95%以上,对复方新诺明和四环素的耐药率也在70%以上,可能与养殖场频繁使用此类药物治疗各种细菌病有关。值得注意的是,同属氨基糖苷类的庆大霉素(62.50%)和阿米卡星(16.67%)耐药率相差近4倍,这可能与养殖场长期使用单一抗菌药有关。大肠杆菌分离株的多重耐药情况也很严重,多重耐药菌株占比70.83%,其中3株分离菌对14种药物都表现为耐药。高海慧等[8]分离的牛源大肠杆菌对氨苄西林、头孢唑林和四环素耐药率超过90%,对环丙沙星和诺氟沙星的耐药率超过60%,多重耐药菌株占比达85.33%;刘勃兴等[9]分离的牛源大肠杆菌对磺胺类抗菌药高度耐药,对β-内酰胺类和喹诺酮类抗菌药的耐药率在30%以下,对10种及以上抗菌药耐药的菌株占比34%。与本研究结果相比,发现各地区大肠杆菌多重耐药问题均很严重,但不同地区大肠杆菌对各类抗菌药物的敏感性有较大差异。
本研究检测分离株对6大类抗菌药所对应的各类耐药基因的携带情况,发现除tetM和cmlA耐药基因外,其余耐药基因均可检出,喹诺酮类耐药基因检出率最高,β-内酰胺类次之,氯霉素类最低。耐药基因GyrB检出率达100%,是喹诺酮类耐药基因中最流行的基因型,磺胺类耐药基因sul1、sul2检出率超过62%,与吴同垒等[10]分离的牛源大肠杆菌中耐药基因GyrB(100%)、sul1(66.7%)的检出率非常接近。耐药基因blaTEM检出率为79.17%,与吴少鹏等[11]在牛粪中分离的大肠杆菌耐药基因blaTEM(59.1%)检出结果相似,均为β-内酰胺类耐药基因中占优势的基因型。氯霉素类耐药基因FloR的检出率为37.5%,是白慧丽等[12]分离的大肠杆菌中耐药基因FloR(76.92%)检出率的1/2,可能与后者所采样的养牛场长期使用氟苯尼考有关。进一步分析耐药基因与耐药表型的相关性,发现β-内酰胺类、磺胺类和四环素类耐药基因与耐药表型的符合率都为100%,而喹诺酮类耐药基因与耐药表型的符合率最高为15%,表明除喹诺酮类耐药基因外,通过对分离株耐药基因的检测可在一定程度上预测菌株的耐药表型,目前药敏试验是检测细菌耐药表型的有效手段,但检测耐药基因对研究分离菌株的潜在耐药性意义重大。
整合子对细菌耐药的产生有着不可忽视的作用,近年来对整合子的研究越来越多,其中对Ⅰ类整合子的研究最多,Ⅱ、Ⅲ类较少。本研究检测分离株中三类整合子的携带情况,发现79.17%大肠杆菌携带Ⅰ类整合子,没有检出Ⅱ、Ⅲ类整合子。与Yang等[13]分离的牦牛源大肠杆菌中Ⅰ、Ⅱ类整合子检出率(66%、6%)及陈朝喜等[14]分离的大肠杆菌中Ⅰ、Ⅱ类整合子检出率(30.50%、18.13%)相比,发现本研究中大肠杆菌Ⅰ类整合子携带率更高,同时说明Ⅰ类整合子相比于Ⅱ类整合子更流行。测序分析携带Ⅰ类整合子的19株分离菌的可变区,发现有9株分离菌携带耐药基因盒,有3种不同的基因盒排列类型,其中基因盒排列dfrA17-aadA5最为流行,这与李晓娜等[15]和苑晓萌等[16]对大肠杆菌Ⅰ类整合子结构的研究结果相同。对分离株携带的Ⅰ类整合子和多重耐药表型进行分析,发现整合子阳性株的多重耐药发生率较整合子阴性株更高,与李晓娜等[15]和王海生等[17]的研究结果一致,提示Ⅰ类整合子的存在增强了大肠杆菌的多重耐药性。
本研究为晋北地区养牛场治疗大肠杆菌感染提供了用药参考,为进一步研究牛源大肠杆菌耐药性水平传播机制提供了科学依据。
