伪狂犬病病毒TaqMan双重实时荧光定量PCR检测方法的建立与初步应用
2022-08-06吕玉金张世军吴凤笋赵攀登刘玲玲李文刚
吕玉金 , 张世军 , 吴凤笋 , 赵攀登 , 刘玲玲 , 李文刚 , 饶 宝
(1.河南牧业经济学院动物医药学院 , 河南 郑州 450046 ; 2.河南农业大学动物医学院 , 河南 郑州 450002 ;3.牧原食品股份有限公司 , 河南 南阳 473000)
伪狂犬病病毒(Pseudorabies virus,PRV)属于疱疹病毒科α疱疹病毒亚科,在自然界中广泛存在,是引起猪伪狂犬病(Pseudorabies,PR)的病原体。PRV唯一的自然宿主是猪,仔猪感染后表现为中枢神经系统紊乱,死亡率可达100%;成年猪感染后通常表现为呼吸道症状和增重减缓,急性感染耐过的猪则终身隐性带毒;怀孕母猪感染后常发生繁殖障碍[1-2]。20世纪80年代以来,Bartha-K61等疫苗的使用对PRV的传播和危害起到了有效的控制作用。但2011年后,由于PRV发生变异导致病毒的毒力增强,猪伪狂犬病再次暴发,由华中地区陆续流行到华南、华北及西南等地区的已经免疫过弱毒疫苗的猪场,且Bartha-K61等传统弱毒疫苗不能对目前PRV流行毒株提供有效的免疫保护[3-6]。近年来,国内外多次出现PRV感染人的报道,加速了PRV根除净化警报[7-9]。因此,快速、准确的诊断方法对该病的防控具有重要意义。
本试验基于国内PRV野毒株基因序列,根据PRVgB和gE基因保守区域,设计特异性引物和探针,建立可用于临床样本中PRV野毒株和疫苗株检测的TaqMan双重实时荧光定量PCR方法,旨在为PRV的检测和防控提供有效的保障。
1 材料与方法
1.1 病毒株及临床样品 病料组织于2020年6月采集自河南省新乡市某一猪场;PRV Bartha-K61疫苗株,购自武汉科前生物有限公司;PRV阳性对照毒株HNJY株、猪肾细胞(PK-15)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪圆环病毒2型(PCV2)和猪乙型脑炎病毒(JEV),均由河南牧业经济学院中心实验室保存。
1.2 主要试剂与仪器 pMD18-T Vector、ExTaq酶和PremixExTaqTM(Probe qPCR),均购自宝生物工程(大连)有限公司;Ezup柱式病毒DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒和SanPrep柱式质粒DNA小量抽提试剂盒,均购自生工生物工程(上海)股份有限公司。ABI-7500 Fast荧光定量PCR仪,购自赛默飞世尔科技(中国)有限公司。
1.3 引物和探针设计 利用DNASTAR(Version 5.0)软件对GenBank 中2012年以来公布的PRV流行毒株gE和gB基因序列进行同源性对比分析(图1和图2),选择各自保守区域设计2对特异性引物和探针,并将探针标记上不同的发光基团,使其能够区分野毒株和疫苗株,引物和探针序列见表1。

图1 PRV-gE引物和探针设计Fig.1 Design of PRV-gE primers and probe

图2 PRV-gB引物和探针设计Fig.2 Design of PRV-gB primers and probe
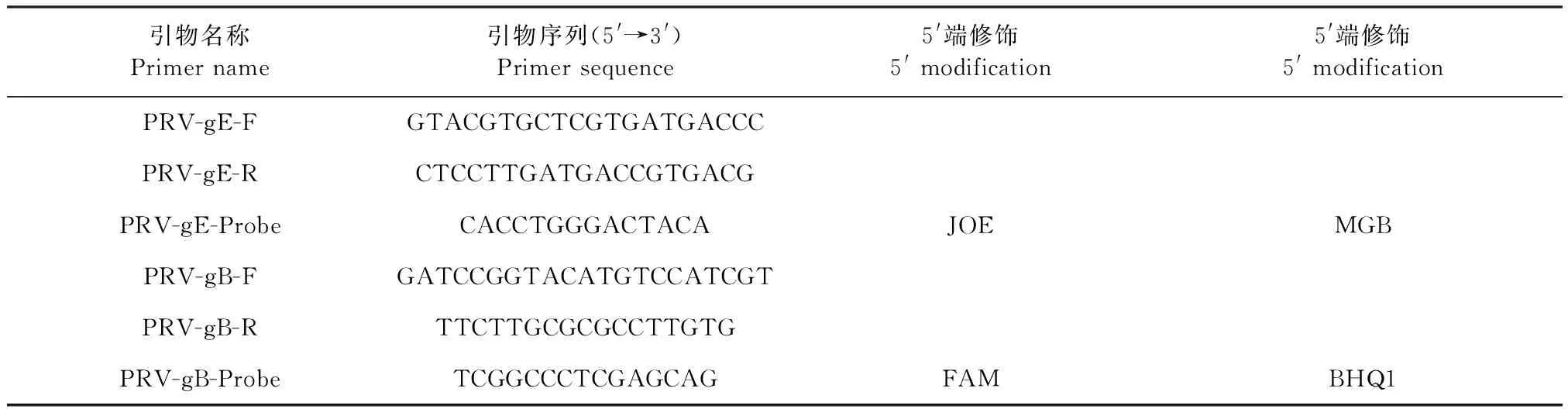
表1 荧光定量PCR引物和探针Table 1 Primers and probe of fluorescence quantitative PCR
1.4 重组质粒标准品的制备 以本实验室保存的PRV病毒的基因组为模板,进行PCR扩增,获得目的片段。将PCR目的片段胶回收纯化克隆至pMD18-T Vector中,并将重组载体转化至DH5α感受态细胞,经菌液鉴定和一代测序,筛选阳性克隆,扩大培养后提取质粒,得到pMD-gB和pMD-gE重组质粒。使用紫外分光光度计测定重组质粒的浓度,根据公式(1)换算出拷贝数[10]。
拷贝数(copies/μL)=[6.02×1023×质粒浓度(ng/μL)×10-9]÷[660×(pMD18-T)载体碱基数+目的片段碱基数]
(1)
1.5 双重实时荧光定量PCR反应条件的优化 采用20 μL反应体系:PremixExTaq(Probe qPCR)(2×Conc) 10 μL,ROX Reference Dye Ⅱ(50×Conc) 0.4 μL,DNA模板2 μL,TaqMan探针(10 μmol/L)和上下游引物(10 μmol/L)的终浓度在0.1~0.8 μmol/L调整,用超纯水补齐至20 μL。然后对双重实时荧光定量PCR各循环参数和引物浓度等进行优化,以确定最佳的双重实时荧光定量PCR反应体系。
1.6 双重实时荧光定量PCR标准曲线的绘制 取PRV-gE、PRV-gB重组标准质粒混匀,进行10倍倍比梯度稀释,以各个梯度重组标准质粒作为标准模板,用优化后的PCR反应最适条件进行扩增,每个数量级重复3次,得出结果进行分析,以对应标准质粒的拷贝数为横轴,Ct值为纵轴建立标准曲线[11]。
1.7 特异性试验 利用本试验建立的TaqMan双重实时荧光定量PCR方法分别对PRV-gE重组标准质粒、PRV-gB重组标准质粒、PRV野毒株、PRV Bartha-K61疫苗株、CSFV、PRRSV、PPV、PCV2和JEV进行检测,分析该方法的特异性。
1.8 敏感性试验 取浓度数量级为100~107copies/μL的重组标准质粒作为DNA模板进行实时荧光定量PCR,每个稀释度做3个重复,以确定该方法的最低检测限度。随后利用普通PCR方法进行扩增[12],分析检测结果得出最低检测浓度,并与本试验建立的TaqMan双重实时荧光定量PCR方法进行灵敏性对比。
1.9 重复性试验 取浓度数量级为104~106copies/μL 共3个稀释度DNA为模板,分别进行3次重复扩增,进行组内和组间重复性试验。根据所得结果的Ct值,计算Ct值的平均数(MN)和标准差(SD)[13],最后根据公式(2)计算变异系数(CV)[14]来验证实时荧光定量PCR的批内重复性。
CV=(SD÷MN)×100%
(2)
1.10 干扰性试验 将PRV-gB和PRV-gE重组质粒标准品按不同的拷贝数进行组合,分别用双重实时荧光定量PCR和单项荧光PCR进行检测,确定模板浓度相差较大时二者的检测是否存在干扰。
1.11 临床样品检测 按照生工生物工程(上海)股份有限公司DNA抽提试剂盒说明书对实验室保存的18份猪临床病料进行基因组提取,采用所建立的PRVgE和gB基因TaqMan双重实时荧光定量PCR方法对病料进行检测。随后利用普通PCR方法进行扩增[12],分析检测结果,并与本试验建立的TaqMan双重实时荧光定量PCR方法结果进行对比。
2 结果
2.1 重组质粒标准品的制备 对PRVgB和gE基因进行PCR扩增,经1%琼脂糖凝胶回收后与pMD18-T Vector连接,提取质粒进行双酶切鉴定,PRVgE基因的重组质粒显示2 061 bp和2 877 bp 2个条带,PRVgB的重组质粒显示2 640 bp和2 877 bp 2个条带,与预期大小一致(图3)。对阳性质粒进行浓度测定,PRV-gB和PRV-gE重组质粒的浓度分别为164.0 ng/μL和141.5 ng/μL,使用公式(1)计算其拷贝数分别为2.74×1010copies/μL和2.71×1010copies/μL。

图3 PRV-gE和PRV-gB重组质粒的双酶切鉴定Fig.3 Double digestion identification of PRV-gE and PRV-gB recombinant plasmidsM:DL5 000 Marker; 1:PRV-gB双酶切产物; 2:PRV-gE双酶切产物M:DL5 000 Marker; 1:PRV-gB double enzymes digestion products;2:PRV-gE double enzymes digestion products
2.2 双重实时荧光定量PCR标准曲线的绘制 经过对TaqMan双重实时荧光定量PCR反应条件的优化,确定该反应体系PRV-gB-F、PRV-gB-R、PRV-gE-F和PRV-gE-R引物的最佳工作终浓度为0.2 μmol/L,PRV-gB-P和PRV-gE-P探针的最佳工作终浓度分别为0.3 μmol/L和0.2 μmol/L;PCR的最佳反应条件:94 ℃ 3 min,94 ℃ 10 s,60 ℃ 45 s,40个循环;最后于4 ℃结束反应。在最佳的反应体系和反应条件下,对浓度数量级为102~108copies/μL的gE、gB基因的标准阳性质粒模板进行检测,建立双重实时荧光定量PCR标准曲线。结果如图4所示,gE、gB基因线性方程分别为:gE:y=-3.154x+46.08;gB:y=-3.120 8x+45.235,相关系数分别为0.997 9和0.990 6,扩增效率分别为99.626%和99.779%。
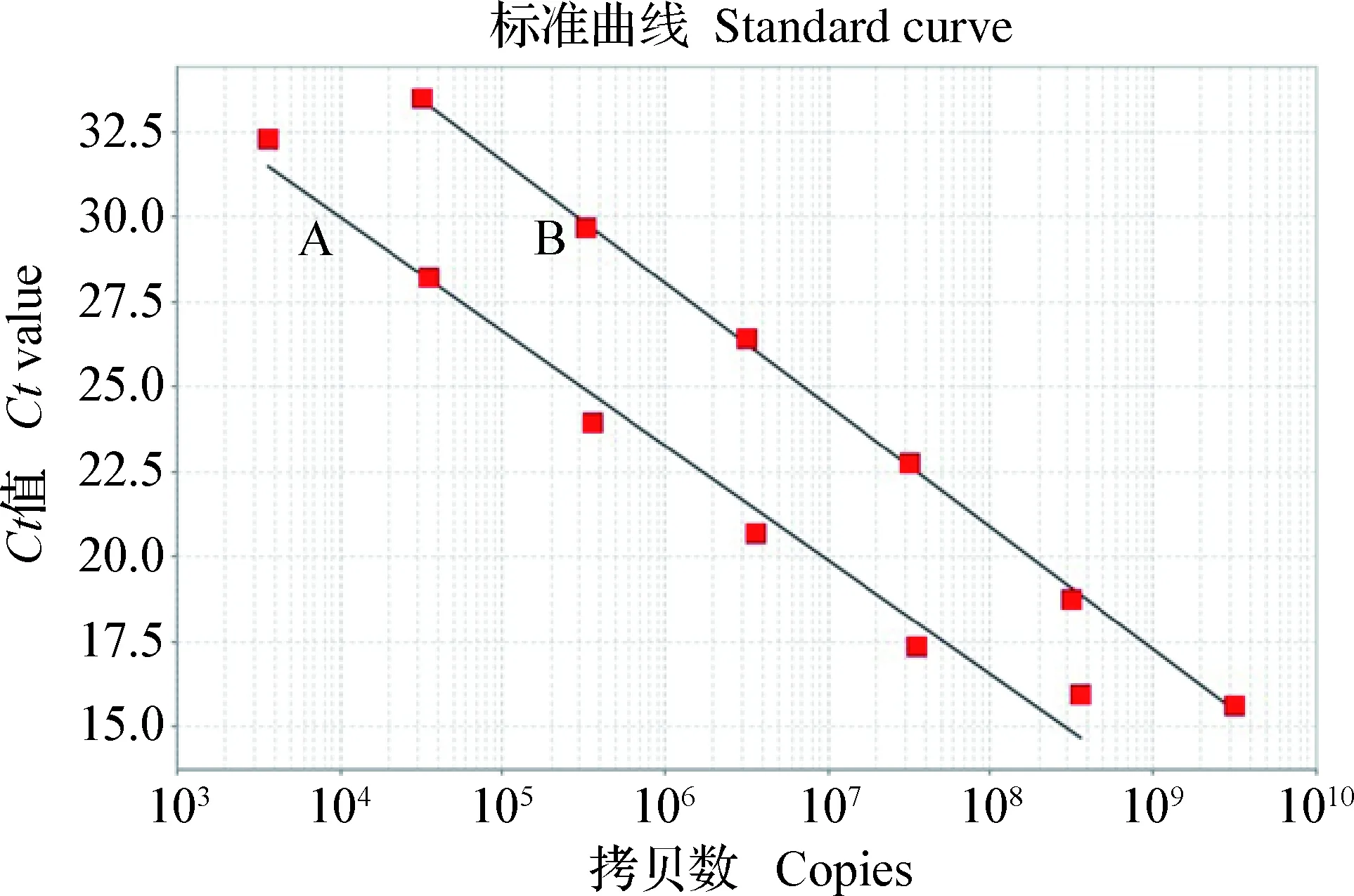
图4 TaqMan双重实时荧光定量PCR的标准曲线Fig.4 Standard curve of TaqMan duplex real-time fluorescence quantitative PCRA:PRV gE基因TaqMan双重实时荧光定量PCR的标准曲线;B:PRV gB基因TaqMan双重实时荧光定量PCR的标准曲线A:Standard curve of PRV gE gene TaqMan duplex real-time fluorescence quantitative PCR;B:Standard curve of PRV gB gene TaqMan duplex real-time fluorescence quantitative PCR
2.3 特异性试验 分别采用所建立的PRVgE和gB基因TaqMan双重实时荧光定量PCR方法对样品进行检测。结果如图5所示,PRV野毒株、PRV-gB重组标准质粒和PRV Bartha-K61疫苗株在FAM荧光通道(530 nm激发光下)出现S型扩增曲线,PRV野毒株、PRV-gE重组标准质粒在JOE荧光通道(478 nm激发光下)出现S型扩增曲线,其他则在FAM和JOE荧光通道为直线,与试验设计相符。

图5 TaqMan双重实时荧光定量PCR的特异性Fig.5 Specificity of TaqMan duplex real-time fluorescence quantitative PCRA:PRV gB基因TaqMan双重实时荧光定量PCR特异性试验结果(1:PRV-gB重组标准质粒; 2:PRV野毒株; 3:PRV Bartha-K61疫苗株;4~9:PRV-gE重组标准质粒、CSFV、PRRSV、PPV、PCV2和JEV); B:PRV gE基因TaqMan双重实时荧光定量PCR特异性试验结果(1:PRV-gE重组标准质粒; 2:PRV野毒株; 3~9:PRV-gB重组标准质粒、PRV Bartha-K61疫苗株、CSFV、PRRSV、PPV、PCV2和JEV)A:PRV gB gene TaqMan duplex real-time fluorescence quantitative PCR specificity test results(1:PRV-gB recombinant standard plasmid; 2:PRV wild strain;3:PRV Bartha-K61 vaccine strain; 4-9:PRV-gE recombinant standard plasmid,CSFV,PRRSV,PPV,PCV2 and JEV)B:PRV gE gene TaqMan duplex real-time fluorescence quantitative PCR specificity test results(1:PRV-gE recombinant standard plasmid; 2:PRV wild strain;3-9: PRV-gB recombinant standard plasmid,PRV Bartha-K61 vaccine strain,CSFV,PRRSV,PPV,PCV2 and JEV)
2.4 敏感性试验 采用所建立的PRVgE和gB基因TaqMan双重实时荧光定量PCR方法对PRVgE和gB基因的2种重组标准质粒的混合品进行灵敏度检测,结果显示,建立的方法对PRVgB基因重组标准质粒的模板最低检测量为2.74 copies/μL(图6A),建立的方法对PRVgE基因重组标准质粒的模板最低检测量为27.1 copies/μL(图6B)。
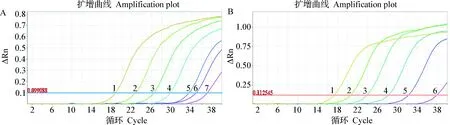
图6 TaqMan双重实时荧光定量PCR的敏感性Fig.6 Sensitivity of TaqMan duplex real-time fluorescence quantitative PCRA:PRV gB基因TaqMan双重实时荧光定量PCR敏感性试验结果(1~7:PRV gB基因的重组质粒的浓度分别为2.74~2.74×106 copies/μL);B:PRV gE基因TaqMan双重实时荧光定量PCR敏感性试验结果(1~6:PRV gE基因的重组质粒的浓度分别为27.1~2.71×106 copies/μL)A:PRV gB gene TaqMan duplex real-time fluorescence quantitative PCR sensitivity test results(1-7: PRV gB gene recombinant plasmids at 2.74-2.74×106 copies/μL);B:PRV gE gene TaqMan duplex real-time fluorescence quantitative PCR sensitivity test results(1-6: PRV gE gene recombinant plasmids at 27.1-2.71×106 copies/μL)
2.5 重复性试验 根据所得结果的Ct值,计算Ct值的MN、SD和CV,如表2所示,两组数据的变异系数均小于1%,结果表明本方法具有良好的重复性。
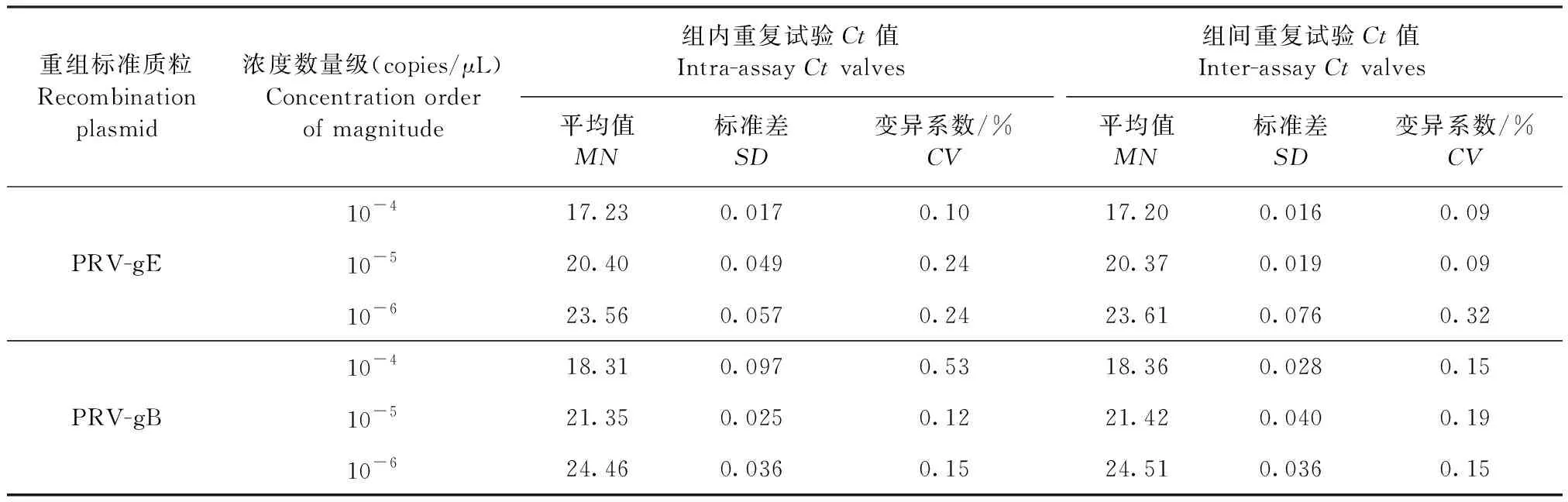
表2 重复性试验结果Table 2 Results of repeatability test
2.6 干扰性试验 将PRV gE和gB重组标准质粒标准品模板按不同浓度进行组合时发现,当一个模板浓度高而另一个模板浓度低时,仍可在不同的荧光通道下分别检测到2个模板,并与单一荧光PCR检测结果无显著差异(图7)。
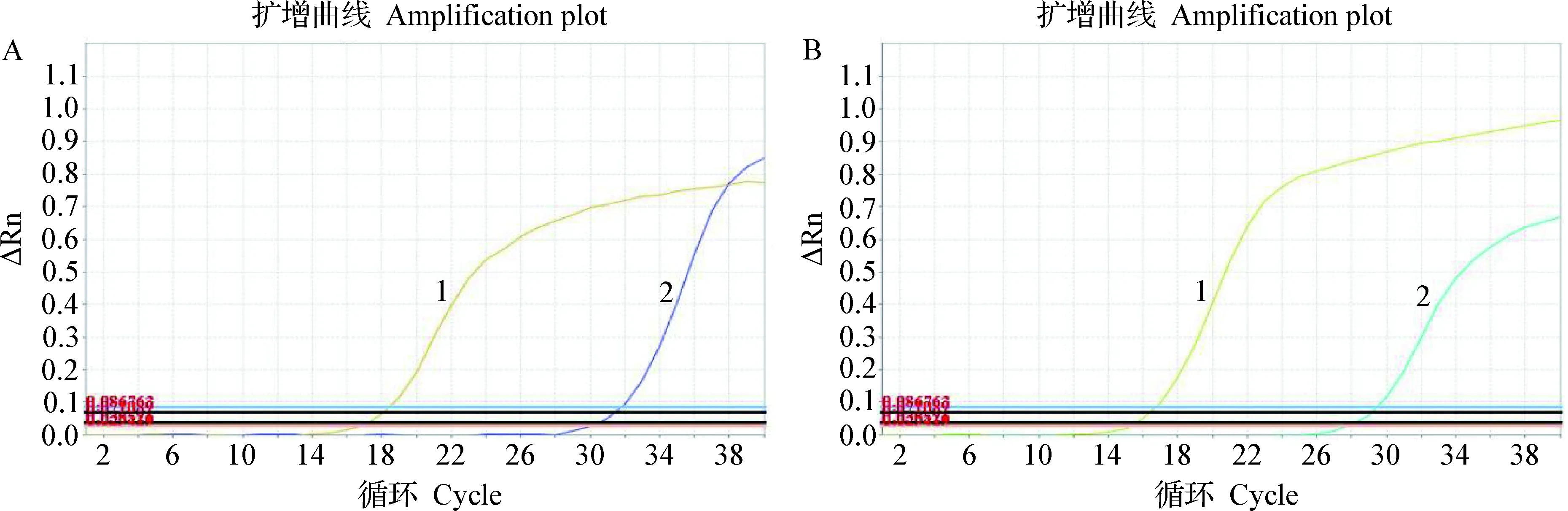
图7 TaqMan双重实时荧光定量PCR的干扰性Fig.7 Robustness of TaqMan duplex real-time fluorescence quantitative PCRA:1:PRV gE重组标准质粒标准品模板浓度为2.71×108 copies/μL; 2:PRV gB重组标准质粒标准品模板浓度为2.74×103 copies/μL;B:1:PRV gE重组标准质粒标准品模板浓度为2.71×103 copies/μL; 2:PRV gB重组标准质粒标准品模板浓度为2.74×108 copies/μLA:1:PRV gE recombinant standard plasmid standard template concentration is 2.71×108 copies/μL; 2:PRV gB recombinant standard plasmid standard template concentration is 2.74×103 copies/μL; B:1:PRV gE recombinant standard plasmid standard template concentration is 2.71×103 copies/μL; 2:PRV gB recombinant standard plasmid standard template concentration is 2.74×108 copies/μL
2.7 临床样品检测 通过本试验建立的方法对保存的18份样品进行检测分析,结果如表3所示,18份病料中共检出gB基因阳性病料10份,阳性率为55.6%;检出gE基因阳性病料7份,阳性率为38.9%;混合感染病料为5份,占比27.8%,且该检测结果与普通PCR方法鉴定结果符合率达100%。说明本试验建立的TaqMan双重实时荧光定量PCR的检测方法较适用于临床样品的检测。

表3 临床样品检测结果Table 3 Results of clinical sample
3 讨论
近年来,在我国许多地区都报告了PR的暴发,目前所使用的Bartha-K61疫苗不能为新型的PRV变异毒株提供足够的保护。考虑到国内进行大规模疫苗接种,猪群中可同时存在PRV野毒株和疫苗株。在猪伪狂犬病净化过程中,开发区分不同PRV毒株的检测方法是必要的,且需求日益增加[15]。
随着研究的不断深入,现已经开发出很多可对PRV毒株进行鉴定的方法。谢思豪等[16]建立了PRV野毒株新型可视化LAMP检测方法,其结果直观且极易分辨,最低的检测限度可达100.5TCID50,虽然该方法灵敏度高,但是结果易出现假阳性。张悦勇等[17]建立了猪伪狂犬病病毒纳米PCR检测方法,该方法操作简单,敏感度高,最低的检出限为10 copies/μL,但是该方法不能对疫苗株和野毒株同时进行检测,也不能够实现对病原定量检测,且纳米材料不易获得。兰德松等[18]以PRVgB和gE基因为靶基因,建立PRV野毒株和gE基因缺失疫苗株的鉴别诊断和准确定量的微滴式数字PCR方法,最低的检测限度为2.3 copies/μL,但该方法操作复杂,对检测人员要求高,不适合基层检测。吴凤笋等[12]构建了猪伪狂犬病病毒检测基因芯片,该方法特异性强,灵敏度高,检测的最低量可达1×10-6ng级,但由于该方法操作过程繁琐且价格昂贵,限制了其推广。此外,临床上也使用ELISA方法通过对猪体内gE抗体水平进行检测,从而区分疫苗株和野毒株,但是抗体的产生具有滞后性,在免疫细胞呈递抗原的这段时间抗体检测几乎没有作用,对病毒的早期检测不如实时荧光定量PCR及时。通过与以上研究对比分析发现,荧光实时定量PCR相对于其他的检测方法来说,操作简单、特异性强、灵敏性好、价格便宜、时效性早,更加适用于临床检测。
综上所述,本试验建立的TaqMan双重实时荧光定量PCR检测方法,可同时检测PRV野毒株和疫苗株,尤其是对PRV早期检测更有效果,这将对临床上PR的诊断与防控提供一种更加有效的解决方案。
