原花青素联合胡椒碱通过五羟色胺受体途径改善慢性应激小鼠抑郁焦虑样行为
2022-07-12李茹于雯飘郭卫楼永良
李茹,于雯飘,郭卫,楼永良
温州医科大学,浙江 温州 325035,1.实验动物中心;2.第一临床医学院(信息与工程学院);3.眼视光学和视觉科学国家重点实验室;4.检验医学院(生命科学学院)
根据世界卫生组织2017年发布的《抑郁症和其他常见精神障碍》报告,全球范围内约有3亿人罹患抑郁症;从2015年开始,抑郁症已成为造成非致命性健康损失的最大单一因素。慢性不可预知应激(chronic unpredictable mild stress,CUMS)是建立抑郁模型的经典方法[1],其原理是将小鼠饲养在未知的温和应激环境中,引起其绝望无助、快感消失等抑郁情绪,诱发动物表现出与抑郁伴焦虑症患者相似的行为,从而研究抑郁伴焦虑发生的相关机制。
原花青素(proanthocyanidins,OPC)广泛存在于自然界中,是由三种不同的黄烷-3-醇亚基组成,常被人所知的是单体或儿茶素。近几年科学家发现OPC具有保护人体健康的功效,特别在抗氧化、心脏保护的抗炎以及抗癌能力等方面的作用[2]。另有研究发现,OPC具有抗抑郁作用,然其在中剂量(40 mg/kg)和高剂量(60 mg/kg)之间的治疗效果没有明显差异。我们加入可以提高多酚类药物生物利用度的胡椒碱(piperine,PIP)来解决OPC生物利用度低的问题[3]。研究表明PIP能增强多酚类化合物如姜黄素、漆黄素、白藜芦醇的抗抑郁样作用[3-4]。胡慧等[5]指出OPC联合PIP可改善CUMS抑郁样行为,该作用可能是通过降低脑内单胺氧化酶活性从而增加单胺类神经递质含量而实现的。5-羟色胺(5-hydroxytryptophan,5-HT)是与心境障碍有关的神经递质,通过作用于特异的5-HT受体实现多样的生物学作用。5-HT受体分为7大类(5-HT1-7受体),共有14种亚型[6],其中5-HT1A受体与抑郁、焦虑密切相关。本研究将进一步从5-HT1A受体来探讨OPC联合PIP的抗抑郁样作用机制。
1 材料和方法
1.1 实验动物 雄性ICR小鼠,体质量为(20±2)g,由上海斯莱克实验动物有限责任公司提供,饲养于温州医科大学实验动物中心[许可证号为SCXK(沪)2017-0005]。小鼠自由进水、摄食,保持实验饲养的环境湿度为40%~50%,温度为(24±1)℃。
1.2 药品试剂 OPC(批号:ZL2018061503)购自天津尖峰天然产物研究开发有限公司,NAN-190、氟西汀(货号:78917)、多巴胺(dopamine,DA,批号:BCBV2562)、去甲肾上腺素(norepinephrine,NE,批号:SLBP9361V)、5-HT(批号:091M5163V)均购自美国Sigma公司。OPC和PIP都使用0.5%羧甲基纤维素钠溶解,溶解后采用小鼠灌胃给药,氟西汀使用双蒸水溶解,然后采用小鼠腹腔注射给药。
1.3 实验仪器 XW-80A型漩涡混合器(海门其林贝尔仪器制造有限公司),JY92-2D型超声波细胞粉碎机(宁波新芝生物科技股份有限公司),Eppendorf 5417R型高速冷冻离心机(德国Eppendorf公司),ANTEC电化学检测器(荷兰安泰克公司),Agilent 1100高效液相仪(美国Agilent公司),色谱柱为Diamonsilim C18(150 mm×4.6 mm,5 μm)。
1.4 动物分组造模及给药 小鼠按照随机数字表法分组(每组8只小鼠):正常组、CUMS组、OPC(12.5、25、50 mg/kg,ig)剂量组联用PIP(5 mg/kg,ig)、OPC(50 mg/kg,ig)+PIP(5 mg/kg,ig)+NAN-190(0.1 mg/kg,ip)、NAN-190组(0.1 mg/kg,ip)以及氟西汀组(10 mg/kg,ip)。除正常组外,其他各组小鼠均建立慢性不可预知性应激CUMS模型:根据文献[7]稍作改善,每天随机给予夹尾1 min、潮湿垫料、倾斜笼子24 h、冷水游泳5 min、禁食24 h、束缚1.5 h、禁水24 h、高速摇晃45 min中的一项,2 d内不能重复并持续21 d。
第21天进行动物行为学实验,然后快速获取脑组织,分离小鼠大脑额叶皮层、海马和下丘脑,放置在超低温冰箱中保存备用。建模期间根据以上分组给予相应的药物持续21 d,正常组和CUMS组均给予0.5%羧甲基纤维素钠。
1.5 新奇食物抑制摄食实验[8]测试前禁食24 h,开始测试时,将小鼠单独放在一个测试箱中(长×宽×高=27 cm×16 cm×13 cm)的角落,箱子底部铺一层1 cm的木屑垫料,中间摆放4颗平时吃的食物。记录小鼠在5 min内摄食的潜伏期。小鼠在嗅食物或者搬运食物都不计入潜伏期,只有当小鼠开始啃食食物才开始记录。
1.6 强迫游泳实验[9]在一个透明的圆柱体(高25 cm,直径为10 cm)中,注入深度为19 cm的水,将水温维持在(25±1)℃。每只小鼠单独放在1个圆柱体内,实验时间为6 min。在适应期(2 min)后,记录每只小鼠剩余4 min内在水中保持不动的时间,该时间记为不动时间。
1.7 悬尾实验[9]在隔音盒(长×宽×高=40 cm×20 cm×60 cm)中进行,用胶带固定每只老鼠的尾部使其悬空,胶带距离老鼠尾部尖端1 cm。将小鼠离地20 cm,适应期2 min后进行测试,测试时间为6 min,在6 min内记录小鼠的不动时间。
1.8 大理石掩埋实验[10]在盒子(长×宽×高=35 cm×28 cm×16 cm)中铺上一层5 cm垫料,垫料上放20颗玻璃弹珠(直径为1.5 cm),记录被小鼠掩埋的弹珠数量,时间为10 min。被掩埋的玻璃弹珠颗数以玻璃弹珠被掩埋2/3或者珠子全部被掩埋为标准。
1.9 单胺类神经递质检测[11]小鼠实验完毕后断头取脑,在准备好的冰板上按照小鼠的脑图谱快速分离出额叶皮层、海马和下丘脑的脑区,快速称重后置于-80 ℃冰箱中保存。取各组小鼠的脑组织,每10 mg的脑组织加入100 μL冰的浓度为0.4 mol/L的高氯酸,超声匀浆,之后放在冰上继续裂解90 min。在4 ℃条件下(12 000 r/min)离心20 min,取上清液,加入半量体积的0.2 mol/L枸橼酸钾,0.3 mol/L K2HPO4和0.2 mol/LEDTA的混合液。混匀,在4 ℃下避光放置60 min,再次在4 ℃条件下(12 000 r/min)离心20 min,最后取其上清液测定单胺类神经递质的含量。采用高效液相电化学法测单胺类神经递质水平。样品上清液首先使用滤过膜处理(孔径为0.22 μm),取滤过液20 μL,自动进样。使用的流动相为0.1 mmol/L EDTA、125 mmol/L枸橼酸-枸橼酸钠缓冲液(pH=3.05)、1.2 mmol/L辛烷基磺酸钠和15%甲醇,色谱柱为Diamonsil C18,规格是5 μm,150 mm×4.6 mm,高效液相的流速为0.8 mL/min,脑组织中的单胺及其代谢产物的含量使用ng/g(湿组织)表示。
1.10 统计学处理方法 采用SPSS16.0统计学软件对数据进行处理,计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnettt检验。P<0.05为差异有统计学意义。
2 结果
2.1 OPC联用PIP对CUMS小鼠抑郁和焦虑样行为的影响 相比于正常组,CUMS组小鼠在强迫游泳和悬尾实验中的不动时间显著增加(P<0.01),给予OPC(25和50 mg/kg)联用PIP(5 mg/kg)可改善由CUMS引发不动时间的增加(P<0.05,P<0.01),且其效果与阳性对照药氟西汀(10 mg/kg)效果一致(P<0.05)。与CUMS组比,低剂量OPC(12.5 mg/kg)联用PIP(5 mg/kg)组小鼠的不动时间差异无统计学意义(P>0.05)。见图1A、图1B。
新奇食物抑制摄食实验结果表明,与正常组相比,CUMS组小鼠的新奇食物抑制摄食潜伏期增加(P<0.05),给予OPC(25和50 mg/kg)联用PIP(5 mg/kg)明显降低CUMS小鼠的摄食潜伏期(P<0.05,P<0.01),该效果与阳性对照药氟西汀(10 mg/kg)的效果一致(P<0.05)。与CUMS组比,低剂量OPC(12.5 mg/kg)联用PIP(5 mg/kg)组小鼠新奇食物摄食的潜伏期时间差异无统计学意义(P>0.05)。见图1C。
大理石掩埋实验结果表明,与正常组相比,CUMS小鼠的大理石掩埋颗粒数增加(P<0.01),口服OPC(25和50 mg/kg)联用PIP(5 mg/kg)浓度依赖性地降低大理石掩埋的颗粒数(P<0.05,P<0.001),该结果与阳性对照药氟西汀(10 mg/kg)的效果一致(P<0.05)。与CUMS组比,低剂量OPC(12.5 mg/kg)联用PIP(5 mg/kg)组大理石掩埋的颗粒数差异无统计学意义(P>0.05)。见图1D。
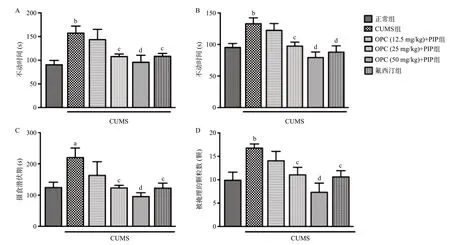
图1 各组小鼠强迫游泳实验、悬尾实验、新奇食物抑制摄食实验和大理石掩埋实验结果比较
2.2 OPC与PIP联用对CUMS小鼠脑内单胺类神经递质的影响 与正常组相比,CUMS组小鼠在海马、前额叶皮层和下丘脑中的5-HT含量均减少,差异有统计学意义(P<0.01);与正常组相比,CUMS组NE仅在海马脑区显著下降(P<0.05),前额叶皮层和下丘脑NE差异无统计学意义(P>0.05);与正常组相比,CUMS组DA在3个脑区中的含量差异无统计学意义(P>0.05)。OPC(25、50 mg/kg)联用PIP(5 mg/kg)可以逆转应激引起的各个脑区5-HT含量降低(P<0.05),其中OPC(50 mg/kg)联用PIP(5 mg/kg)减少得最明显(P<0.01),但是对NE和DA无影响(P>0.05),见表1、表2和表3。
表1 各组小鼠海马脑区中5-HT、NE和DA含量比较(每组n=8,,ng/g)
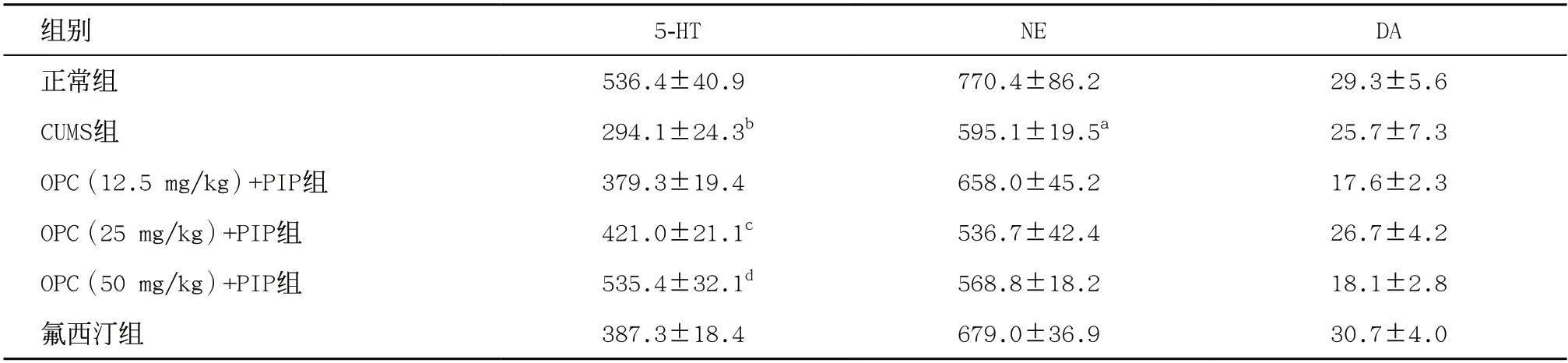
表1 各组小鼠海马脑区中5-HT、NE和DA含量比较(每组n=8,,ng/g)
与正常组比:aP<0.05,bP<0.01;与CUMS组比:cP<0.05,dP<0.01
表2 各组小鼠前额叶皮层脑区中5-HT、NE和DA含量比较(每组n=8,,ng/g)

表2 各组小鼠前额叶皮层脑区中5-HT、NE和DA含量比较(每组n=8,,ng/g)
与正常组比:aP<0.01;与CUMS组比:bP<0.05,cP<0.01
表3 各组小鼠下丘脑区中5-HT、NE和DA含量比较(每组n=8,,ng/g)

表3 各组小鼠下丘脑区中5-HT、NE和DA含量比较(每组n=8,,ng/g)
与正常组比:aP<0.01;与CUMS组比:bP<0.05,cP<0.01
2.3 OPC与PIP联用通过5-HT1A受体对CUMS小鼠新奇食物抑制摄食及大理石掩埋实验的影响 如前所述,OPC(25和50 mg/kg)联用PIP(5 mg/kg)组可改善由CUMS诱发的小鼠抑郁焦虑样行为,且可逆转多个脑区内5-HT含量的降低,我们推测这种作用是通过作用于5-HT1A受体而实现的。因此,我们研究5-HT1A受体拮抗剂NAN-190是否可逆转OPC联用PIP的效果。结果表明,腹腔注射NAN-190(0.1 mg/kg)可逆转OPC(50 mg/kg)联用PIP(5 mg/kg)降低新奇食物抑制摄食的潜伏期及减少大理石掩埋颗粒的效果(P<0.05),见图2。

图2 各组新奇食物抑制摄食潜伏期和大理石掩埋颗粒数
2.4 OPC与PIP联用通过5-HT1A受体作用对海马、额叶和下丘脑中5-HT含量的影响 与正常组相比,CUMS组小鼠在海马、额叶和下丘脑中的5-HT含量均减少,差异有统计学意义(P<0.01)。OPC(50 mg/kg)联用PIP(5 mg/kg)可以逆转应激引起的各个脑区的5-HT含量降低,且差异有统计学意义(P<0.01),使用NAN-190(0.1 mg/kg)能逆转OPC(50 mg/kg)联用PIP(5 mg/kg)脑区中5-HT含量的下降,在海马和额叶皮层中的影响较显著(P<0.01),见表4。
表4 各组小鼠不同部位5-HT含量比较(每组n=8,,ng/g)

表4 各组小鼠不同部位5-HT含量比较(每组n=8,,ng/g)
与正常组比:aP<0.01;与CUMS组比:bP<0.01;与OPC(50 mg/kg)+PIP组比:cP<0.01
3 讨论
随着经济的高速发展和社会节奏的加快,越来越多的人陷入抑郁和焦虑的泥潭中深受折磨。本研究在传统的OPC单一治疗抑郁焦虑疾病的给药方式中,提出OPC联合PIP的给药方式,在降低药物治疗剂量的基础上还加强了治疗效果。通过实验结果可知,CUMS小鼠在第21天后出现抑郁和焦虑样行为,在强迫游泳、悬尾实验中的不动时间和新奇食物抑制摄食实验中的摄食潜伏期都显著提高,由此可知应激后的小鼠求生欲降低、食欲变差、兴趣丧失,进入抑郁、恐惧状态;在大理石掩埋实验中被掩埋的玻璃弹珠颗粒数增加,说明应激后的小鼠挖掘、挖洞和埋葬行为增加,进入焦虑、强迫和重复状态。OPC联合PIP可以逆转应激引起的行为学改变。在确认造模的稳定性后,后续我们在抑郁症的3个行为学中选取了一种比较新颖的行为学即新奇食物抑制摄食实验来验证拮抗剂对药物的翻转作用。进一步研究发现,5-HT1A受体拮抗剂NAN-190能逆转OPC联合PIP对行为学的改善作用,表明OPC联合PIP对CUMS小鼠的改善作用可能是通过5-HT1A受体相关的信号通路而实现的。
抑郁和焦虑障碍已成为严重的公共健康问题,但是其发病机制至今不明。目前,多数抗抑郁药物是通过增加脑内单胺类神经递质浓度(5-HT、NE和DA)来改善患者的抑郁症状。单胺类神经递质系统调控抑郁涉及多个脑区,其中海马参与学习和记忆,额叶皮层参与情绪认知、感觉认知和执行功能[12],下丘脑接受5-HT、NE能和DA能三系统共同的神经支配。这三者的相互作用可共同协调情绪认知和学习记忆等活动,其异常和临床上抑郁症或者焦虑症密切相关[13]。在单胺类神经递质研究中发现,CUMS小鼠海马、额叶皮层中的5-HT和NE含量显著性下降,而DA水平无明显变化。OPC(25、50 mg/kg)联合PIP(5 mg/kg)能逆转各脑区由应激引起的5-HT水平显著降低的情况,而对海马脑内NE含量下降的情况无作用。因此可知,OPC联合PIP的作用是通过增加脑内的5-HT来改善抑郁伴焦虑样变化,这与胡慧等[5]的研究结果相似。前期研究表明OPC联合PIP的抗抑郁效果可能是通过抑制MAO-A活性来提高中枢神经系统中的单胺类神经递质,并且效果优于OPC单独用药[5]。由应激引起的抑郁症与NE相关,且该递质在HPA轴中扮演着重要的角色[1],该现象与慢性应激小鼠海马脑内NE含量显著下降相一致。然而OPC联合PIP给药对该递质无调节作用,说明OPC联合PIP没有通过此机制达到改善抑郁焦虑症作用。
目前,研究者已经发现脑区中有14种5-HT受体亚型,包括天然受体(5-HT1A、5-HT1B、5-HT1D、5-HT2A、5-HT2B、5-HT2C、5-HT3、5-HT4)和6种重组受体(5-HT1E、5-HT1F、5-HT5A、5-HT5B、5-HT6、5-HT7)[14]。其中5-HT1A受体与调节情绪密切相关,在哺乳动物中,5-HT1A受体分为自身受体和异身受体,其中自身受体位于5-HT神经元中介导负反馈,其主要分布在海马、额叶皮层、杏仁核、下丘脑等[15-16]。多项研究表明5-HT再摄取抑制剂类药物的抗抑郁的作用机制是通过海马齿状回成熟颗粒细胞中的5-HT1A受体来促进海马神经元再生,原位杂交研究表明在小鼠齿状回成熟颗粒细胞中有丰富的5-HT1AmRNA表达[17-18]。研究表明抑郁患者的脑区中5-HT递质减少,5-HT1A受体含量反而增加,因此使用5-HT重摄抑制剂(氟西汀)等改善抑郁的起效比较慢[19]。YU等[20-21]发现5-HT1A受体拮抗剂NAN-190能逆转多酚类化合物OPC和反式白藜芦醇改善慢急性应激引起的行为学变化,如强迫游泳实验和大理石掩埋实验。此外,有学者研究发现齐墩果酸具有抗抑郁样和抗焦虑样行为的作用,但是其被5-HT1A受体拮抗剂逆转[22]。本研究为了更进一步验证OPC联合PIP的抗抑郁焦虑样行为学是与5-HT和其受体相关,因此首次采用OPC(50 mg/kg)联合PIP(5 mg/kg)和5-HT1A受体拮抗剂NAN-190来观察其对行为学的作用以及5-HT含量的变化,结果表明NAN-190可以逆转OPC(50 mg/kg)联合PIP(5 mg/kg)联用引起的新奇食物抑制摄食时间减少和大理石掩埋颗粒数的减少,其中在新奇食物抑制摄食实验中改善更明显。OPC(50 mg/kg)联合PIP(5 mg/kg)对海马、额叶皮层和下丘脑中5-HT的改善作用被NAN-190逆转。
综上所述,本研究运用CUMS制造抑郁模型,OPC和PIP联用可以减少CUMS小鼠的新奇食物抑制摄食的潜伏期和大理石掩埋的颗粒数,同时可以导致海马、额叶皮层和下丘脑单胺类神经递质含量的变化,其作用机制可能是通过激动中枢神经系统的5-HT1A受体产生抗抑郁效应。
