SMARCA5在非小细胞肺癌中的表达及作用
2022-07-12杨志强黄燕燕何慧温媛媛
杨志强,黄燕燕,何慧,温媛媛
舟山医院,浙江 舟山 316021,1.呼吸与危重症科;2.分子生物实验室;3.病理诊断中心
在世界范围内,肺癌在所有恶性肿瘤中发病率和病死率均居首位[1],组织学上大部分为非小细胞肺癌(non-small cell lung cancer,NSCLC)。尽管治疗方式多样,但预后仍较差[2]。新的分子标志物的研究对于早期发现和预后分析至关重要。
SWI/SNF是一种复合型核突变小体,以ATP依赖的方式参与基因表达的转录调控,在DNA修复与DNA复制、细胞生长和细胞分化中发挥重要作用[3-5]。SMARCA5属于SWI/SNF家族的一种蛋白,具有解旋酶和ATPase活性[6-10]。SMARCA5通过组蛋白八聚体控制DNA的敏感性,该功能有助于基因表达、DNA复制、DNA修复和染色质高阶结构的维持[6,11-18]。SMARCA5已被证明具有致癌功能,特别是已有研究报道其与肝癌、乳腺癌和胃癌细胞增殖有关[19-21]。然而,SMARCA5在NSCLC中是否表达,及其表达情况如何鲜见相关研究。本研究采用免疫组化、RT-PCR及Western blot检测SMARCA5在NSCLC的表达情况,同时采用MTT法和Transwell法检测肺癌细胞的增殖和侵袭能力,以期阐明SMARCA5在NSCLC发生发展中的生物学作用。
1 材料和方法
1.1 标本来源与患者资料 收集2009年1月1日至2010年12月31日舟山医院住院患者131例肺组织标本。根据世界卫生组织肺癌组织学分类标准(2015年),分为47例肺鳞癌和84例肺腺癌。所有入组患者均行根治性手术切除,未行化疗或放疗。新鲜组织标本用4%中性甲醛固定,石蜡包埋,进行组织切片。常规染色采用HE染色。入组患者的肿瘤采用国际抗癌联盟(2009年)的TNM分期系统进行分期。本研究经舟山医院伦理委员会批准。对患者进行门诊和电话随访。生存时间是从手术日期到因复发/转移死亡日期或最后一次随访日期。本研究随访数据截止日期为2016年12月31日,1例患者失访。
1.2 主要试剂 S-P免疫组织化学检测试剂盒(福州迈新生物技术公司);SMARCA5抗体、SMARCA5 siRNA(hSNF2H siRNA)(美国Santa Cruz公司);β-actin抗体(北京中杉金桥生物技术有限公司);Lipofectamine 2000(美国Invitrogen公司);TaKaRa RNA PCR Kit(AMV)Ver.3.0试剂盒(大连TaKaRa公司);MTT增殖试剂盒(美国Sigma公司)。
1.3 方法
1.3.1 免疫组化染色及结果判读:组织采用4%中性甲醛固定,石蜡包埋,制备4 μm切片。免疫染色采用Streptavidin过氧化物酶(S-P)法。按照S-P法进行染色:脱蜡,水化,阻断内源性过氧化物酶活性,抗原修复,封闭,滴加多克隆小鼠抗SMARCA5抗体(1:600)4 ℃过夜,PBS清洗后加入对应的二抗、室温孵育1 h,DAB显色,复染,常规脱水、透明、封片,显微镜下判读。阴性对照为非免疫血清。所有样本均由两名独立的高年资病理医师进行评估。细胞核/细胞质中存在棕黄色颗粒被认为是阳性染色。染色强度分为三个等级(0,阴性;1,中等着色;2,强着色),染色百分率分为5个等级(0,0%;1,1%~25%;2,26%~50%;3,51%~75%;4,76%~100%),在至少5个高倍镜视野(400倍)评估,以阳性细胞率和染色强度的分值乘积作为每一例的积分,评分为4~8分判定为SMARCA5阳性表达或高表达,0~4分为阴性表达或低表达[20]。
1.3.2 细胞培养:选取人类正常支气管上皮细胞系(HBE),人类肺腺癌(adenocarcinoma,ACC)细胞株A549和Lu165,人类鳞状细胞癌(squamous cell carcinoma,SCC)细胞系SK-MES-1和NCI-H520,均接种于RPMI 1640与10%胎牛血清和100 U/mL的青-链霉素培养基中,于37 ℃含5% CO2湿润空气的培养箱中培养。
1.3.3 siRNA干扰实验:细胞接种于六孔板中,接种密度为5×105/孔。实验分3组:未处理组,control siRNA组和SMARCA5 siRNA组,每个实验均重复3次。未处理组和control siRNA组为阴性对照,siRNA浓度为20 μm。在室温下,将10 μg SMARCA5 siRNA和10 μg control siRNA与1.5 mL培养基混合。未处理组在正常培养基中培养。将60 μL Lipofectamine 2000与1.5 mL培养基混合,室温孵育5 min。将稀释后的siRNA与Lipofectamine 2000混合,室温孵育30 min。将该混合物转染A549和SK-MES-1细胞。6 h后,将细胞转移到正常培养基中,转染后培养36 h。然后收集细胞进行研究。
1.3.4 蛋白提取与Western blot:收集细胞,加入500 μL细胞裂解液和蛋白酶抑制剂复合物,冰浴下超声处理。取上清液,10 000×g,4 ℃离心30 min,收集含总蛋白的上清液。上样蛋白量为60 μg,经聚丙烯酰胺琼脂糖凝胶电泳1.5 h后,转印至PVDF膜,加入Western封闭液室温封闭60 min,洗净,分别加入一抗SMARCA5(1:1 000)和β-actin(1:2 000)在4 ℃下孵育过夜。TTBS洗膜3次,后加入对应的二抗(1:2 000)室温下孵育2 h,ECL显色,通过凝胶成像系统采集图像。以目的条带与内参照β-actin条带灰度值之比表示目的蛋白的相对表达水平。实验重复3次。
1.3.5 RT-PCR:使用TRIzol试剂分离提取总RNA。采用RNA PCR kit反转录获得cDNA,并扩增SMARCA5。β-actin作为内参。cDNA的合成条件为:30 ℃ 10 min,42 ℃ 30 min,99 ℃ 5 min,5 ℃5 min。以反转录cDNA为模板扩增mRNA。引物序列:SMARCA5上游引物5’-CCTTTGAAGATGAAACCAGGGCGC-3’,下游引物5’-CTGTTAATAGCTCTTCATCCTCCTC-3’;β-actin上游引物5’-AAATCGTGCGTGACATTAA-3’,下游引物5’-CTCGTCATACTCCTGCTTG-3’。PCR产物用溴化乙酯染色,电泳后用生物成像系统进行分析。使用NIH图像软件测定相对表达强度。实验重复3次。
1.3.6 基质胶侵袭实验(Transwell侵袭小室测定):采用孔径为8 mm的24孔Transwell室评估细胞侵袭。将Matrigel基质胶涂于膜的上表面。转染24 h后,将细胞接种在上室(5×104个细胞/孔)并培养24 h。浸润至膜表面的细胞用甲醇固定,苏木素染色,室温干燥过夜。取下微孔膜,置载玻片上,显微镜下计数侵袭至滤膜下表面的细胞数,每张滤膜随机计数10个视野,取均值。实验重复3次。
1.3.7 MTT实验:将各组细胞悬液分别接种于96孔培养板中(1×104个细胞/孔),培养24 h,每孔加入MTT溶液继续培养4 h,加入DMSO,490 nm波长下测定各孔吸收值,以不含细胞的等体积培养基作对照。绘制细胞生长曲线。实验重复3次。
1.4 统计学处理方法 采用SPSS18.0统计学分析软件。计数资料采用χ2检验,计量资料以表示。两样本比较采用独立样本t检验,多组样本比较采用随机区组设计的方差分析。采用Kaplan-Meier法绘制生存曲线,Log-rank检验进行生存分析,Cox回归分析肺癌患者预后的独立预测因素。P<0.05为差异有统计学意义。
2 结果
2.1 SMARCA5高表达与NSCLC中高pTNM分期、低分化和胸膜浸润相关 为明确SMARCA5蛋白在肺癌组织中的表达,采用免疫组化方法检测了131例肺癌组织中SMARCA5蛋白的表达。SMARCA5蛋白在正常的支气管上皮或肺泡上皮中不表达,在肺鳞状细胞癌与腺癌细胞中阳性表达,定位于细胞核。见图1。78例(59.5%)肺癌组织中SMARCA5高表达(评分≥4分),53例(40.5%)肺癌组织SMARCA5低表达(评分<4分。同时分析了SMARCA5蛋白表达与NSCLC临床病理的关系,SMARCA5的高表达与低分化(P<0.001)、高TNM分期(P<0.001)和胸膜浸润(P=0.032)显著相关。SMARCA5的表达与年龄、性别、组织学、肿瘤大小、肿瘤位置和淋巴结状态无相关性(P>0.05)。见表1。

表1 131例NSCLC中SMARCA5表达与临床病理参数的相关性分析(例)
2.2 SMARCA5高表达与NSCLC患者预后不良相关 采用生存曲线分析术后随访记录完整的患者,在131例NSCLC患者中,SMARCA5高表达患者的总生存率显著低于SMARCA5低表达患者(P=0.001),见图2。多因素生存分析显示,SMARCA5高表达(HR=3.807,P=0.005)、肿瘤直径大(HR=4.626、3.564,P=0.004、0.029)、淋巴结转移(HR=2.554,P=0.009)、肿瘤分化程度低(HR=6.245、16.077,P=0.001、<0.001)、低临床分期(HR=12.903,P=0.010)是肺癌预后的独立危险因素,见表2。

图2 SMARCA5表达与患者总生存率之间的关系
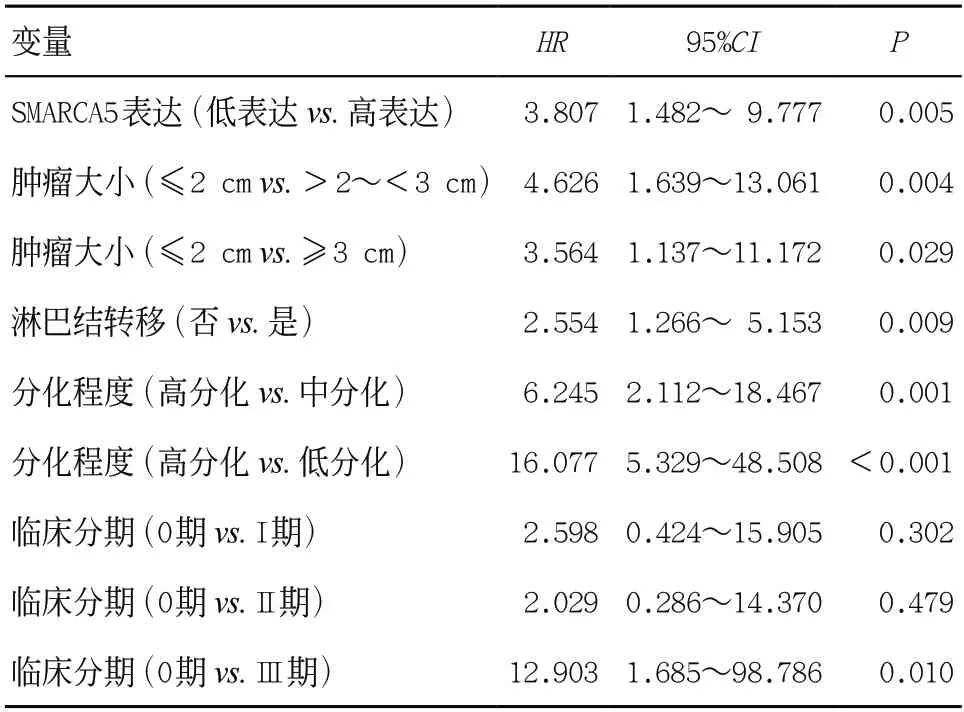
表2 131例NSCLC患者生存预后因素的多因素分析
2.3 NSCLC中沉默SMARCA5可以下调SMARCA5表达 Western blot和RT-PCR检测结果发现SMARCA5在HBE细胞株中的表达明显低于肺癌细胞株(A549、Lu165、SK-MES-1和NCI-H520()蛋白:F=8.221、4.334、8.967、4.219,P<0.05;mRNA:F=7.650、5.328、9.218、4.671,P<0.05)。见图3。在A549和SKMES-1细胞株中采用SMARCA5 siRNA来沉默SMARCA5的表达。将SMARCA5 siRNA片段导入A549和SKMES-1细胞36 h后,RT-PCR和Western blot结果显示,与未处理组和control siRNA组相比,两组肺癌细胞中SMARCA5 mRNA(F=9.245、7.204,P<0.05)和蛋白(F=5.114、3.235,P<0.05)的表达均显著下调,见图4。
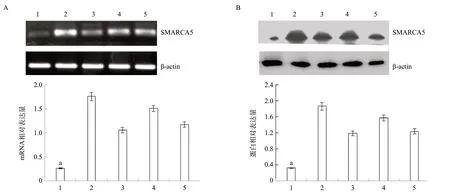
图3 SMARCA5在正常支气管上皮和肺癌细胞株中的表达

图4 在肺癌细胞株中沉默SMARCA5后可以下调SMARCA5的表达
2.4 在NSCLC中沉默SMARCA5表达可抑制细胞增殖和侵袭 MTT法测定结果表明在细胞培养第2~第4天,与control siRNA组或未处理组比,转染SMARCA5 siRNA后A549与SK-MES-1细胞的增殖率明显下降(P<0.05),见图5。在细胞培养第2~第4天,Transwell检测结果显示,SMARCA5 siRNA组与control siRNA组和未处理组相比,侵入Transwell基质胶下表面的细胞数量明显减少(P<0.05),见图6。

图5 沉默SMARCA5表达可以抑制肺癌细胞的增殖

图6 沉默SMARCA5表达可以抑制肺癌细胞的侵袭
3 讨论
新近有研究表明,SMARCA5在原始细胞向肿瘤细胞进化的过程中是必要的,包括白血病、胃癌、乳腺癌等[22-23]。本研究旨在明确SMARCA5蛋白在NSCLC中的表达情况及在肺癌发生发展中的生物学功能。免疫组化结果发现,SMARCA5蛋白在NSCLC组织中表达水平增加,而在正常的支气管上皮或肺泡上皮不表达。同时半定量RT-PCR和Western blot分析发现,SMARCA5在肺癌细胞株中表达高于正常上皮细胞株。有研究显示,SMARCA5在胃癌中表达高于正常胃黏膜上皮[21],这与本研究肺癌中观察到的结果相似:SMARCA5可能在恶性肿瘤中的表达高于正常上皮细胞。此外,本研究进一步分析了肺癌组织中SMARCA5表达与临床病理参数之间的关系。我们发现SMARCA5过表达与TNM晚期、胸膜浸润和肿瘤分化不良显著相关。这些结果表明,SMARCA5高表达可能在肺癌发生发展中发挥了重要作用,SMARCA5可能发挥癌基因的作用,促进肺癌恶性表型形成。
本研究中发现SMARCA5在人类肺癌中普遍表达上调,然而它在肺癌发展中的生物学作用仍不清楚。为了进一步明确SMARCA5对肺癌细胞增殖、侵袭等生物学行为的影响,本研究使用SMARCA5 siRNA干扰了SMARCA5的表达及其引起的生物学效应。结果发现,干扰SMARCA5表达后,A549(肺腺癌细胞系)和SK-MES-1(肺鳞癌细胞系)细胞的增殖能力均较对照组显著减弱。上述结果与TOMAS等[24]的研究结果有相似之处,其研究认为SMARCA5表达缺失可抑制AML细胞增殖,影响干细胞的正常功能。WANG等[19]也报道,在BEL-7402细胞中过表达SMARCA5可促进细胞生长,而在Huh7细胞中下调SMARCA5的表达可抑制细胞的生长。
此外,我们还观察到,沉默SMARCA5的表达会抑制肺癌细胞侵袭。有研究发现,SMARCA5表达缺失可以通过下调MMP2来抑制乳腺癌细胞的侵袭能力[20]。因此,这些结果均提示,沉默SMARCA5表达有可能抑制肺癌细胞的恶性进展;在肺癌的发生发展进程中,SMARCA5可能发挥促进肿瘤增殖、侵袭的作用,具体机制还有待进一步探究。
本研究发现SMARCA5高表达水平的患者比低表达水平的患者生存率更短。进一步运用多因素Cox回归分析发现,SMARCA5蛋白高表达是影响患者预后的独立危险因素,以上结果说明SMARCA5的表达可能影响NSCLC患者的预后。值得我们关注的是,JIN等[20]在乳腺癌中观察到,SMARCA5过表达与乳腺癌的高TNM分期、大小、高增殖指数、较短的生存期相关,这也与本研究结果相似。
总之,本研究发现SMARCA5在NSCLC组织中表达增加,与肿瘤TNM分期、胸膜浸润和肿瘤分化不良相关。利用RNA干扰敲除SMARCA5可降低NSCLC细胞的增殖和侵袭活性。SMARCA5高表达与NSCLC患者不良预后相关,初步揭示了SMARCA5在NSCLC的发生发展中可能发挥一定作用,SMARCA5有潜力成为未来肺癌治疗的靶点。
