温阳消癥方对5/6肾切除小鼠肾纤维化的作用及其机制
2022-07-12余柯娜何立群林晓蒙蔡旭东
余柯娜,何立群,林晓蒙,蔡旭东
1.宁波市中医院 肾病科,浙江 宁波 315000;2.上海中医药大学附属曙光医院 肾病科,上海 200021
各类慢性肾脏病(chronic kidney disease,CKD)终末期不良结局的病理特征是肾纤维化,包括肾小球硬化和肾间质纤维化,其疾病阶段和病变程度与CKD进展至终末期肾脏病(end stage renal disease,ESRD)的程度息息相关。肾纤维化过程涉及生长因子众多,信号通路错综复杂,除经典TGF-β/Smad通路外,Janus激酶2/信号转导子与转录激活子3(Janus kinase 2/signal transducers and activators of transcription 3,JAK2/STAT3)信号旁路也可参与肾纤维化。抗肾纤维化药物研发往往只能从单一途径入手,临床收效甚微。
温阳消癥方是于补虚消癥方[1]之上巧辨阴阳而衍化应用于临床的,动物实验证明其可保护5/6肾切除小鼠肾功能,减轻肾纤维化病理表现,改善单侧输尿管结扎(unilateral ureteral obstruction,UUO)小鼠肾纤维化程度[2-3]。本研究通过建立小鼠5/6肾切除肾纤维化模型,围绕TGF-β1/Smad3、JAK2/STAT3信号通路展开讨论,比较各组小鼠肾组织JAK2、STAT3、p-JAK2、p-STAT3、转化生长因子β1(transforming growth factor-β1,TGF-β1)、Smad3、I型胶原蛋白(Collagen-I,Col-I)、III型胶原蛋白(Collagen-III,Col-III)和α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)的表达差异,探究温阳消癥方在抗肾纤维化方面的作用机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:SPF级雄性C57小鼠32只(8周龄),体质量(20.0±1.5)g,由上海斯莱克实验动物有限公司提供[许可证号:SCXK(沪)2017-0005],饲养于上海中医药大学实验动物中心[许可证号:SYXK(沪)2020-0009]。实验期间自由饮食饮水,饲料由上海中医药大学实验动物中心提供,适应性喂养1周后进行动物模型制作。
1.1.2 药物:温阳消癥方(组成:黄芪30 g,党参30 g,淫羊藿15 g,肉苁蓉15 g,桃仁12 g,川芎15 g,莪术30 g),由宁波明贝中药业有限公司提供中药,煎煮成汤剂。代文由北京诺华制药有限公司生产,批号:H20040216。
1.1.3 试剂:RIPA裂解液(LP002)、SDS-PAGE蛋白上样缓冲液(×2)(PWE-003A)、Super-GL ECL超敏发光液(PWB-001S)均由上海诺伦生物科技有限公司提供,JAK2一抗(ab108596,1:100稀释)、STAT3一抗(ab68153,1:100稀释)、TGF-β1一抗(ab92486,使用浓度1:500)、Smad3一抗(ab40854,1:500稀释)、α-SMA一抗(ab32575,1:1 000稀释)、Col-I一抗(ab138492,1:200稀释)、Col-III一抗(ab6310,1:200稀释)由美国Abcam公司提供;p-JAK2一抗(cst8082s,1:100稀释)、p-STAT3一抗(cst9145p,1:100稀释)由美国CST公司提供;抗GAPDH小鼠单克隆抗体(G8795,1:10 000稀释)由美国Sigma公司提供;GAPDH二抗(115035003,1:2 000稀释,山羊抗鼠)由美国Jakson公司提供,其余指标二抗为山羊抗兔(111035003,1:2 000稀释),由美国Jakson公司提供。
1.2 方法
1.2.1 模型建立:从32只C57小鼠中随机选取24只小鼠,用PLATT法[4]制作5/6肾切除慢性肾功能衰竭肾纤维化模型。于手术台上放置成人尿垫,模型组小鼠于异氟烷吸入麻醉后手术,于左肋下1 cm处行一斜向外下方切口(小鼠:0.8~1 cm),切口约与鼠体长纵轴向内成45°,暴露左侧肾脏,分离肾周围脂肪并剥离肾外包膜后切除肾上下极组织各1/3,用明胶海绵压迫止血10 min后复位肾脏并缝合。一周后行2期手术,同样手法麻醉,切开右背暴露右肾,结扎肾蒂后切除整个右肾。故两次手术共切除约70%肾脏。另8只C57小鼠作为假手术组,两次手术中,仅仅暴露双侧肾脏并分离肾周脂肪、包膜后缝合。
1.2.2 分组:小鼠进入实验室适应性喂养1周后,随机取8只为假手术组,其余24只为造模组,将造模组小鼠按上述方法制作慢性肾功能衰竭动物模型,术后2周行小鼠目内眦采血,测定肾功能,按血清肌酐值将小鼠分为模型组、温阳消癥方组和代文组,使三组间血清肌酐值差异无统计学意义。
1.2.3 给药方法与疗程:温阳消癥方:中药相当于成人等效剂量,人鼠剂量20倍换算,煎煮成汤剂,0.98 g(0.2 mL)/20 g小鼠,连续灌胃8周。代文:人鼠剂量12.33倍换算,0.33 m(g0.2 mL)/20 g小鼠,连续灌胃8周。
1.2.4 取材:治疗8周后,用10%水合氯醛0.15 mL/25 g对所有小鼠麻醉后取血,将血液离心后收集血清,留取肾组织。肾组织:留取假手术组小鼠肾组织和其余小鼠残肾,沿肾组织冠状面纵轴分离等大后一半置于-80 ℃冰箱中保存,另一半置于4%多聚甲醛中用于HE、Masson染色和免疫组织化学的检测。另于低温(4 ℃)、活体、快速用双面刀片取1 mm3的肾脏组织置于戊二醛中,避免组织挤压损伤,后迅速送往上海中医药大学电镜室。
1.2.5 蛋白质印迹(Western blot)法:用Western blot法测定肾脏组织的JAK2、STAT3、p-JAK2、p-STAT3、TGF-β1、Smad3、α-SMA、Col-I、Col-III。将样本12 000×g离心5 min后除去沉淀,加入300 μL裂解液中,混匀使其完全裂解后移至离心管。从离心管中取10 μL样本加入10 μL SDS-PAGE(×2)混匀,100 ℃加热处理5 min,冰上冷却。使用10%SDS-PAGE分离,每孔上样量为20 μL。电泳结束后,将在转换液浸泡过的凝胶、滤纸和在甲醇中浸泡过的PVDF膜一起4 ℃放置10 min,然后制备转移三明治。使用Semi-Dry Cell进行半干电泳转移,转移条件为30 mA,90 min。将转印膜4 ℃封闭过夜,第2天用TBST洗涤3次,每次15 min。加入稀释好的一抗,37 ℃温育2 h。用TBST洗涤4次,每次10 min。加入稀释好的二抗,37 ℃温育2 h。用TBST洗涤4次,每次10 min。用超敏发光液检测,并对X光片曝光、显影、定影,用凝胶成像分析系统拍照,采用Gel-Pro Analyzer软件来分析处理。
1.2.6 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RTqPCR)法:RT-qPCR法测定肾组织TGF-β1 mRNA表达,按照Genbank数据库中公开发表的基因序列,采用primer express引物设计软件,设计TGF-β1引物。采用TRIzol法提取细胞总RNA,将mRNA反转录为cDNA模板,进行RT-qPCR实验。TGF-β1引物序列:上游引物5’-GCTGCGCTTGCAGAGATTAAAATC-3’,下游引物5’-AGGTAACGCCAGGAATTGTTGCTA-3’;Smad3引物序列:上游引物5’-CACGCAGAACGTGAACACC-3’,下游引物5’-GGCAGTAGATAACGTGAGGGA-3’;以β-actin为内参,引物序列:上游引物5’-AAGATCAAGATCATTGCTCCTCC-3’,下游引物5’-GACTCATCGTACTCCTGCTTGC-3’。扩增条件:95 ℃,变性3 min;然后按下述条件循环40次;95 ℃变性12 s,62 ℃退火40 s。程序运行结束后,分析各基因的实时扩增曲线和熔解曲线。取Ct值,按2-ΔΔCt法计算待测目的基因相对表达量。
1.2.7 免疫组织化学染色:采用3 μm石蜡包埋肾脏组织切片进行免疫组织化学染色分析。用3% H2O2封闭,用0.01 mol/L PBS洗涤2次,每次5 min。然后加入100 μL血清,37 ℃孵育30 min,与α-SMA抗体(1:200)、Col-I(1:200)抗体、Col-III(1:200)抗体4 ℃孵育过夜。第2天,用PBS洗涤染色切片3次,并在37 ℃下与HRP标记的二级抗体孵育30 min,然后再次用PBS洗涤3次。通过DBA染色观察组织切片,用自来水冲洗10 min,用苏木素反向染色45 s,冲洗10 min,脱水,封片。
1.3 统计学处理方法 采用SPSS18.0软件进行统计分析。计量资料用表示,2组比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肾功能比较 5/6肾切除手术过程中,有3只小鼠死亡,术后2周内再次出现3只小鼠死亡。故术后2周将剩余18只小鼠分为5/6肾切除组、代文组和温阳消癥方组,使3组肌酐值差异无统计学意义。为使各组小鼠数量均衡,假手术组小鼠仅取6只进行后续研究。与假手术组比较,5/6肾切除组血肌酐和血尿素氮含量升高(P<0.01);与5/6肾切除组比较,温阳消癥方组、代文组血肌酐和血尿素氮含量减低(P<0.01)。见表1。
表1 各组小鼠血清肌酐及尿素氮检测结果(每组n=6,)

表1 各组小鼠血清肌酐及尿素氮检测结果(每组n=6,)
与假手术组比:aP<0.01;与5/6肾切除组比:bP<0.01
2.2 小鼠肾组织病理改变
2.2.1 小鼠肾组织HE染色:5/6肾切除组小鼠病理形态表现为肾小管扩张,肾小管蛋白管型形成及部分肾小管坏死,肾间质表现为炎症细胞增多和纤维化形成;代文组、温阳消癥方组均可见肾小管坏死,肾间质炎性细胞浸润,蛋白管型较5/6肾切除组少,肾间质纤维化范围较模型组小,总体病变程度较模型组轻。见图1。

图1 各组小鼠肾脏HE染色结果
2.2.2 小鼠肾组织Masson染色:5/6肾切除组小鼠肾组织蓝染的胶原面积较大,主要分布在肾小管、肾间质以及部分硬化的肾小球内部,代文组、温阳消癥方组肾组织蓝染的胶原面积较小,主要分布在肾小管及肾间质。见图2。与假手术组比较,5/6肾切除组胶原阳性率升高(P<0.01);与5/6肾切除组比较,温阳消癥方组、代文组胶原阳性率减低(P<0.01)。见图3。

图2 各组小鼠肾脏Masson染色结果
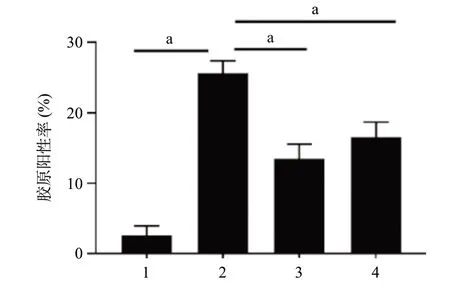
图3 各组小鼠肾脏Masson染色胶原阳性率比较
2.2.3 肾组织电镜表现:5/6肾切除组成纤维细胞增多,基质增宽,线粒体嵴断裂,线粒体肿胀,间质胶原增多;代文组、温阳消癥方组成纤维细胞数量及间质胶原范围均较5/6肾切除组减少。见图4。

图4 各组小鼠肾组织透射电镜结果(×4 200)
2.3 免疫组织化学结果 5/6肾切除组小鼠肾组织中α-SMA、Col-I、Col-III蛋白阳性黄染面积较其他组更大,颜色更深,阳性黄染部位主要分布在肾小管、肾间质。代文组、温阳消癥方组的阳性黄染主要分布在肾小管、肾间质,其面积较5/6肾切除组小,颜色较5/6肾切除组浅。见图5。5/6肾切除组小鼠肾组织Col-I、Col-III、α-SMA蛋白含量均高于假手术组,差异有统计学意义(P<0.01)。与5/6肾切除组比,温阳消癥方组、代文组小鼠肾组织α-SMA、Col-I、Col-III蛋白含量降低,差异有统计学意义(P<0.01);与代文组比较,温阳消癥方组Col-I、Col-III蛋白含量较低,差异有统计学意义(P<0.01),而α-SMA蛋白含量在两治疗组间差异无统计学意义(P>0.05)。见图6。
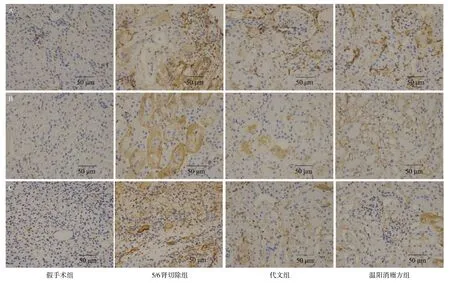
图5 各组小鼠肾组织α-SMA(A)、Col-I(B)、Col-III(C)免疫组织化学结果
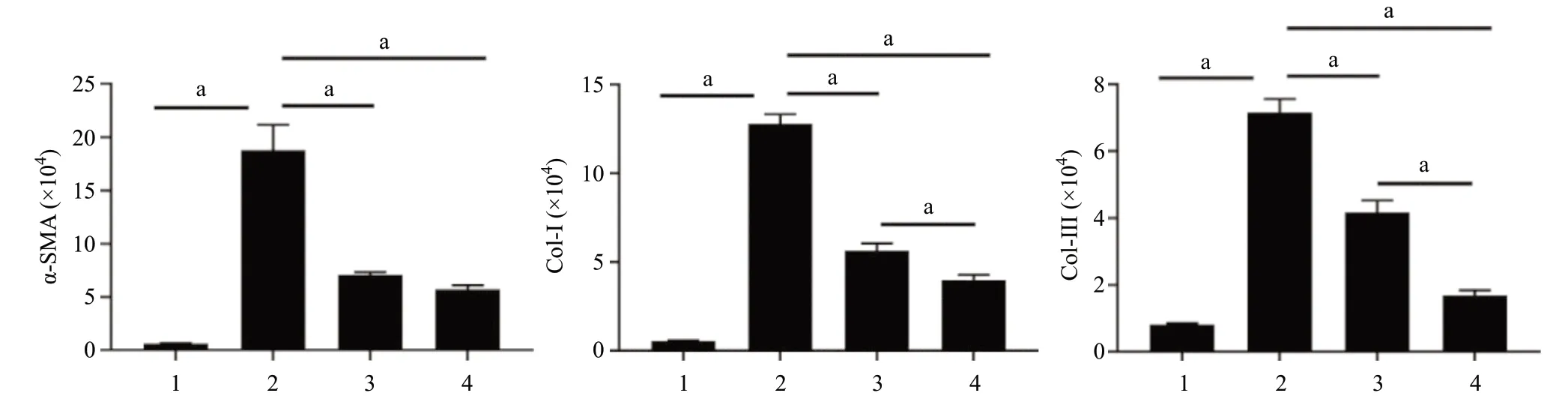
图6 各组小鼠肾组织α-SMA、Col-I、Col-III免疫组织化学半定量表达结果
2.4 Western blot检测结果 5/6肾切除组小鼠肾组织JAK2、STAT3、p-JAK2、p-STAT3、TGF-β1、Smad3、Col-I、Col-III、α-SMA蛋白含量均高于假手术组,差异均有统计学意义(P<0.01)。与5/6肾切除组比较,温阳消癥方组、代文组小鼠肾组织JAK2、STAT3、p-JAK2、p-STAT3、TGF-β1、Smad3、α-SMA、Col-I、Col-III蛋白含量均降低,差异有统计学意义(P<0.01);与代文组比较,温阳消癥方组JAK2、STAT3、p-JAK2、p-STAT3、Smad3、Col-I、Col-III、α-SMA蛋白含量较低,差异有统计学意义(P<0.01),而TGF-β1蛋白含量在两治疗组之间差异无统计学意义(P>0.05)。见图7。

图7 各组小鼠肾组织JAK2、STAT3、p-JAK2、p-STAT3、Col-I、Col-III、α-SMA、TGF-β1、Smad3蛋白表达结果
2.5 RT-qPCR结果 5/6肾切除组小鼠肾组织TGF-β1、Smad3 mRNA含量均高于假手术组,差异有统计学意义(P<0.01)。与5/6肾切除组比较,温阳消癥方组、代文组小鼠肾组织TGF-β1、Smad3 mRNA含量降低,差异有统计学意义(P<0.01);与代文组比较,温阳消癥方组TGF-β1、Smad3 mRNA含量较低,差异有统计学意义(P<0.01),见图8。
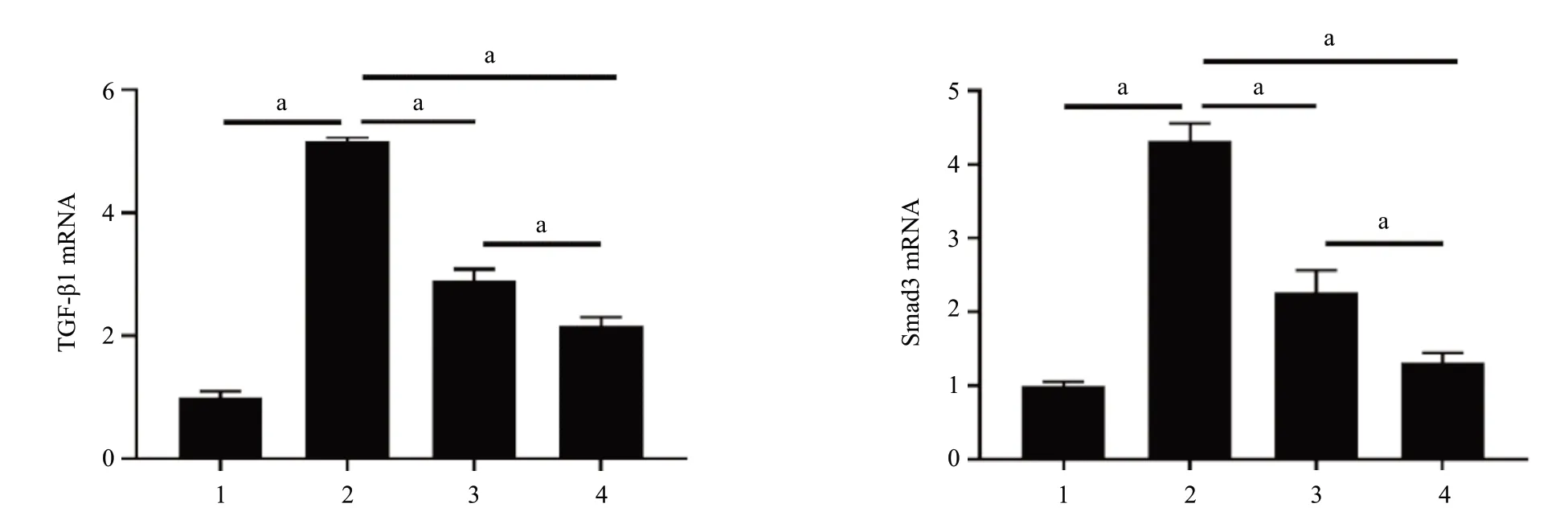
图8 各组小鼠肾组织TGF-β1、Smad3 mRNA表达结果
3 讨论
作为各类CKD通往ESRD的共同病理路径,肾脏纤维化是一系列疾病因子纵横交错所致的瀑链式反应,其病理发生过程,涉及生长因子、炎症反应、肾小管上皮细胞-肌成纤维细胞转分化(tubular epithelial myofibroblast trans-differentiation,EMT)、信号通路、细胞凋亡等。虽然ECM降解剂/抑制剂、TGF-β1单克隆抗体、内皮素受体拮抗剂、炎症因子抑制剂、HIF-1α抑制剂、基因靶向治疗、干细胞移植治疗等[5-6]均能围绕肾纤维化单一病理途径开展治疗,然而肾纤维化涉及作用靶点之多可能使得各通路间相互干扰,并且其治疗效果也视所处病理阶段而定,因此延缓甚或逆转肾纤维化药物的开发仍难有重大突破,寻找多靶点的抗肾纤维化药物也成了临床和实验室研究亟待解决的难题之一。
近年来,中医药多靶点干预治疗在多领域凸显锋芒,研究者也开始充分挖掘其在肾纤维化治疗中的巨大优势[7-9],以期指导临床。之于慢性肾功能衰竭,中医只有“虚劳”“腰痛”“水肿”等病名。究其病因,大多涉及脾肾两虚、湿热毒邪和瘀血内阻。温阳消癥方以“肾虚血瘀”为病因立论,聚焦以温阳活血之法消肾内微型癥积。淫羊藿、肉苁蓉补肾温阳,补助肾衰之根本,桃仁、川芎、莪术三者联用行气活血而使化瘀之力恢宏,党参、黄芪二者益气升阳,既助扶阳又益行瘀,此一举三得。而另有肉苁蓉填精润燥、党参和胃生津之就,使得全方温而不燥,丰育肾阴。
从中医治法宏观而论,温阳消癥方可温阳补肾、活血化瘀。本研究采用5/6肾切除为肾纤维化动物模型,术后小鼠残肾将逐渐代偿增大。我们猜想,温阳消癥方的干预会否有益于残肾代偿生长中的结构重塑?其是否可以通过补肾填精之力使得残肾代偿产生更多的肾单位,此外其活血化瘀之功是否可同时改善残肾代偿时发生的纤维化?
从方药成分微观分解,温阳消癥方中药物有效单体已于肾纤维化研究中展开讨论:如黄芪甲苷可通过抑制miR-192表达减轻肾纤维化[10-11];淫羊藿苷于CKD肾纤维化具治疗意义[12],能改善UUO小鼠及糖尿病大鼠肾小管间质纤维化程度[13-14];苦杏仁苷[15-16]可通过抗氧化应激、抗炎症和抗纤维化改善慢性肾衰大鼠肾损伤等。由此,我们期待温阳消癥方的研创能够在肾纤维化研究领域中发挥更加长足的优势。
TGF-β1是成纤维细胞激活的核心介质[17-19],可以通过Smad依赖和非Smad依赖方式作为关键细胞因子参与肾纤维化。Smad蛋白家族庞大,其中仅Smad2/3由TGF-β激活,临床研究和动物实验均证实通过经典通路TGF-β1/Smad3的激活介导能够促进肾纤维化[20-21]。
JAK2/STAT3广泛存在于各类组织和细胞中,可通过作用多种上下游细胞因子和生长因子广泛参与细胞的增殖、分化、凋亡和免疫应答[22]。上游细胞因子与其受体结合后,先后使得JAK2、STAT3发生磷酸化,p-STAT3最终以二聚体形式转录到细胞核中,诱导或抑制目的基因表达[23]。肾脏病领域研究中,JAK2/STAT3通路的激活除了参与肾小管上皮细胞损伤或凋亡[24-25]、肾小球系膜细胞增生[26]外,也可参与糖尿病肾病肾纤维化[27]。此外,JAK2/STAT3还与EMT相关[28],并且STAT3或p-STAT3活性的增加可促进肾间质成纤维细胞的增殖和肾纤维化的进展[29]。除自身参与肾纤维化外,JAK2/STAT3也可通过上调其他多通路而致病[30]。
JAK2/STAT3、TGF-β1/Smad3除通路本身能介导纤维化外,两者还可通过相互作用共同促进纤维化。研究发现,TGF-β1[31-33]可作为JAK2/STAT3通路的上游细胞因子,通过与受体的结合激活通路并参与肾纤维化,反之,对JAK2/STAT3的抑制也可减少TGF-β1的合成[34]。而在TGF-β诱导的EMT中,IL-6激活的STAT3可促进Smad3的核定位[35]。另外,也有研究显示TGF-β1/Smad3的激活能通过诱导STAT3磷酸化[36]促进肝纤维化。
本研究同时观察TGF-β1/Smad3与JAK2/STAT3的变化,探究温阳消癥方对肾纤维化的作用机制。从中我们得知,模型组α-SMA、Col-I、Col-III蛋白含量较假手术组显著上调,肾组织内α-SMA、Col-I、Col-III的含量、比例对肾纤维化程度的病理诊断意义重大,结合其肾功能改变及肾组织病理特点,结果提示模型组小鼠肾组织显著纤维化。温阳消癥方治疗8周后,上述纤维化相关指标蛋白含量下调明显,表明温阳消癥方有助于改善肾组织内部胶原含量,于肾纤维化治疗有益。我们进一步测定TGF-β1/Smad3及JAK2/STAT3通路指标变化以探究其中作用机制,发现模型组小鼠肾组织TGF-β1、Smad3的蛋白及mRNA含量大幅上调,此时,伴随JAK2/STAT3通路同步激活,JAK2、STAT3发生磷酸化(p-JAK2、p-STAT3),共同促进肾纤维化。治疗8周后,温阳消癥方组、代文组小鼠肾组织TGF-β1、Smad3含量下调,JAK2、STAT3磷酸化程度减弱,TGF-β1/Smad3、JAK2/STAT3通路被抑制,由此拮抗肾纤维化。而与代文相比,温阳消癥方对JAK2/STAT3通路的抑制作用更显著。至于本研究中TGF-β1/Smad3与JAK2/STAT3是否通过协同作用而加速肾纤维化,目前尚未可知。后期研究中或可选择阻断其中一条通路来探究二者在5/6肾切除小鼠中是否存在作用关系。
综上所述,5/6肾切除小鼠在术后10周发生肾纤维化,TGF-β1/Smad3及JAK2/STAT3通路同步激活共同促进肾纤维化。温阳消癥方能够减轻5/6肾切除小鼠肾组织纤维化程度,保护残肾功能,延缓慢性肾功能衰竭疾病进程,其中机制可能与抑制TGF-β1/Smad3、JAK2/STAT3信号通路相关。
