无溶剂条件下Ru/Mn-Al催化糠醇加氢制1,2-戊二醇
2022-07-11王新承杨靖丰郑枝源易玉峰杜松松
王新承,杨靖丰,郑枝源,黄 龙*,易玉峰,高 乐,杜松松
(1.北京石油化工学院燃料清洁化及高效催化减排技术北京市重点实验室,北京102617;2.山东省非粮乙醇生物炼制技术创新中心,山东 临沂 276400)
1,2-戊二醇作为一种重要的化工产品,是合成广谱杀菌剂丙环唑的主要原料,作为增溶剂、抗菌剂和保湿剂广泛应用于护肤品,也可用于生产聚酯纤维、表面活性剂和医药中间体等[1-4]。目前我国1,2-戊二醇产能不足,缺口较大,且国内现役装置普遍存在1,2-戊二醇合成工艺生产成本高、操作复杂、设备腐蚀严重等问题[5]。我国是世界上最大的糠醛生产国,其加氢制糠醇工艺成熟,目前国内可供应大量价格低廉的糠醇。因此,开发一条以价格低廉易得的糠醇为原料,反应温和、操作简单、产品质量高的1,2-戊二醇合成工艺路线具有显著的工业化前景。
1,2-戊二醇的合成路线主要有两种:以正戊烯法为代表的传统工艺和生物质基新工艺[6-8]。侯薇等[9]以1-戊烯、醋酐为原料,在浓硫酸催化下烯烃经过硼酸钠氧化后水解生成1,2-戊二醇的收率可达50%。该方法的主要优点在于原料价格低、反应条件温和。然而浓硫酸对反应影响较大,极易发生副反应。Severeynsa A等[10]报道了一种锇催化1-戊烯双羟基化反应体系,反应物转化率为83%,1,2-戊二醇选择性达99%,并且催化剂活性组分四氧化锇负载于二氧化硅上,可重复利用。Siegmeier R等[11]报道了1-戊烯在苯、环氧丙酸作用下经过环氧化、水解反应生成1,2-戊二醇的方法。该方法采用过氧丙酸作为氧化剂,由于其易燃易爆,工业化大规模生产容易造成安全隐患,且NaOH作为水解溶质会造成设备严重腐蚀。余小鸥[12]以过氧甲酸为氧化剂,1-戊烯先氧化成1,2-环氧戊烷后水解制备1,2-戊二醇。正戊烯法工艺流程主要包括正戊烯选择性氧化制戊烯氧化物以及碱性条件下的水解反应,普遍存在生产成本高、设备腐蚀等问题。
生物质作为可再生资源,具有价格低廉、供给量充足等优点,因此开发生物质基1,2-戊二醇的生产工艺成为当前的研究热点[13]。以糠醇为原料,Adkins H等[14-17]报道了一种Cu-Cr催化氢解体系,在250 ℃,H2压力15 MPa的反应条件下可以实现60%的糠醇转化率,产物中1,5-戊二醇和1,2-戊二醇的选择性分别为15%与14%。将Cu-Cr催化剂用醋酸预处理后,相同H2压力下,反应温度降为170 ℃时,1,5-戊二醇与1,2-戊二醇的选择性分别为50%和40%。Liu H等[18]报道了一种以水滑石为前驱体制备的弱碱性Cu-Mg3AlO4.5双功能催化剂,在140 ℃,H2压力8 MPa条件下,1,2-戊二醇与1,5-戊二醇的选择性之和可达到70%。Cu-LaCoO3催化剂对呋喃环C-O键具有优异的氢解活性,戊二醇选择性随Cu负载量的增加先升高后降低,糠醇转化率可达100%,戊二醇最佳选择性为55%(其中1,5-戊二醇与1,2-戊二醇之比接近3∶1)。Yamaguchi A等[19]以MgO为载体制备的Ru催化剂,在190 ℃、H2压力3MPa条件下反应1 h,1,2-戊二醇选择性高达42%。Hu J L[20]报道了一种碱性Silicalite-1分子筛负载纳米Pt颗粒催化剂的制备方法,制备的催化剂可以在 4.5 MPa、115 ℃的反应条件下氢解糠醇生成1,2-戊二醇,1,2-戊二醇选择性达80.2%,且糠醇完全转化。该方法适用于低浓度的糠醇溶液,然而碱性Silicalite-1分子筛价格较高,工业化成本较高。Zhang B等[21]发现以MnOx为载体负载的Ru催化剂,在150 ℃、H2压力1.5 MPa的反应条件下能够实现99%的糠醇转化率,1,2-戊二醇选择性达32%,主要副产物四氢糠醇选择性为60%,说明以MnOx为载体有着优异的催化性能。Wang X L等[22]制备了Ru-Mn/CNTs碳纳米管催化剂,得到了20%的1,2-戊二醇选择性,进一步肯定了MnOx在催化剂中的重要作用。
本文设计开发一种双组分Ru/Mn-Al催化剂,对催化剂制备工艺及反应条件进行关联及优化,并结合N2物理吸附、H2-TPR、X射线衍射等表征分析,对Ru/Mn-Al催化剂构效关系进行分析探讨。
1 实验部分
1.1 催化剂制备及表征
本文制备了Mn-Al、Mn-Si、Mn-Ti、Sn-Al及Zr-Al五种双组分载体负载型Ru催化剂。以双组分载体Ru/Mn-Al催化剂制备为例。将1.0 mol·L-1Mn(NO3)2溶液和1.0 mol·L-1Na2CO3溶液于80 ℃水浴条件下同时均匀缓慢加入三口烧瓶中,控制加液速度使混合液pH值为9,滴加结束后持续搅拌15 min;然后加入适量拟薄水铝石继续搅拌15 min,得到的沉淀物经去离子水和乙醇多次洗涤除去Na+、110 ℃过夜干燥、500 ℃焙烧5 h制得Mn-Al载体。
取10 g的Mn-Al载体置于0.03 g·mL-1的RuCl3浸渍液中室温下搅拌浸渍6 h,110 ℃干燥6 h、500 ℃焙烧5 h。冷却至室温后,用去离子水和乙醇多次洗涤催化剂,除去Cl-,直至用AgNO3试剂测试洗涤液无明显白色沉淀,最后110 ℃干燥6 h备用。
对制备催化剂进行XRD、H2-TPR、TEM、热重、BET、XRF及XPS表征分析。
1.2 催化剂活性评价
糠醇加氢反应在高温高压反应釜中进行,反应前催化剂首先在150 ℃下用H2还原4 h。反应温度150 ℃,压力1.5 MPa,反应时间10 h,搅拌转速600 r·min-1,催化剂用量0.2 g,糠醇溶液浓度10%(质量分数),糠醇溶液质量100 g。
液相产物使用GC-7890A型气相色谱仪进行分析。色谱柱CP9025-Agilent,FID检测器,检测器温度240 ℃,汽化温度200 ℃,进样量0.2 μL,采用面积归一法确定产物组成。
2 结果与讨论
2.1 催化剂表征结果及活性筛选
不同催化剂的N2等温物理吸附-脱附表征结果如图1所示。Ru/Mn-Al与Ru/Sn-Al催化剂属于IUPAC分类中的Ⅳ型,回滞环为非典型的H1滞后环。Ru/Mn-Al的最可几孔径分布在8 nm和33 nm,Ru/Sn-Al的最可几孔径分布在15 nm。Ru/Mn-Si和Ru/Mn-Ti催化剂也属于IUPAC分类中的Ⅳ型,回滞环为H3型滞后环,其等温吸脱附曲线在不同压力段的吸附量上升平缓,可能的原因为狭缝孔,有别于粒子堆积,是一些层状结构产生的孔。同时N2吸附量较小,说明该催化剂比表面较小,结合表1可以得到验证。得益于较长的陈化时间,介孔结构得到充分形成,孔道比较规整。Ru/Mn-Si的最可几孔径分布在18 nm,Ru/Mn-Ti的最可几孔径分布在23 nm。
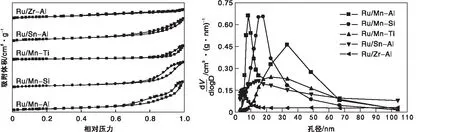
图1 双组分载体负载Ru基催化剂N2等温吸附-脱附曲线和孔径分布图Figure 1 N2 physisorption isotherm and pore size distribution of the Ru-based catalyst supported on dual-component carrier
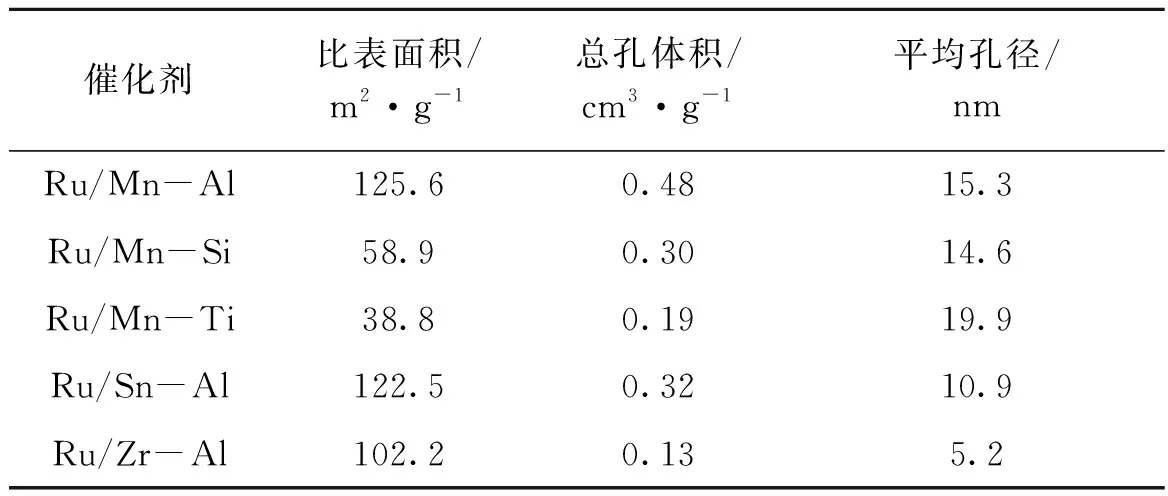
表1 双组份载体负载Ru基催化剂比表面积和孔结构数据Table 1 Surface area and pore structure of the Ru-based catalyst supported on dual-component carrier
通过H2-TPR表征Ru基催化剂的还原性能,结果见图2。由图2可以看出,Ru/Zr-Al催化剂在183 ℃和394 ℃有两个还原峰,归属于负载型RuO2的还原峰[23-24]。Ru/Sn-Al在低温段与高温段出现了两个H2还原峰,分别为Ru氧化物在217 ℃低温还原峰与441 ℃高温还原峰。(170~220) ℃ 的还原峰对应催化剂表面RuO2还原为金属Ru,尤其是217 ℃的极弱峰对应较大颗粒RuO2的还原[25],并且没有中间态Ru2+与Ru3+的出现[26]。350 ℃以上的还原峰则是由于Ru物种与载体之间较强的相互作用所形成的比较难还原的Ru物种[27]。
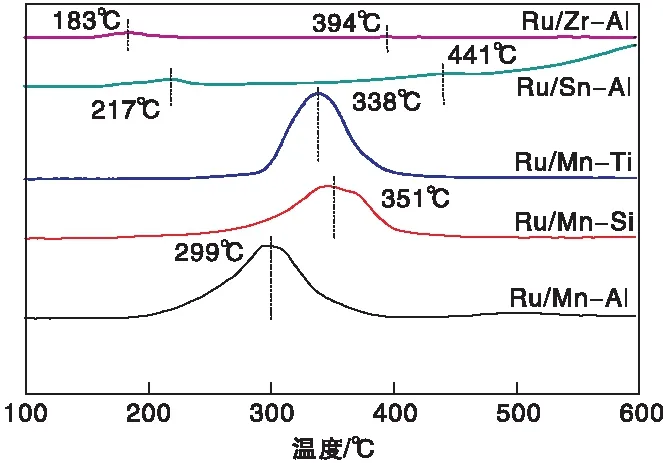
图2 双组份载体负载Ru基催化剂的H2-TPR曲线Figure 2 H2-TPR profiles of the Ru-based catalyst supported on dual-component carrier
在Ru/Mn-Al、Ru/Mn-Si、Ru/Mn-Ti的还原曲线中并没有发现RuOx的还原峰,因为Ru的负载量较低,当催化剂中MnOx被还原时出现较大的还原峰,导致RuOx的还原峰被掩盖。据报道[28],锰氧化物的还原过程为:MnO2→Mn2O3→Mn3O4→MnO,催化剂在(200~400) ℃时出现了一个大包峰,与上述还原过程相吻合,即催化剂还原后的Mn主要以MnO形式存在。同时通过对比可以看出大包峰的位置出现了一定的偏移,Ru/Mn-Si与Ru/Mn-Ti催化剂的MnOx还原峰与Ru/Mn-Al催化剂相比分别向高温区偏移了52 ℃和39 ℃。这是因为SiOx与TiOx的掺杂增强了其与MnOx的相互作用力,使载体中的MnOx难以被还原,提高了MnOx的还原温度。
对Ru/Mn-Al催化剂进行XPS分析,结果如图3所示。由XPS全谱图可以看出,催化剂表面含Ru、Mn、Al及O元素。图3(B)为Ru/Mn-Al催化剂的Al 2p轨道谱图,Al 2p的峰值为74.15 eV,该结合能为催化剂表面Al2O3的Al3+。图3(C)为Ru/Mn-Al催化剂中Mn 2p谱图,Mn 2p3/2的峰值为642.03 eV,Mn 2p1/2的峰值为653.63 eV,自旋能分离值为11.6 eV,与文献[29]报道的MnO2一致。图3(D)为Ru/Mn-Al催化剂的Ru 3d轨道谱图,Ru 3d的峰值为284.98 eV,与文献中报道的RuO2的标准峰值相比向高能方向偏移了4.32 eV。
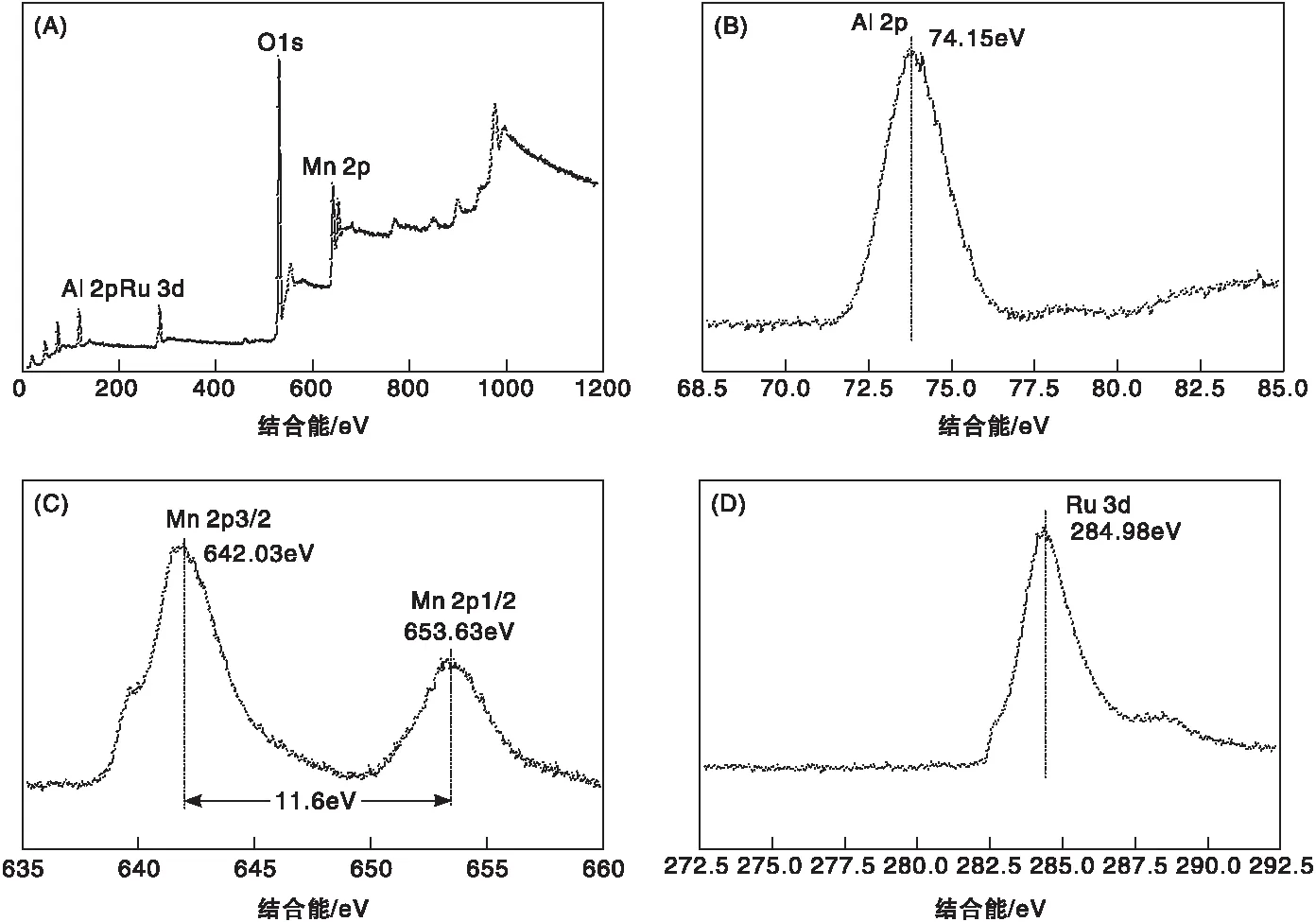
图3 Ru/Mn-Al催化剂的XPS分析:全谱图(A)、Al 2p(B)、Mn 2p(C)、Ru 3d(D)Figure 3 XPS spectra of the Ru/Mn-Al catalyst:survey spectrum(A), A12p spectrum(B),Mn 2p spectrum(C) and Ru 3d spectrum(D)
不同二元载体负载型催化剂Ru 3d和Mn 2p的XPS分析如图4所示。对比不同催化剂的Ru 3d轨道峰值可以得出,Sn-Al和Zr-Al载体负载的RuOx相比于Mn系负载RuOx峰值向高结合能偏移了0.15 eV。通过对比不同Mn系载体负载Ru基催化剂的Mn 2p轨道峰值可以得出,各催化剂中MnOx的轨道特征峰并无明显差异,说明载体中加入的第二种金属组分对于Mn 2p轨道电子没有产生影响。结合H2-TPR分析,Ru/Sn-Al和Ru/Zr-Al催化剂中的RuOx有一部分与载体形成了较强的作用力,使得电子密度由Sn和Zr向Ru产生转移,从而使得结合能升高[30-32]。
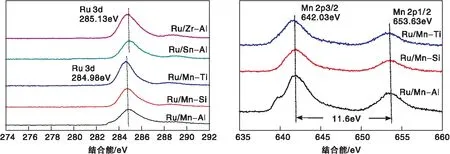
图4 不同二元载体负载型催化剂Ru 3d和Mn 2p的XPS分析Figure 4 XPS analysis of different binary supported catalysts Ru 3d and Mn 2p
Ru/Mn-Al催化剂TEM照片如图5所示。从图5可以看出,活性组分Ru在双组分载体Mn-Al上均匀分布,未出现活性组分团聚的现象。Mn-Al载体中的MnOx均匀地分散在催化剂表面,拥有较高的暴露量,这些都有利于提升糠醇转化率和1,2-戊二醇选择性。通过TEM可以看出,制备的Ru/Mn-Al催化剂是一种Ru粒子均匀分散的金属氧化物催化剂。

图5 Ru/Mn-Al催化剂TEM照片Figure 5 TEM images of the Ru/Mn-Al catalyst

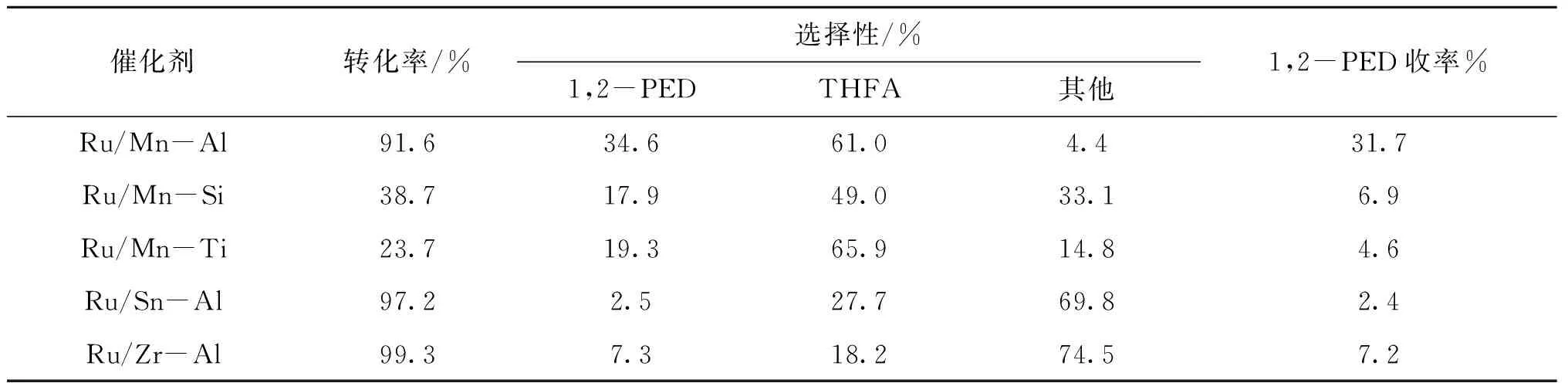
表2 双组份载体负载Ru基催化剂活性评价结果Table 2 Activity test results of the two-component carrier supported Ru-based catalysts
结合表1与表2可以看出,拥有较高比表面的Ru/Mn-Al、Ru/Sn-Al与Ru/Zr-Al催化剂展现出较高的催化活性,糠醇转化率可以达到90%以上。比表面积较低的催化剂Ru/Mn-Si和Ru/Mn-Ti的糠醇转化率只有20%~40%,说明催化剂比表面积是影响催化活性的关键因素。因此,本文优选出Ru/Mn-Al催化剂进行后续研究。
2.2 双组分载体组成元素比例考察
通过改变双组份载体的金属物质的量比,从而改变催化剂表面酸性中心数量与催化剂孔径、比表面积等特性,探究对Ru/Mn-Al催化剂性能的影响,结果如表3所示。
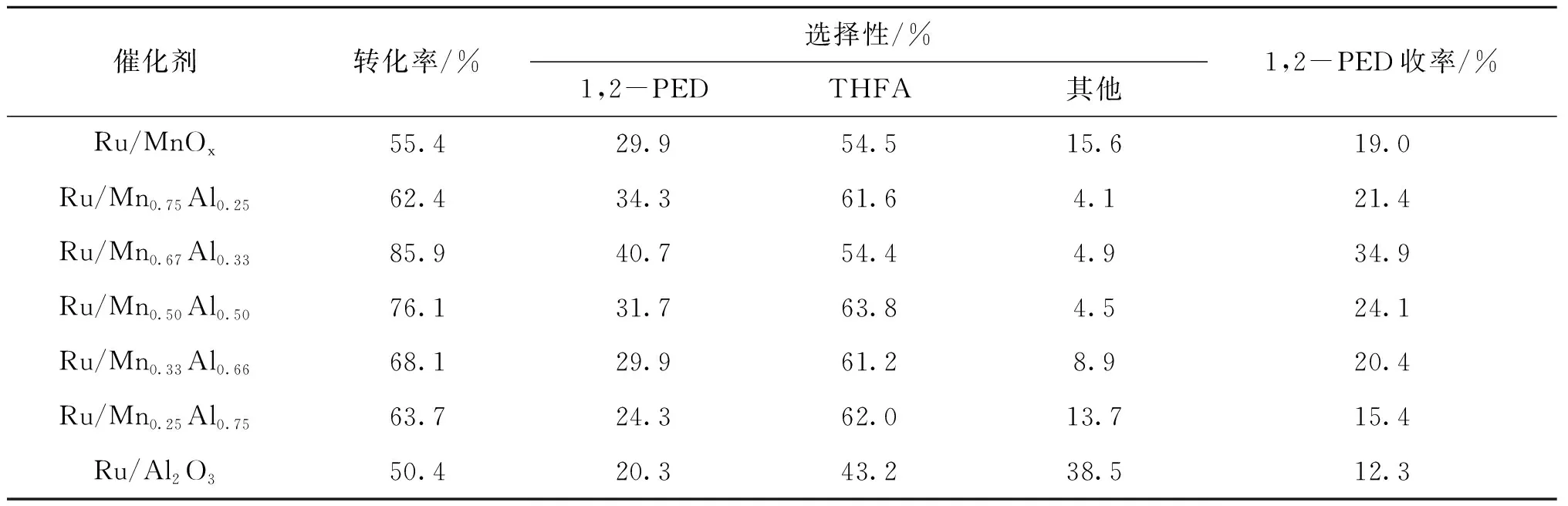
表3 载体不同组份负载Ru基催化剂评价结果Table 3 Activity test results of Ru-based catalysts supported on different carrier components
从表3可以看出,随着Al元素在二元载体中比例增加,糠醇转化率与1,2-戊二醇选择性先增大后减少,其中Ru/Mn0.67Al0.33催化剂活性与1,2-戊二醇选择性最高,糠醇转化率为85.9%,1,2-戊二醇收率与选择性分别为34.9%与40.7%。随着Al元素进一步增加,催化剂活性明显下降,并且反应中产生了更多的副产物。与Ru/Al2O3催化剂对比可以发现,催化剂载体中引入MnOx可以有效地提升催化剂的整体活性,并且可以减少反应体系中副产物的产生。随着Al在双组份载体中比例的增加,催化剂对糠醇树脂化的抑制作用也在逐渐下降,Al含量在载体中占比为75%时,反应结束后甚至可以看到有部分催化剂被粘连在反应釜的搅拌桨上。
不同载体组分负载Ru基催化剂比表面积及孔结构数据如表4所示。
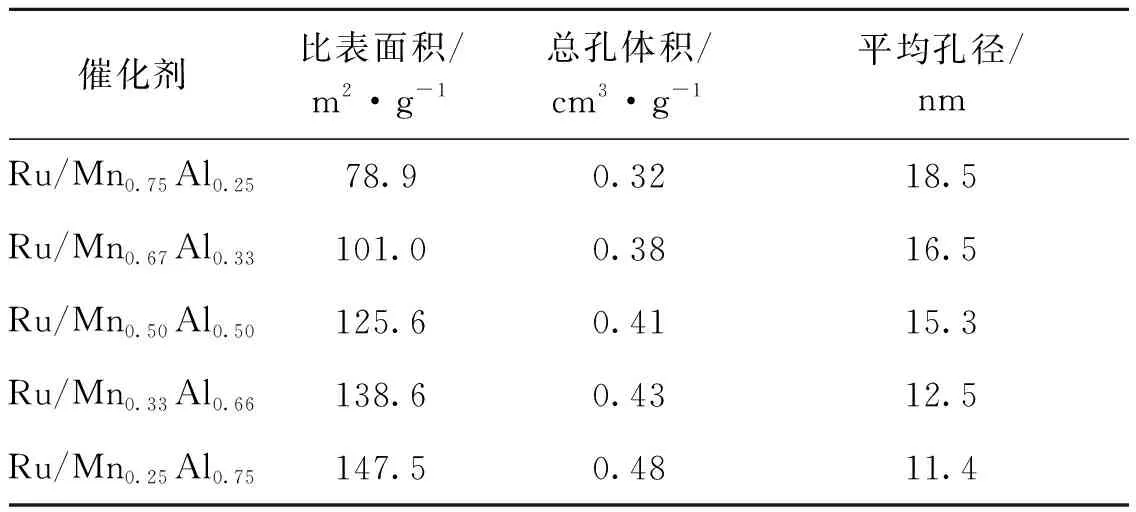
表4 载体不同组份负载Ru催化剂的比表面积和孔结构数据Table 4 Surface area and pore structure of the Ru-based catalysts supported on different carrier components
从表4可以看出,随着载体体系中Al含量的增加,催化剂比表面积与孔容明显增大,结合表3结果可知,当Al在二元载体中的占比为25%~33%时,1,2-戊二醇选择性与糠醇的转化率均呈上升趋势,这说明催化剂活性在一定范围内与催化剂比表面积与孔容正相关。当Al占比持续上升时,虽然催化剂比表面积与孔容进一步上升,但催化剂活性却开始下降,这是因为MnOx的存在可以有效提升催化剂的催化活性,当Al含量不断增加时,Mn的相对含量就会减少,从而降低了催化剂的反应活性与选择性。综上,当双载体组份比为Mn0.67Al0.33时,催化剂催化效果最好。
2.3 活性组分Ru负载量优化
Ru负载量对催化剂活性的影响见图6。
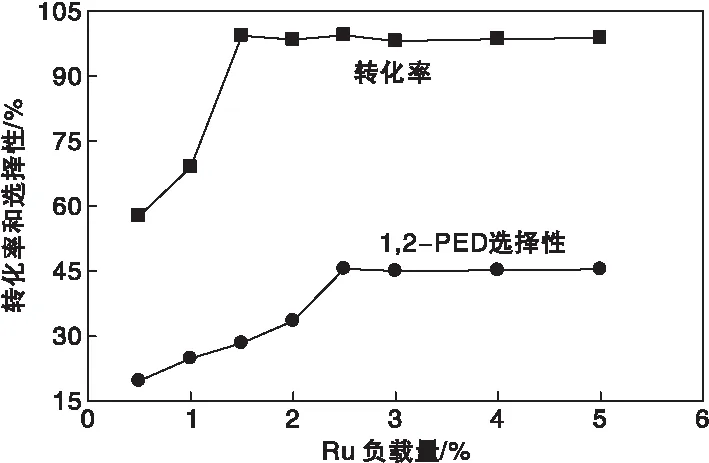
图6 Ru负载量对催化剂活性的影响Figure 6 Effect of Ru loadings on the catalyst activity
由图6可知,随着Ru负载量的增加,糠醇转化率与1,2-戊二醇选择性先递增后趋于稳定。当Ru负载量在0.5%~1.5%时,随活性组分Ru负载量的增加,催化剂活性上升明显。在此区间内,活性组分负载量是限制催化剂活性的关键因素,糠醇转化率由57.8%迅速上升到99.3%,近似呈现出线性规律,但1,2-戊二醇选择性依然较低。当Ru负载量升至2.5%时,1,2-戊二醇选择性和收率分别提高至45.6%与45.3%。并且Ru负载量在0.5%~2.5%时,1,2-戊二醇选择性随着Ru负载量的增加,呈现出近似线性的增长规律,说明Ru负载量是影响1,2-戊二醇选择性的关键因素。进一步增加活性组分Ru的负载量,糠醇转化率与1,2-戊二醇选择性无明显变化。
因此,当Ru负载量为2.5%时,催化剂的活性与目标产物1,2-戊二醇的选择性与收率达到了最优值,后续实验内容以该催化剂展开。
2.4 工艺条件优化
2.4.1 反应溶剂及糠醇溶液浓度
选取四氢糠醇、四氢呋喃、水、乙醇作为溶剂,探究溶剂对催化剂催化活性的影响,并选取无溶剂的纯糠醇溶液作为对照组,结果如表5所示。
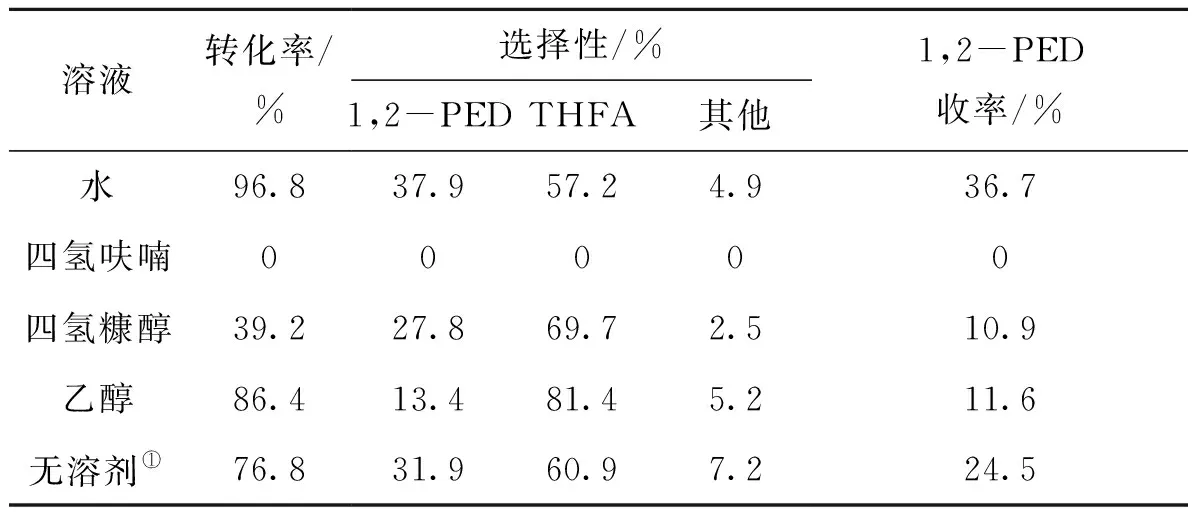
表5 溶剂对催化剂催化活性的影响Table 5 Effect of solvent on the catalytic activity
由表5可以看出,水作为溶剂时,与无溶剂对比,糠醇转化率有明显提升,1,2-戊二醇选择性提高6 个百分点,说明水作为溶剂可以提升糠醇催化氢解的反应速率,同时水的加入可促进糠醇的开环反应,提高1,2-戊二醇选择性;四氢呋喃作为溶剂时糠醇没有发生反应;四氢糠醇作为溶剂时,1,2-戊二醇收率与选择性均有较大幅度下降;乙醇作为溶剂时,糠醇转化率达到了86.4%,但1,2-戊二醇收率与选择性分别只有11.6%和13.4%,主要产物为四氢糠醇,说明乙醇的加入抑制了呋喃开环效应,增强了催化剂的呋喃环加氢作用。
实验证实水具有促进呋喃环开环的作用,进一步探究了糠醇溶液中水含量对催化剂活性的影响,结果如表6所示。
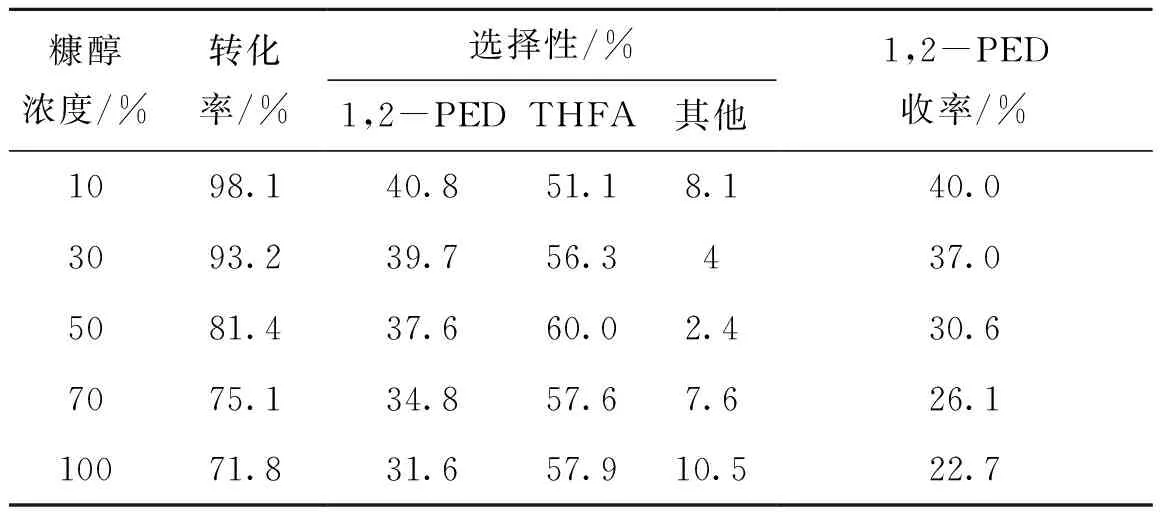
表6 糠醇溶液浓度对催化剂活性的影响Table 6 Effect of furfuryl alcohol concentration on the catalytic activity
由表6可以看出,随着溶剂水的减少,糠醇转化率与1,2-戊二醇收率均逐渐降低,但延长反应时间,糠醇依然继续发生氢解反应。说明随着溶剂的减少,反应速率在逐渐下降,糠醇完全氢解需要的反应时间增加,故以高纯度糠醇为原料时,可以通过延长反应时间来提升糠醇转化率,但1,2-戊二醇收率随着选择性降低而下降。
2.4.2 催化剂还原温度
在(170~250) ℃温度区间考察催化剂还原温度对催化活性的影响,结果如表7所示。从表7可以看出,随着还原温度的上升,催化剂活性呈现出先增加后减少的趋势,当催化剂还原温度为200 ℃时,糠醇转化率为96.6%,1,2-戊二醇选择性为38.9%,均为还原温度区间内的最大值,进一步升温,糠醇转化率与1,2-戊二醇选择性逐渐下降,但下降幅度较小。
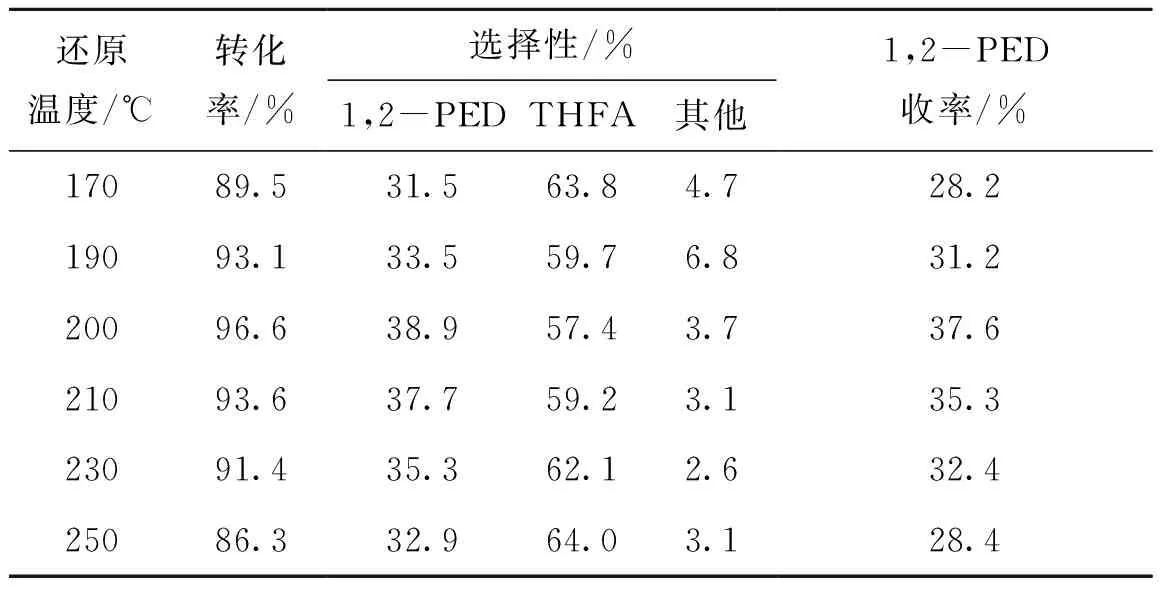
表7 催化剂还原温度对催化活性的影响Table 7 Effect of catalyst reduction temperature on the catalytic activity
2.4.3 反应温度
在(100~250) ℃温度区间考察反应温度对催化剂活性的影响,结果如图7所示。从图7可以看出,随着反应温度的升高,糠醇转化率逐步提升,反应温度低于150 ℃时,糠醇转化率上升速率较快,说明在此温度区间内,反应温度是影响催化剂活性的关键因素。当反应温度达到150 ℃后,转化率上升速度放缓,说明此时反应温度已不是催化剂活性的决定因素。反应温度达到230 ℃时,糠醇转化率达到最大值100%并趋于稳定。主要副产物四氢糠醇选择性随着温度的上升而近似线性下降(160 ℃时数据点与变化曲线偏离较远,可以考虑为实验误差)。1,2-戊二醇选择性随着反应温度升高先升高后下降。在反应温度为150 ℃时,1,2-戊二醇选择性达到最高为38.7%,这是因为随着温度的上升,糠醇氢解速率加快,反应速率加快,更多的生成了除1,2-戊二醇和四氢糠醇以外的副产物,导致1,2-戊二醇选择性快速下降。因此,确定150 ℃为优选后的反应温度,此时糠醇转化率达到96.8%,1,2-戊二醇选择性为38.7%,四氢糠醇选择性为55.3%,反应产生的副产物较少。
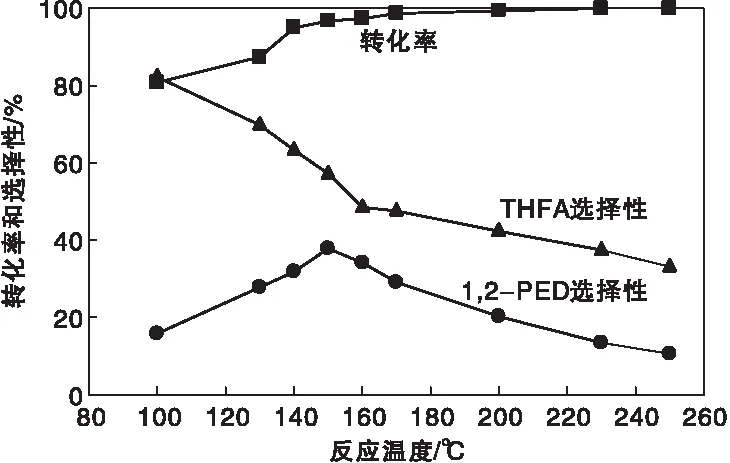
图7 反应温度对催化剂活性的影响Figure 7 Effect of reaction temperature on the catalyst activity
2.4.4 反应压力
在H2压力(1.0~2.5) MPa范围内,考察了其对催化剂活性的影响,结果见图8。由图8可知,压力对1,2-戊二醇选择性、糠醇转化率以及四氢糠醇选择性影响较大。糠醇转化率与主要副产物四氢糠醇选择性随着H2压力的增大而提高,1,2-戊二醇选择性则随着压力的增大呈现出先上升后下降的趋势,1,2-戊二醇选择性在2 MPa时达到最大值38.7%。继续升高压力,1,2-戊二醇选择性开始下降,可能由于高反应压力会促进糠醇的氢解开环反应,同样也促进呋喃环的加氢反应。因此,高温与低压的反应条件有利于糠醇氢解生成1,2-戊二醇。较低的氢气压力使得氢气在液相中的平衡分压降低,较高的反应温度也可达到同样效果,而高压会导致糠醇加氢生成四氢糠醇。
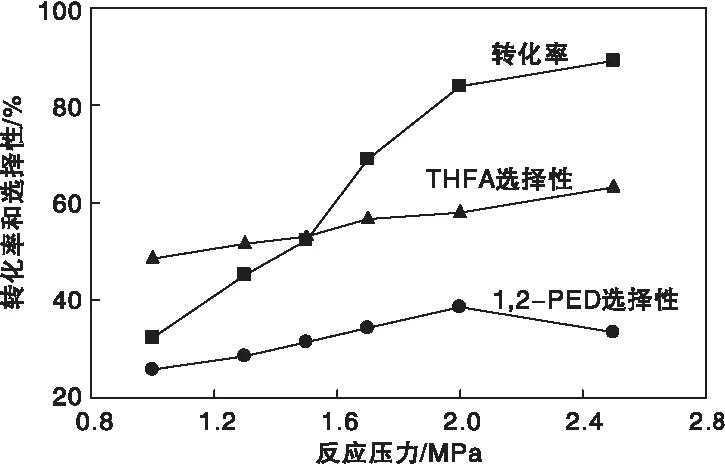
图8 反应压力对催化剂活性的影响Figure 8 Effect of reaction pressure on the catalytic activity
2.4.5 反应时间
反应时间对催化剂活性的影响见图9。从图9可以看出,糠醇转化率随着反应时间的增加而逐渐增加,当反应时间达到10 h时,糠醇转化率达到峰值并趋于稳定。四氢糠醇与1,2-戊二醇选择性随着反应时间的增加无明显变化,说明反应时间不是催化产物选择性的关键影响因素。在反应过程中检测发现了1-羟基-2-戊酮的存在,但当反应时间达到10 h,糠醇转化率趋于稳定后,最终产物中并没有检测到1-羟基-2-戊酮的存在,考虑为糠醇氢解生成1,2-戊二醇的氢化中间体。
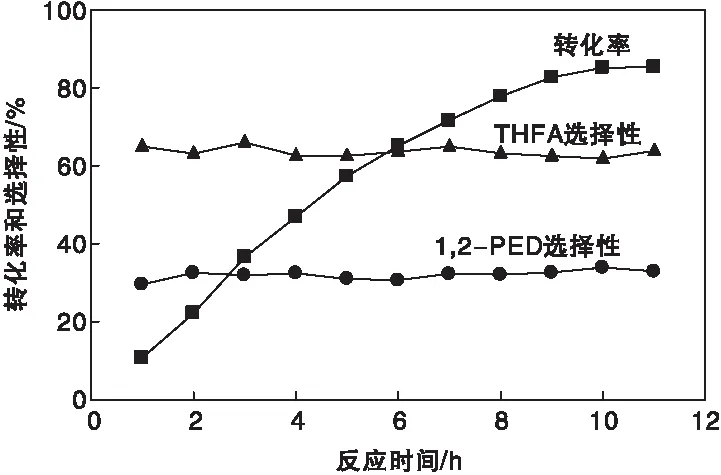
图9 反应时间对催化剂活性的影响Figure 9 Effect of reaction time on the catalytic activity
2.5 催化剂使用寿命
反应后通过离心分离催化剂,经洗涤后进行重复实验,结果如表8所示。
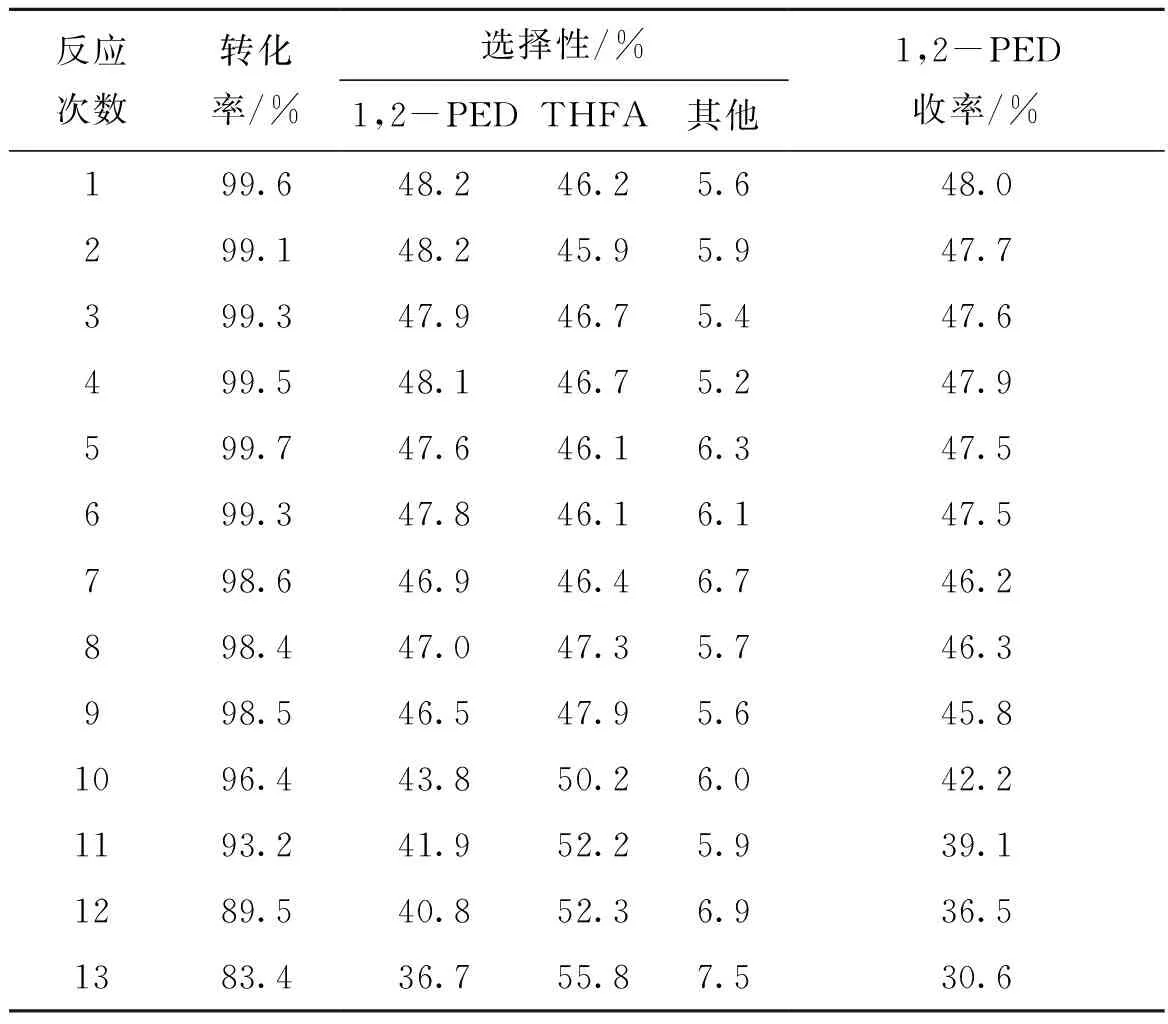
表8 催化剂重复使用性能Table 8 Results for repeated use of the catalysts
由表8可以看出,催化剂重复使用9次后,催化活性与1,2-戊二醇选择性无明显变化,可能由于MnOx与Ru的强相互作用,使得活性组分可以牢固结合在催化剂表面。但随着反应多次进行以及离心洗涤的作用,催化剂活性组分开始流失。活性组分含量对1,2-戊二醇与四氢糠醇选择性影响尤其明显,当反应次数达到10次时,1,2-戊二醇选择性开始明显下降,四氢糠醇选择性开始上升。并且随着反应次数的增加,1,2-戊二醇选择性下降速度开始变快,反应过程中更多的生成了四氢糠醇。当反应达到13次时,1,2-戊二醇选择性降低到了36.7%,四氢糠醇选择性上升到55.8%。综上,催化剂至少可重复使用11次。
2.6 催化剂失活原因分析
对新鲜和失活催化剂进行了XRD对比分析,结果如图10所示。从图10可以看出,新鲜催化剂表面为MnO2与Mn5O8的混合物,经还原后MnOx被还原为MnO。催化剂中MnOx晶相发生变化的原因可能为糠醇溶液中含有大量的不饱和键,这些不饱和键在加氢反应时表现出氧化性,将MnO氧化为Mn3O4,另一个可能的原因为催化剂在回收使用过程中需要经历洗涤、干燥等步骤,造成催化剂中的MnO被空气氧化生成Mn3O4。
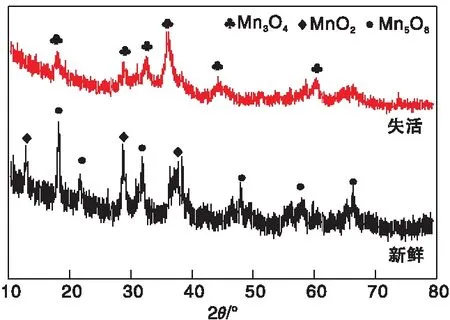
图10 新鲜与失活催化剂XRD图Figure 10 XRD patterns for deactivated and fresh catalysts
在金属催化的加氢和氢解反应中,溶剂为1,4-二戊烷时,甘油或四氢糠醇在Rh-ReOx/SiO2催化剂催化作用下氢解反应速率比水溶剂中低得多,可能的原因是载体ReOx与水作用形成了Re-OH,Ru/Mn-Al催化剂与其具有相似性质[93]。对于新鲜催化剂Ru/Mn-Al,从XRD中观察到MnO2与Mn5O8。MnOx在被H2还原后形成Mn(+2)O,在液相反应过程中与糠醇水溶液接触,Mn(+2)O可以与水发生反应转化为Mn(OH)2,这是一种八面体簇边缘共享构成的层状结晶材料。Mn-OH在Ru/Mn-Al催化剂中可能是某些物种的活性位点,因为Rh-ReOx催化剂中的Re-OH可促进四氢糠醇通过与氢氧化物相互作用而氢解。其他可能的解释则是水质子(H+)有利于金属-碳键通过还原得到消除。产物的吸附中间体在金属活性位点以Ru-CxHyOz形式,在H+存在条件下,吸附速率可能会提高。
对新鲜和失活后的催化剂进行元素组成与比表面积的分析可知(表9),失活催化剂活性组分部分流失,主要原因在于催化剂在反应过程中是气固液三相反应,反应时快速的搅拌使得液相溶液与催化剂表面的接触更加频繁,导致活性组分由催化剂表面脱落。另一个原因是催化剂在回收利用的过程中活性组分流失,造成活性组分溶解在产物中。
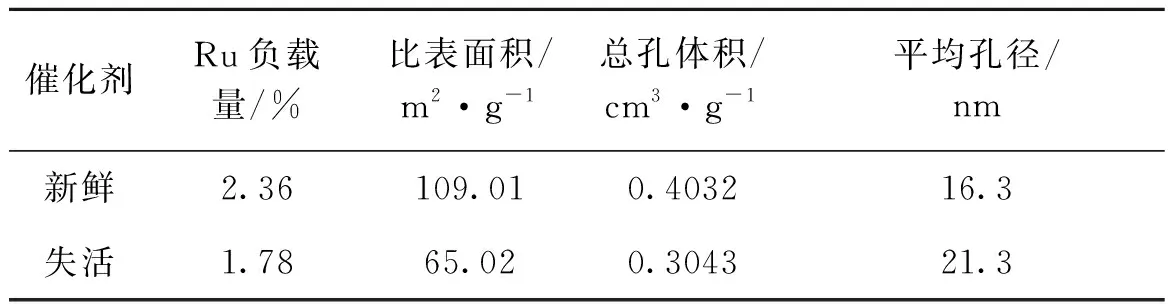
表9 新鲜和失活催化剂Ru负载量、比表面积和孔结构数据Table 9 Ru loading,surface area and pore structure of fresh and deactivated catalysts
与新鲜催化剂相比,失活催化剂比表面积下降幅度较大,主要原因是催化剂在反应过程中,表面的孔道被反应中的有机物或者积碳堵塞所致,堵塞的孔道导致反应物糠醇无法与催化剂活性中心Ru充分接触,因此造成催化剂活性一定程度的下降。催化剂活性组分Ru经过多次高温反应后,在催化剂表面出现了团聚现象,催化剂活性组分颗粒大小与催化剂活性直接相关。因此,催化剂失活的原因之一是Ru在催化剂表面的团聚。
分别考察了失活催化剂在空气及氮气氛下的热失重情况,结果见图11。对比DTG曲线可以看出,催化剂在空气环境中时在260 ℃与430 ℃时分别有一个较大的失重峰,但在N2环境中时只有480 ℃一个较大的失重峰。说明430 ℃的失重峰与气氛的种类没有关系,原因是催化剂表面附着的有机物质量损失,这与TG曲线相互印证。260 ℃时的失重峰是由于碳在催化剂表面沉积而造成的。这说明催化剂表面的积碳沉积也是催化剂失活的其中一个原因。
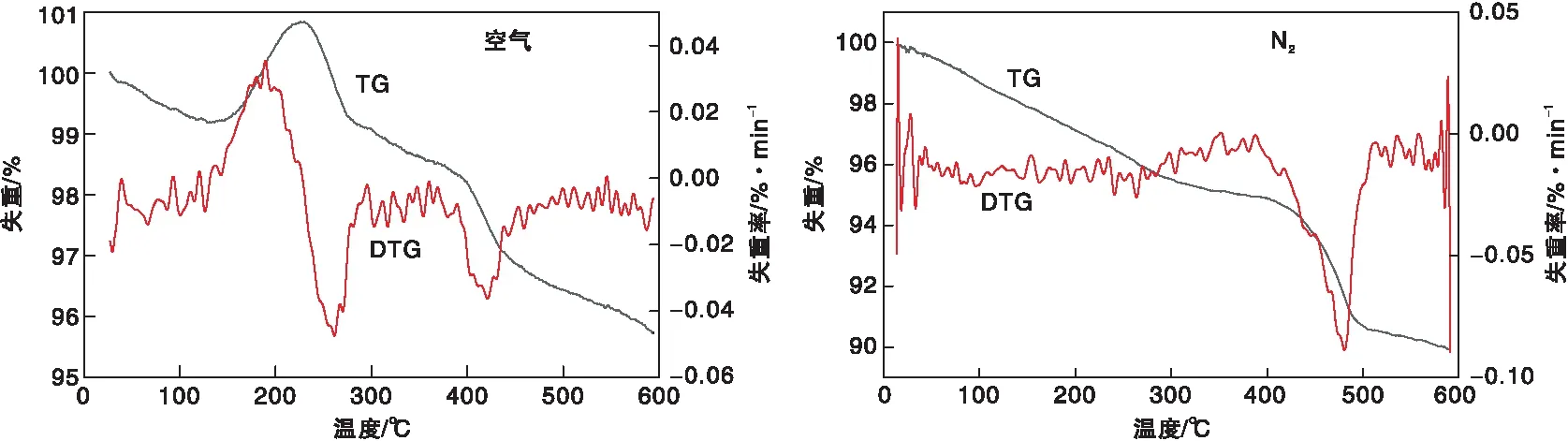
图11 失活催化剂空气和氮气气氛中热重分析Figure 11 TG analysis of deactivated catalysts in empty and N2 atmosphere
2.7 催化剂在高浓度糠醇溶液下催化活性
为进一步探究该反应体系的工业化可行性,以纯糠醇溶液为反应物进行了实验。在实验过程中发现,每30 min H2压力会降低0.5 MPa,导致在反应过程中H2压力无法维持稳定,从而影响实验数据的准确性。因此,在高浓度糠醇的反应条件下,低浓度糠醇反应得出的反应时间已经不适用。图12为糠醇加氢转化率和选择性随反应时间变化曲线。
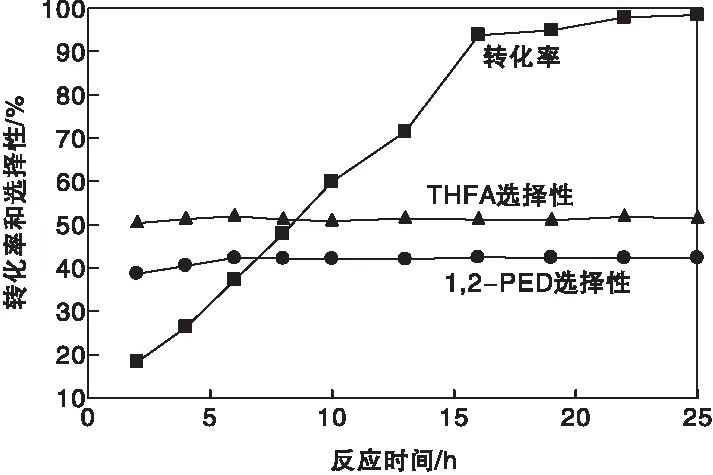
图12 纯糠醇加氢转化率和选择性随反应时间变化曲线Figure 12 Pure furfuryl alcohol hydrogenation conversion and selectivity vs.reaction time
由图12可以看出,反应时间为10 h时,糠醇转化率为59.9%,随着反应时间进一步增加,糠醇转化率继续提升。反应时间在(0~19) h内,糠醇转化率增长较快。原因是使用连续加氢的方式后,能够有效保证反应过程中H2的充足供应。当反应时间达到19 h后,糠醇转化率增长速度放缓,并且在反应时间为22 h时,糠醇转化率达到最高值,此时糠醇转化率为98.4%。1,2-戊二醇与四氢糠醇选择性随着反应时间增加无明显变化。反应时间为22 h时,1,2-戊二醇选择性为42.3%,四氢糠醇选择性为51.4%。1,2-戊二醇选择性与低浓度糠醇加氢反应选择性相比降低了6个百分点。催化剂在高浓度糠醇的加氢反应中依然保持了较高的催化活性与目标产物选择性。因此,纯糠醇溶液加氢适宜的反应时间为22 h。
在相同的反应条件下,考察了催化剂用量对催化活性的影响,结果见图13。从图13可以看出,糠醇转化率随着催化剂用量的增加而上升,随后趋于稳定。当催化剂用量在(1~4) g时,糠醇转化率随着催化剂用量的增加而增加,说明催化剂用量在一定条件下是影响糠醇转化率的主要因素。在催化剂用量为4 g时,糠醇转化率达到最大值98.7%。目标产物1,2-戊二醇选择性随着催化剂用量的增加无明显变化,始终维持在41%左右。

图13 催化剂用量对催化活性的影响Figure 13 Effect of catalyst dosage on the catalytic activity
对纯糠醇溶液加氢反应中催化剂重复使用性能进行考察,结果见图14。由图14可知,当催化剂使用次数在7次以内时,催化剂能够保持较高的催化活性与选择性,糠醇转化率为98.5%左右,1,2-戊二醇选择性为42.3%左右。催化剂使用8次时,催化剂活性与选择性都有一定程度的下降,糠醇转化率下降到了93.4%,1,2-戊二醇选择性降至37.2%。并且随着反应次数的增加,催化剂活性下降速度也逐渐加快。
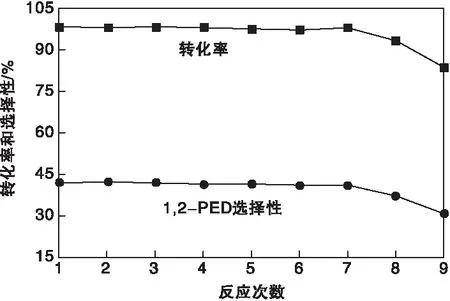
图14 催化剂重复使用性能Figure 14 Repeatibility of the catalysts
3 结 论
(1)针对糠醇催化加氢制1,2-戊二醇反应开发了Mn-Al二元复合载体负载型Ru催化剂。Al2O3可以有效提升载体比表面积,同时确保催化剂表面MnOx的高含量,从而有效提升催化剂活性与选择性。
(2)在10%糠醇(质量分数)溶液中,以Ru/Mn0.67Al0.33为催化剂,在反应压力2 MPa、温度150 ℃和反应时间10 h的条件下,糠醇转化率达到99.6%,1,2-戊二醇选择性达到48.2%,1,2-戊二醇收率达到48.0%。催化剂可重复使用11次。
(3)在无溶剂体系中,当催化剂与糠醇质量比为1∶25,反应22 h时,糠醇转化率达到98.5%,1,2-戊二醇选择性为42.3%。催化剂至少可重复使用7次。
(4)本研究对1,2-戊二醇工业化制备新工艺的开发具有较好的借鉴意义。后续研究内容将围绕产物分离及技术经济分析展开,逐步向工业化生产推进。
