复发/难治DLBCL 患者继发CNS 侵犯的临床特征及泽布替尼联合化疗方案的疗效
2022-07-11石磊王亚丽孙恺陆敏秋高珊褚彬王宇彤鲍立
石磊,王亚丽,孙恺,陆敏秋,高珊,褚彬,王宇彤,鲍立
1 北京积水潭医院血液科,北京 100096;2 北京天坛医院神经肿瘤综合治疗病区
弥漫大B细胞淋巴瘤(DLBCL)继发中枢神经系统(CNS)侵犯是一种罕见的难治性疾病,为区别于原发中枢神经系统淋巴瘤(PCNSL),将其归类于继发中枢神经系统淋巴瘤(SCNSL)。针对复发的中枢神经系统淋巴瘤患者,尚无统一的推荐治疗。而传统方案疗效有限,完全缓解(CR)率低,预后差,生存期短,是进一步提高DLBCL 治愈率的瓶颈,亟需创新治疗方案。基于遗传学特点对DLBCL 进行合理区分亚型,指导临床精准治疗,是当今淋巴瘤诊治的热点话题之一。近年,根据DLBCL 分子生物学特征,新提出了DLBCL 的分子分型,包括MCD 型、BN2型、N1 型以及EZB 型4 种基因亚型[1]。已有研究证明,SCNSL 中具有MYD88L265P 和CD79B 共突变的MCD 基因亚型的DLBCL 占比较高,其存在B 细胞抗原受体(BCR)信号通路突变,是布鲁顿氏酪氨酸激酶(BTK)抑制剂的精准分子治疗靶点。BTK 抑制剂是小分子药物,易穿透血脑屏障,其联合化疗方案是当前研究热点,或将成为未来治疗PCNSL 与SCNSL的重要方案。全球首款获批的第一代BTK 抑制剂伊布替尼联合用高剂量甲氨蝶呤(HD-MTX)和利妥昔单抗治疗复发或难治性PCNSL 的Ⅰ期研究,客观缓解率为80%,中位无进展生存时间9.2个月[2]。而新一代BTK 抑制剂泽布替尼血脑屏障透过率高于其他BTK 抑制剂。泽布替尼联合其他药物治疗PCNSL 的CR 率高达81.8%,其中5 例复发的CNSL患者应答率为60%[3]。而泽布替尼联合传统化疗方案对DLBCL 继发CNS 侵犯的疗效尚无文献报道。本研究分析了4 例DLBCL 继发CNS 侵犯患者的临床特征,并观察泽布替尼联合化疗方案进行挽救性诱导治疗的效果及安全性。现报告如下。
1 资料与方法
1.1 临床资料 2021 年1 月—2022 年1 月,选择北京积水潭医院血液科及北京天坛医院神经肿瘤综合治疗病区收治的DLBCL患者4例,男2例、女2例,年龄48~69 岁。4 例患者初诊时均无CNS 累及的临床表现。诊断标准:病理诊断符合2017 年版造血及淋巴组织肿瘤WHO 分类中DLBCL 诊断标准,初诊时通过颅脑MRI、脑脊液检查排除CNS淋巴瘤累及;在DLBCL 患者存在典型的CNS 受累相关症状基础上,再获得影像学异常和(或)病理学检查证据明确SCNSL[4],诊断淋巴瘤CNS 复发。末次随访时间为2022年4月。本研究为回顾性研究,4例患者治疗前对本方案知情并签署知情同意书。
1.2 临床特征分析 分析患者初诊及复发时的临床特征。收集患者初诊资料,包括初诊累及部位、分期、中枢神经系统国际预后指数(CNS-IPI)评分、细胞起源(COO)分类、突变基因、分子生物学分型、复发前治疗方案、复发前最大疗效、至复发时间、是否首次复发。CNS-IPI评分4~6分为高危。COO分类:通过Hans模型根据肿瘤细胞起源分为生发中心(GCB)来源和非生发中心(non-GCB)来源。分子生物学亚型:分为非MCD 亚型和MCD 亚型(以MYD88L265P、CD79B 共突变为特征)。收集患者复发时的临床资料,包括患者复发部位、受累部位、复发诊断依据。
1.3 治疗方案 2 例采用泽布替尼+甲氨蝶呤(Z-MTX)方案治疗,具体为泽布替尼每次160 mg,2次/日,持续口服;甲氨蝶呤每次3 g,1次/日,第1日静脉输注;21天/周期。1例采用泽布替尼+利妥昔单抗+吉西他滨+顺铂+地塞米松(Z-R-GDP)方案治疗,具体为泽布替尼每次160 mg,2次/日,持续口服;利妥昔单抗每次375 mg/m2,1次/日,第1日静脉输注;吉西他滨每次1 g,1次/日,第2日静脉输注;顺铂每次100 mg,1次/日,第2日静脉输注;地塞米松每次20 mg,1次/日,第2~5日静脉输注;21天/周期。1例采用泽布替尼+利妥昔单抗+甲氨蝶呤(Z-R-MTX)方案治疗,具体为泽布替尼每次160 mg,2 次/日,持续口服;利妥昔单抗每次375 mg/m2,1 次/日,第1 日静脉输注;甲氨蝶呤每次3.5g/m2,1次/日,第2日静脉输注;21天/周期。
1.4 疗效评估 疗效评估内容包括CNS 淋巴瘤和外周。CNS参照原发中枢淋巴瘤的评估标准,通过颅脑加强MRI、眼底检查或脑脊液检查进行判定[5]。CR:颅脑MRI检查无对比增强,无需皮质类固醇激素治疗,眼科评估正常,脑脊液(CSF)检查阴性。不能确认的完全缓解:颅脑MRI无对比增强,需要任何剂量皮质类固醇激素治疗,眼科评估正常,CSF 检查阴性;颅脑MRI检查微小异常,需要任何剂量皮质类固醇激素治疗,眼科评估轻微视网膜色素上皮(RPE)异常,CSF检查阴性。部分缓解(PR):颅脑MRI 增强检查肿瘤减小50%,眼科评估轻微RPE 异常或正常,CSF检查阴性;颅脑MRI无对比增强,眼科评估玻璃体细胞或视网膜浸润减少,CSF 检查可疑阳性。疾病进展:颅脑MRI检查病变增大25%,眼科评估复发或新发眼病,CSF 检查复发或阳性;CNS 或全身任何新部位出现疾病。另外,通过PET-CT按照非霍奇金淋巴瘤Lugano缓解标准[6]进行外周评估。
1.5 毒性反应评估 按照常见不良反应评价标准(CTCAE)5.0 评估化疗相关毒性反应,血液学毒性和非血液学毒性分别进行评估。1 级:无症状或轻微;仅为临床或诊断所见;无需治疗。2 级:需要较小、局部或非侵入性治疗;与年龄相当的工具性日常生活活动受限。3 级:严重或具重要医学意义但不会立即危及生命;导致住院或者延长住院时间;致残;自理性日常生活活动受限。4 级:危及生命;需要紧急治疗。5 级:与AE 相关的死亡。本研究中出现4级及以上毒性反应停止治疗。
2 结果
2.1 初诊及复发时的临床特征
2.1.1 初诊时临床特征 见表1。

表1 4例患者初诊时的临床特征
2.1.2 复发时临床特征 患者1 复发部位脑实质,复发诊断依据CT、MRI、病理检查;患者2 复发部位脑实质,复发诊断依据CT、MRI;患者3 复发部位脑实质、眼,受累部位肾上腺,复发诊断依据CT、MRI、眼科检查;患者4 复发部位脑实质,受累部位淋巴结,复发诊断依据CT、MRI。患者1:CNS 复发时脑肿瘤组织的MYD88、CD79B 突变丰度较初诊骨组织比例高,TP53突变丰度提高成为优势克隆。MYD88(L265P)错义突变丰度初诊47.3%,复发时88.1%;CD79B(Y196C)错义突变丰度初诊24.5%,复发时43.4%;TP53(Y220C)错义突变丰度初诊23.5%,复发时82.8%;IGLL5(c. -198A>T)5'UTR 突变丰度初诊30.2%,复发时67.0%;IGLL5(A32V)错义突变丰度初诊12.8%,复发时25.3%;IGLL5(c. -198A>G)5'UTR 突变丰度初诊12.4%,复发时24.8%;ETV6(L116P)错义突变丰度初诊23.2%,复发时48.2%;ETV6(S9N)错义突变初诊未检出,复发时丰度37.6%;HIST1H1B(A123V)错义突变丰 度初诊17.2%,复发时未检出;BTG2(S22T)错义突变丰度初诊15.4%,复发时43.6%;PIM1(E124Lfs*77)移码缺失丰度初诊12.0%,复发时未检出。见图1。患者2、3因CNS复发时癫痫大发作、剧烈头痛、频繁呕吐等原因,未取得CNS 肿瘤组织进行第二代基因测序(NGS)检测。

图1 患者1初诊(骨组织)及CNS复发时(脑组织)NGS检测结果
2.2 疗效 4 例患者随访时间为4~5 个月,治疗5~7 个疗程,ORR 为100%,PR 1 例(患者4),CR 3 例(患者1~3);获得CR 的3 例达到最大疗效时间均为4 个疗程;末次随访,4 例患者均存活;1 例(患者4)PR 患者达到最大疗效2 个疗程后复发,余3 例(患者1~3)截至末次随访持续CR 无复发。
2.3 毒性反应 4 例患者治疗期间发生的毒性反应见表2。
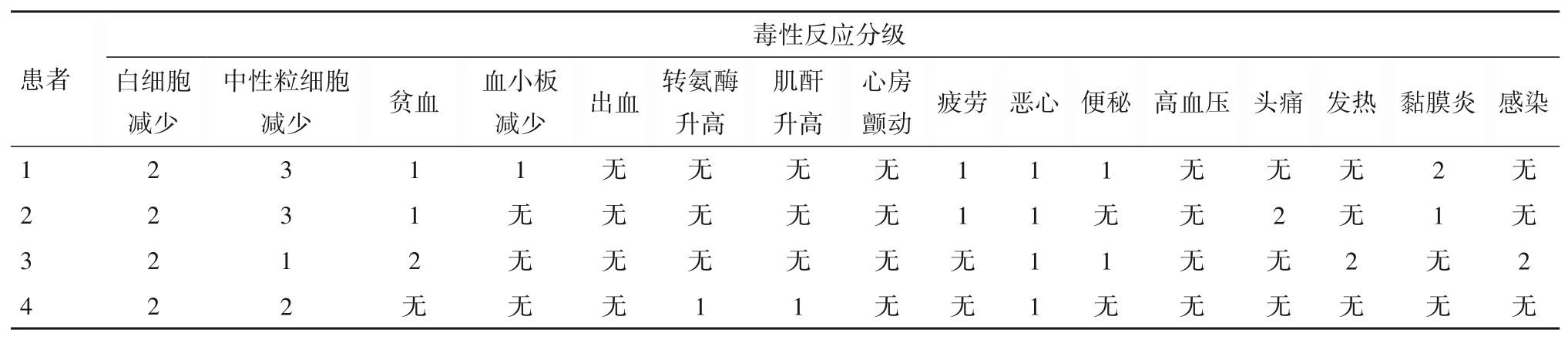
表2 4例患者治疗期间发生的毒性反应及分级
3 讨论
DLBCL 患者一旦出现CNS 侵犯,往往预后极差,严重缩短患者的OS。在利妥昔单抗治疗时代,DLBCL 患者从诊断淋巴瘤至出现CNS 侵犯的中位时间约为9个月,其中80%发生在一线治疗结束后,且多是在疾病首次复发时[7]。其中52%~68%患者仅累及CNS,而无系统性侵犯;同时继发CNS侵犯时50%~60%患者的累及部位仅为脑实质受累[7]。本研究的4 例患者有2 例仅存在CNS 侵犯,3 例CNS 侵犯仅为脑实质受累。DLBCL 继发CNS 侵犯的高危因素包括临床指标高危因素和分子生物学指标高危因素,前者以CNS-IPI 为代表,后者以COO 分型和DLBCL 新基因分型为代表。CNS-IPI 可重复性好,且所包含的是临床常见指标,可操作性强[8]。后者以COO 分型和肿瘤基因突变检测为代表。研究表明,CNS-IPI 高危组、活化B 细胞(ABC)亚型以及COO 未分型这3 个危险因素和DLBCL 的CNS 侵犯高风险有关[9]。淋巴瘤肿瘤组织免疫组织化学检测Hans 模型定义的non-GCB 类型的DLBCL 与COO 分型中的ABC 亚型和COO 未分型亚型的总和基本相符,为DLBCL 继发CNS 侵犯的高危因素。虽然non-GCB 来源的DLBCL 更易存在中枢神经系统的侵犯,但有文献报道,CD79B 和MYD88 L265P 在37%的PCNSL 的DLBCL 患者中同时突变,显著高于以COO分类的ABC 型DLBCL[10],也是DLBCL 患者CNS 侵犯的重要指标。本研究4例患者中的3例为CNS-IPI高危;排除1 例初诊未进行COO 及分子亚型检测的患者,其余3 例中全部为non-GCB 类型,2 例为MCD亚型。值得关注的是,本研究观察到MCD 亚型DLBCL 复发时CNS 病灶与初诊时CNS 外病灶的NGS检测对比,MYD88、CD79B 及TP53 突变丰度均较初诊时增高,这可能是导致以CNSL 为表现复发患者预后差的原因。
目前,美国国立综合癌症网络(NCCN)指南及欧洲肿瘤内科学会(ESMO)指南均指出,预防DLBCL患者发生CNS的有效方法尚未明确。NCCN指南推荐的CNS 预防策略包括4~8 次鞘内注射(IT)MTX 和(或)阿糖胞苷,或HD-MTX(3.0~3.5 g/m2静脉输注)。ESMO 指南指出IT 可能不是最佳的CNS 预防方式,HD-MTX 可能有效[11]。最新研究发现,HD-MTX 预防DLBCL 患者CNS 复发的效果不佳[12]。因此,以HD-MTX为主的全身化疗预防策略,其作用尚存争议。DLBCL 患者继发CNS 侵犯部位以脑实质为主,进入到蛛网膜下腔的传统治疗药物对血脑屏障的穿透力较弱,多数临床研究结果也不支持IT具有保护性作用[13],故其在预防DLBCL患者继发CNS中的价值有限。
由于预防DLBCL 继发CNS 的有效方法尚不明确,故其治疗更为重要。治疗目前主要参考PCNSL,为以IT和HD-MTX为主的全身化疗;如同时伴发CNS 外系统性复发,还需兼顾CNS 外病灶的治疗[13]。2018年,新英格兰医学杂志发表了DLBCL 分子分型,包括MCD 型(以MYD88L265P 和CD79B 共突变为特征)、BN2 型(BCL-6 融合及NOTCH2 突变)、N1 型(NOTCH1 突变)以及EZB 型(以EZH2 突变和BCL-2 易位为特征)4 种基因亚型,约覆盖46.6%的DLBCL 患者[1],为DLBCL 及其继发CNS 侵犯分子水平的精准诊断及靶向治疗提供了理论基础。其中以CD79B 和MYD88 L265P 共突变为表现DLBCL 的MCD 分子亚型是SCNSL 常见基因分型,MCD 亚型与BCR 信号通道的持续激活密切相关[14],由于BTK 抑制剂能够抑制BCR 信号通路,故成为治疗SCNSL 的新选择,近年来成为淋巴瘤领域的研究热点。目前文献多集中在第一代BTK 抑制剂伊布替尼单药或联合HD-MTX/利妥昔单抗治疗[2,15]。新一代BTK 抑制剂泽布替尼血脑屏障透过率高于其他BTK 抑制剂,可达42.70%[3],但其对DLBCL 患者CNS 复发的治疗效果尚无文献报道。本研究中4 例患者ORR 达100%,CR 率75%,且达到CR 的患者截至末次随访仍持续CR 无复发。本研究结果初步证明,新一代BTK 抑制剂泽布替尼联合化疗方案挽救性诱导治疗SCNSL 特别是CNS 复发患者,有显著且持续的疗效,其主要毒性反应可控且低于第一代BTK抑制剂,值得进一步临床研究。需要强调的是,DLBCL 新基因分型并未覆盖全部DLBCL,某些新基因分型不能归类为亚型的DLBCL。如本研究病例2的NGS测序结果为BTG2、EBF1突变,泽布替尼联合化疗方案疗效显著,提示不仅MCD 亚型SCNSL 对BTK 抑制剂治疗反应好,某些新基因分型不能归类亚型的DLBCL也对BTK抑制剂治疗敏感。
有研究对第一代BTK 抑制剂伊布替尼的3~4级毒性反应进行荟萃分析,发现最常见的毒性反应是血液学毒性和感染。血液学毒性反应主要表现为血细胞减少,包括中性粒细胞减少、贫血和血小板减少,发生率为6%~8%;非血液学毒性反应的最高发生率是感染,为11%。同时还有部分患者出现心房颤动。北京协和医院用泽布替尼联合方案治疗13例CNSL 患者,最常见的毒性反应(>10%)是中性粒细胞减少症、血小板减少症、感染、恶心、呕吐、丙氨酸转氨酶异常和黏膜炎。3 级及以上的中性粒细胞减少发生率38.5%,3 级及以上的贫血发生率15.4%,3级及以上的血小板减少发生率7.7%,在非血液学毒性反应中有3 级及以上报道的为肾损伤、黏膜炎、疲劳[3]。本研究中4例患者的主要毒性反应是血液学毒性,3 级以上的血液学毒性中性粒细胞减少发生率为50%,贫血发生率为25%,未观察到3级以上的非血液学毒性。总体毒性反应可以接受,患者耐受性良好。
综上所述,DLBCL 继发CNS 侵犯多为non-GCB来源及MCD 亚型,主要侵犯脑实质,可不合并系统性复发。含新一代BTK 抑制剂泽布替尼的联合化疗方案是DLBCL 继发CNS 侵犯患者的有效治疗方案;其反应率高,患者耐受性良好。基于DLBCL 继发CNS 侵犯是一种相对罕见的难治性疾病,本研究病例数少,随访时间较短,仍需要增加样本进一步验证该治疗方案的疗效及安全性。
