亚砷酸钠对人肝星状细胞活化的影响及机制
2022-07-11李昂黄菲迪丽娜尔亚尔麦麦提丁关鑫日沙来提塔依尔吴顺华
李昂,黄菲,迪丽娜尔·亚尔麦麦提,丁关鑫,日沙来提·塔依尔,吴顺华
1 新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室,乌鲁木齐 830011;
2 新疆医科大学公共卫生学院流行病与卫生统计学教研室
砷是一种广泛存在于水、土壤等环境介质中的有毒类金属。无机砷(iAs)是Ⅰ类致癌物。除职业暴露外,长期饮用高浓度iAs 污染的地下水是人体高砷暴露的主要途径[1]。iAs 可对人和动物均产生毒害作用,长期接触iAs 会导致皮肤损伤、神经损伤、糖尿病、血液循环系统病变、肝损伤和癌症等多种疾病[2-3]。肝脏是砷代谢的主要靶器官。长期接触iAs 可使肝纤维化、肝硬化,最终导致肝脏发生癌变。肝纤维化是可逆的病理过程,抑制肝星状细胞活化是治疗肝纤维化以及预防肝癌发生的有效策略。iAs 诱发肝癌的机制与氧化应激、DNA 和染色体损伤、凋亡、坏死、甲基化等有关。然而,其确切致癌机制尚不明了。研究发现,细胞自噬在砷致癌的机制中起重要作用。自噬是一种通过降解蛋白质和细胞器,获得维持生存所必需营养物质,参与物质能量循环的过程[4]。iAs 暴露可诱导细胞自噬,但其机制尚未完全阐明。自噬是肝脏疾病发生发展的潜在机制[5]。因此,调节自噬或可成为治疗肝脏疾病的新方向之一。在正常肝组织中星状细胞处于静止状态,不表达α-平滑肌肌动蛋白(α-SMA)。2021 年8月—2022 年3 月,本研究以人肝星状细胞(LX-2 细胞)为研究对象,探讨亚砷酸钠(NaAsO2)对LX-2 细胞自噬的影响及机制。
1 材料与方法
1.1 细胞、试剂及仪器 LX-2 细胞(中国武汉普诺赛生命科技有限公司),具有短串联重复序列鉴定报告。NaAsO2(中国北京化学试剂三厂),胎牛血清、DMEM 高糖培养基(美国Hyclone 公司),Western Breeze 化学发光蛋白印迹检测试剂盒、RIPA 裂解液、4×蛋白上样缓冲液、SDS-PAGE 凝胶制备试剂盒、碱性磷酸酯酶显色试剂盒(中国北京索莱宝科技有限公司),α-SMA、蛋白激酶B(AKT)、发状分裂相关增强子1(Hes1)、雷帕霉素靶蛋白(mTOR)、GAPDH 抗体(英国Abcam 公司)。超净工作台(中国江苏苏净集团有限公司)、凝胶成像分析系统、Western blotting 电泳装置及转膜装置(美国Bio-Rad 公司)、酶联免疫检测仪(赛默飞世尔科技公司)。
1.2 细胞培养 采用含10%胎牛血清、双抗的高糖培养基,在5%CO2、37 ℃条件下培养细胞。细胞隔2 天换1 次液,待细胞融合度达80%时,用0.25%胰酶消化收集细胞,依照1∶2 进行传代培养,收集生长状况良好且处于对数生长期的细胞进行后续试验。
1.3 NaAsO2实验染毒浓度筛选 采用MTT 法。取对数生长期LX-2 细胞,用胰酶消化,1 000 r/min 离心5 min(离心半径13.5cm),弃上清液,加入5 mL完全培养基制备细胞悬液,将细胞悬液用完全培养基稀释(5×104个/mL),将100 μL 细胞悬液接种于96孔板,每孔细胞密度5×104个/mL,每组设置3 个复孔,放入37 ℃培养箱中孵育24 h后,弃上清液,依次在各个实验孔内加入浓度为0、5、15、20、30、40、50 μmol/L的NaAsO2培养液(每孔10 μL),同时设定空白组(无细胞,只有培养基)、对照(正常细胞加完全培养基);置于培养箱内作用48 h后,除空白组外,向每孔中加入稀释的MTT 溶液(每孔10 μL),培养箱中培养4 h 后取出,1 500 r/min 离心10 min(离心半径13.5 cm),吸去上清后除空白孔外每孔加入150 μL DMSO,用锡箔纸包裹后置于摇床上孵育10 min,放入酶标仪中,振荡3 min,测定波长490 nm处OD 值,并计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组OD 值/对照组OD 值)×100%。通过细胞增殖抑制率和染砷浓度计算细胞半数抑制浓度(IC50)。根据IC50筛选NaAsO2实验浓度。
1.4 细胞自噬变化观察 采用透射电子显微镜。将细胞随机分为四组,对照组及NaAsO2低、中、高浓度组,分别用0、5、10、15 μmol/L的NaAsO2干预48 h,取各组细胞用胰酶消化后收集细胞,PBS溶液漂洗3遍,去掉PBS 溶液,加入0.5 mL 戊二醛,转移到
1.5 mL离心管中。2 000 r/min离心5 min(离心半径13.5 cm),4 ℃冰箱保存。经包埋、超薄切片(厚度70 nm)、电子染色电镜(×40 000)下观察,调整放大倍数确定视野内出现自噬小体。
1.5 细胞活化蛋白(α-SMA)及自噬蛋白(AKT、Hes1、mTOR)表达检测 采用Western blotting 法。干预48 h,取各组细胞,用裂解液提取各组细胞总蛋白,聚氰基丙烯酸正丁酯法测定蛋白浓度,取相同质量的蛋白上样,经SDS-PAGE 转移至聚偏二氟乙烯膜,用Western Breeze 试剂盒中的封闭液室温封闭30 min,α-SMA一抗(稀释比例1∶5 000)、AKT一抗(稀释比例1∶10 000、Hes1一抗(稀释比例1∶1 000)、mTOR一抗(稀释比例1∶10 000)、内参GAPDH(稀释比例1∶10 000),4 ℃摇床孵育过夜,抗体洗液漂洗3 次,二抗室温孵育30 min,抗体洗液漂洗3 次,碱性磷酸酯酶显色试剂盒显影。用Image Lab 软件读取显影各条带的灰度值,目的蛋白的表达量=目的蛋白灰度值/内参灰度值。
1.6 统计学方法 采用SPSS22.0 统计软件。符合正态分布计量资料用±s表示,多组间比较采用单因素方差分析,两两比较采用LSD 法。P<0.05 为差异有统计学意义。
2 结果
2.1 NaAsO2染毒浓度筛选结果 经5、15、20、30、40、50 μmol/L 的NaAsO2处理48 h,LX-2 细胞OD 值分别为1.29±0.06、0.75±0.09、0.93±0.10、0.61±0.02、0.57±0.06、0.47±0.07,细胞增殖抑制率分别为8.13%、46.14%、33.90%、56.66%、58.82%、66.52%。对照细胞OD 值为1.45±0.01。随着Na-AsO2染毒浓度的增加,细胞增殖抑制率逐渐升高(P<0.05)。IC50为26.46 μmol/L,以IC50及细胞活性为参照选择5、10、15 μmol/L为实验所需浓度。
2.2 NaAsO2对LX-2细胞自噬的影响 对照组可观察到自噬小体、自噬溶酶体。与对照组相比,NaAsO2低、中、高浓度组细胞间隙逐渐增宽,观察到“假狄氏间隙”,自噬小体数量增加,脂滴的分布更加密集。可见部分线粒体肿胀、空泡化,大量线粒体嵴断裂,NaAsO2高浓度组以上变化最为明显。
2.3 NaAsO2对LX-2 细胞活化的影响 对照组及NaAsO2低、中、高浓度组α-SMA 蛋白相对表达量分别为0.13 ± 0.02、0.23 ± 0.04、0.32 ± 0.06、0.48 ±0.10。与对照组比较,NaAsO2低、中、高浓度组α-SMA蛋白相对表达量逐渐升高(P均<0.05)。
2.4 Na2AsO2对LX-2 细胞自噬相关蛋白表达的影响 与对照组比较,NaAsO2低、中、高浓度组AKT、mTOR 蛋白表达逐渐降低,Hes1蛋白表达逐渐升高(P均<0.05)。见表1。
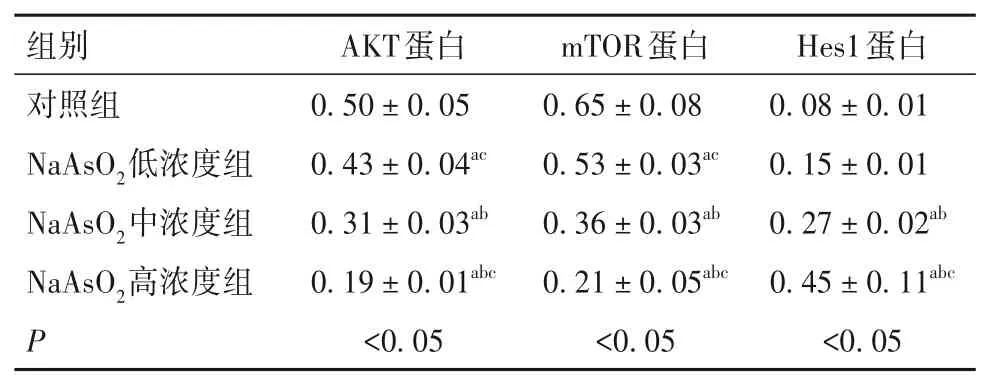
表1 各组细胞AKT、mTOR、Hes1蛋白表达比较(xˉ± s)
3 讨论
肝脏是砷代谢的主要靶器官[6]。iAs 摄入人体后,随着血液分配到肝脏,在肝细胞中不断积累,与巯基结合,形成稳定的复合物,从而影响细胞代谢。肝纤维化是慢性肝损伤后伤口持续愈合的可逆的病理过程。在肝纤维化过程中,处于静态的肝星状细胞不断被激活,并促进活化标志蛋白α-SMA 的表达,从而促进肝星状细胞向肌成纤维细胞转化,使细胞外基质分泌增加,改变肝脏组织结构[7]。本研究中,NaAsO2处理LX-2 细胞48 h,随着染毒浓度的增加α-SMA 表达逐渐升高。可见NaAsO2可促进人肝星状细胞活化。
研究发现,细胞自噬参与肝纤维化形成的过程[5]。细胞自噬是吞噬自身细胞质蛋白或受损细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,借此实现细胞内稳态和受损细胞器的更新的过程[8]。研究表明,当细胞处于饥饿状态或受到某种刺激时,自噬通过溶酶体降解细胞质成分,使细胞在营养耗竭时维持能量稳态[9]。因此,在本研究中,NaAsO2染毒LX-2 细胞48 h,通过透射电镜观察到圆形双层膜包裹着被降解的各种物质的小体即自噬小体,证明了NaAsO2干预下LX-2 细胞发生自噬。研究表明,肝炎、肝脂肪变性、纤维化、肝硬化和肝细胞癌等多种肝脏疾病可能以依赖于自噬的方式发生发展[10]。其中,肝纤维化作为可逆的病理阶段与自噬密切相关。研究认为,人肝星状细胞含有大量脂滴,细胞自噬可能促进脂滴分解成游离脂肪酸,为细胞外基质的激活和分泌提供了大量能量,进而促进肝纤维化[11]。研究发现,卡维地洛通过抑制自噬和促进LX-2细胞凋亡来减轻肝纤维化[12]。因此,自噬水平升高是肝细胞活化和肝纤维化的促进剂,减少自噬抑制肝细胞活化可能是治疗的靶点。本研究观察不同浓度NaAsO2处理LX-2 细胞后,自噬相关蛋白AKT、mTOR、Hes1表达的变化。
AKT 在细胞存活、增殖、分化、代谢和重组细胞骨架等多种细胞生命过程中起重要作用[13]。研究表明,AKT与自噬的发生密切相关。AKT被PI3K 活化后磷酸化,随之活化下游因子mTOR。mTOR是调节细胞蛋白质和脂质合成的关键细胞营养传感器[14],是调节自噬过程的主要因子。研究发现,奥曲肽通过抑制AKT/mTOR 通路,激活自噬并减轻脂多糖诱导的人肺上皮细胞损伤[15]。iAs 可通过抑制PI3K/AKT/mTOR 信号通路诱导自噬发生,使小鼠海马锥体神经元数量减少,神经元轴突变性,细胞萎缩[16]。因此AKT/mTOR 通路与自噬密切相关。本研究结果显示,与对照组比较,随着NaAsO2浓度的增高,AKT 和mTOR 蛋白表达显著降低。mTOR 是AKT 的重要下游信号节点,其高度保守,使营养、生长因子、应激等多种细胞外信号一起整合,参与细胞发育、细胞周期、生物代谢、自噬等众多生物过程。PI3K/AKT 信号通路作为一个成熟的mTOR 上游调节器,可通过激活mTOR 抑制自噬。研究表明,外泌体通过抑制mTOR,上调肾小管上皮细胞的自噬水平,减缓炎症作用,修复急性肾损伤[17]。在骨肉瘤中,iAs通过抑制AKT/mTOR 和激活ROS/JNK 信号通路诱导细胞凋亡和自噬[18]。因此,AKT/mTOR 对于自噬具有负调控作用。本研究结果提示,NaAsO2可能通过抑制AKT/mTOR激活来诱导LX-2细胞自噬。
Hes1 属于前神经元碱性螺旋-环-螺旋家族成员,在胚胎发育中影响细胞的增殖和分化[19]。研究表明,microRNA-30e通过Notch1/HES1/AKT信号通路调控自噬,从而保护心脏免受缺血和再灌注损伤[20]。本研究发现,与对照组相比,NaAsO2中、高浓度组Hes1 表达均显著升高。因此,随着NaAsO2浓度的升高Hes1 表达上调并可能影响AKT/mTOR 通路的调控。
综上所述,NaAsO2诱导LX-2活化与自噬密切相关,且随着NaAsO2浓度的升高作用增强。
