胃癌组织中miR-875-5p、USF2基因表达变化及其临床意义
2022-07-11王伟王聃王晓光
王伟,王聃,王晓光
1 唐山市中医医院普外科,河北唐山 063000;2 唐山市中医医院腔镜外科
胃癌为消化道常见恶性肿瘤,2020 年中国新发和死亡病例分别为47.9 万、37.4 万,占全球胃癌病例总数的43.99%、48.63%[1]。目前大多胃癌患者在诊断时已经处于进展期,且缺乏有效治疗手段,还需进一步了解胃癌发生发展的驱动因素。微小RNA(miRNA)是一类非编码小RNA,通过调控癌基因与抑癌基因参与肿瘤发生和进展[2]。miR-875-5p在肝细胞癌和食管鳞状细胞癌组织中异常表达,与癌细胞增殖、迁移和侵袭有关[3-4]。上游转录因子2(USF2)是一种多功能转录因子,能通过调节泛素-蛋白酶体途径(UPP)参与乳腺癌进展[5]。目前关于miR-875-5p、USF2 与胃癌患者临床病理特征和预后的关系尚不明确,本研究旨在分析胃癌组织中miR-875-5p、USF2 表达变化及其临床意义,以期为临床诊治提供参考。
1 资料与方法
1.1 临床资料 选取2015 年1 月—2017 年1 月唐山市中医医院收治的93 例胃癌患者,其中男64 例,女29 例;年龄41~78(60.85±7.36)岁;肿瘤直径≥5 cm 46 例,<5 cm 47 例;组织分化程度:低分化35例,中高分化58 例;TNM 分期[6]:Ⅰ期24 例、Ⅱ期27例、Ⅲ期26 例、Ⅳ期16 例;淋巴结转移45 例。纳入标准:①经术后病理检查确诊为胃癌;②初诊,入院前未接受抗肿瘤治疗;③接受姑息性或根治性手术;④病理特征和随访资料完整;⑤年龄≥18 岁;⑥患者及家属均知情同意。排除标准:①合并其他部位肿瘤;②全身感染性疾病;③既往胃部手术史;④合并严重心、肝、肾功能损害。本研究经医院伦理委员会批准。
1.2 胃癌组织及癌旁组织中miR-875-5p、USF2 mRNA 表达检测 采用定量RT-PCR。收集术中切除的癌组织及癌旁组织(距癌组织边缘>5 cm),置于液氮冷冻保存。取50 mg 组织液氮中研磨成末,加入TRIzol 试剂(北京索莱宝科技有限公司)提取组织中总RNA,TaKaRa 试剂盒(北京宝日医生物技术有限公司)转录合成cDNA,NaroDrop验证cDNA 浓度及纯度(OD260/OD280为1.8~2.0),使用定量RT-PCR 试剂盒(广州锐博生物技术有限公司)和定量RT-PCR 仪(赛默飞世尔科技有限公司)进行扩增。miR-875-5p上游引物:5'-GCCTCATGGAATACTGTTGAACC-3',下游引物:5′-GGATAGATCACTCTCTCACC-3';USF2 上 游 引 物:5'-AAAGGAGGGATCCTGTCCAA-3',下 游 引 物:5'-CAGGGCGTTCTCATTCTTCA-3';miR-875-5p内参U6上游引物:5'-AGAGCCTGTGGTGTCCG-3',下游引物:5'-CATCTTCAAAGCACTTCCCT-3′;USF2 内参GAPDH 上游引物:5'-GGGAAGGTGAAGGTCGGAGT-3',下游引物:5'-TTGAGGTCAATGAAGGGGTCA-3'。反 应 体 系共20 μL:SYBR Premix Ex Taq 10 μL、上游引物0.8 μL、下游引物0.8 μL、cDNA 模板2.0 μL、经DEPC 处理水6.4 μL。反应条件:95 ℃预变性30 s 循环1 次;95 ℃变性5 s、60 ℃退火30 s、72 ℃延伸15 s,循环40次。用2-ΔΔCt法计算组织中miR-875-5p、USF2 mRNA相对表达量。
1.3 随访 所有患者出院后通过门诊或电话方式随访,随访至2022 年1 月,统计术后5 年累积生存率,死亡或随访时间截至则研究结束。
1.4 统计学方法 采用SPSS27.0 统计软件。计数资料以例(%)表示,比较采用χ2检验;计量资料均呈正态分布以-x±s表示,组间比较采用t检验;用生物学网站http://www. targetscan. org/分析预测miR-875-5p 和USF2 间的相互作用位点;Pearson相关法分析胃癌组织中miR-875-5p 与USF2 mRNA表达的相关性;Kaplan-Meier 法绘制胃癌患者生存曲线,组间生存率比较采用Log-rank 检验;多因素Cox回归分析胃癌患者预后的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织及癌旁组织中miR-875-5p、USF2 mRNA 表达比较 胃癌组织中miR-875-5p 表达低于癌旁组织,USF2 mRNA表达高于癌旁组织(P均<0.05)。见表1。USF2 的3'-非翻译区595~601碱基处存在与miR-875-5p 潜在的结合位点。Pearson 相关分析显示,胃癌组织中miR-875-5p 与USF2 mRNA表达呈负相关(r=-0.710,P<0.05)。
表1 胃癌组织和癌旁组织中miR-875-5p、USF2 mRNA表达比较(±s)

表1 胃癌组织和癌旁组织中miR-875-5p、USF2 mRNA表达比较(±s)
?
2.2 miR-875-5p、USF2 mRNA 表达与胃癌患者临床病理特征的关系 miR-875-5p、USF2 mRNA 表达与胃癌分化程度、TNM 分期、淋巴结转移有关(P均<0.05)。见表2。

表2 miR-875-5p、USF2 mRNA表达与胃癌患者临床病理特征的关系
2.3 miR-875-5p、USF2 mRNA 表达与预后的关系随访5年,中位随访时间35个月,93例胃癌患者5年累积生存率为57.83%(48/83)。miR-875-5p高表达患者(≥0.903,n=50)、低表达患者(<0.903,n=43)5年累积生存率分别为60.00%(30/50)、41.86%(18/43);USF2 mRNA 高表达患者(≥2.606,n=45)、低表达患者(<2.606,n=48)5 年累积生存率分别为37.78%(17/45)、64.58%(31/48)。miR-875-5p 高表达患者累积生存率高于miR-875-5p 低表达患者,USF2 mRNA 高表达患者累积生存率低于USF2 mRNA 低表达患者(P均<0.05)。
2.4 miR-875-5p、USF2 mRNA 对胃癌患者预后的影响 以随访时间为时间变量,以表3单因素分析有差异因素为自变量,预后为因变量(死亡=1,存活=0),多因素Cox 回归分析显示,TNM 分期Ⅲ、Ⅳ期及淋巴结转移、USF2 mRNA≥2.606是胃癌患者死亡的独立危险因素,miR-875-5p≥0.903 是独立保护因素(P均<0.05)。见表3、4。
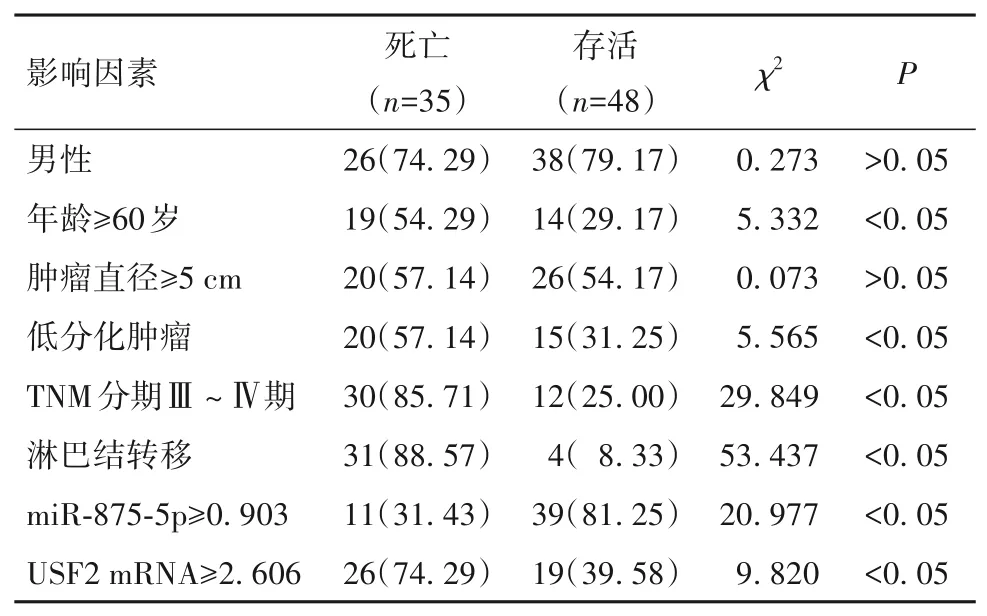
表3 胃癌患者预后影响因素的单因素分析
3 讨论
胃癌是起源于胃黏膜上皮的恶性肿瘤,以厌食、腹痛、饱腹感、消化不良、疲乏等为常见症状,但早期并无特异性症状,导致大多患者在确诊时已处于进展期,发生转移。我国70.8%的胃癌患者在确诊时已存在局部进展,晚期胃癌患者5 年累积生存率不足30%[7-8]。目前胃癌的治疗仍以手术为主,放化疗为辅,对晚期胃癌疗效较差。近年来以个体化精准化为特征的免疫和靶向治疗为胃癌治疗提供了新方向,但目前仍未达到满意效果,还需进一步了解其分子机制,对判断胃癌进展、评估预后、延长生存期具有重要意义。
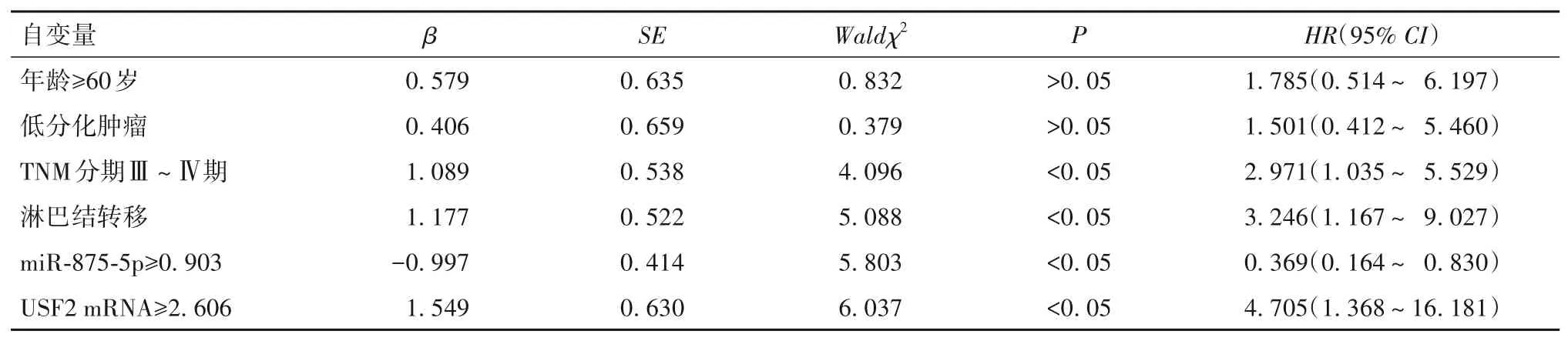
表4 胃癌患者预后影响因素的多因素Cox回归分析
人类基因组中,98%的蛋白质为不参与蛋白质编码的非编码RNA,共同组成了生物体细胞中复杂的RNA 调控网络,广泛参与肿瘤细胞各种生物学过程。miRNA 是一类内源性长18~25 个核苷酸的非编码RNA,通过与靶基因mRNA 的3'-非翻译区结合,负向调节靶基因表达,进而参与基因转录后水平调控,在肿瘤中发挥癌基因或抑癌基因功能[9]。如miR-3178 能通过抑制缺口受体1(Notch1)抑制胃癌细胞增殖、迁移和侵袭[10]。miR-875-5p 定位于人染色体8q22.2,近年多项研究均报道了其与恶性肿瘤的关系[11-12]。HE 等[11]研究报道,膀胱癌中miR-875-5p 表达上调,能通过抑制COP9 信号体7A 亚基促进癌细胞增殖。CHEN 等[12]研究报道,肝细胞癌中miR-875-5p 表达下调,能通过上调真核翻译起始因子3a 抑制癌细胞增殖、迁移、侵袭和上皮间质转化。上述研究表明,miR-875-5p 在不同肿瘤中作用不同。本研究结果显示,胃癌组织中miR-875-5p 表达降低,提示miR-875-5p 可能在胃癌发生发展中发挥作用。众所周知,癌细胞能通过促进增殖和抑制凋亡而无限增殖,进而促进肿瘤发展。本研究结果显示,胃癌组织中miR-875-5p 表达与分化程度、TNM 分期、淋巴结转移有关,进一步提示miR-875-5p 在胃癌中发挥抑癌基因作用,其机制可能与抑制Notch3 表达有关。Notch3 是一种经典癌基因,Notch3异常激活参与多种恶性肿瘤细胞增殖、分化、迁移等过程[13]。KANG 等[14]研究显示,Notch3 是胃癌中表达最失调的Notch,上调miR-875-5p 表达能靶向抑制Notch3 异常激活,并提升胃癌细胞对化疗的敏感性。本研究结果还显示,miR-875-5p 高表达患者术后5 年累积生存率升高,是胃癌患者预后的独立保护因素,说明miR-875-5p 或可成为胃癌患者预后评估指标。
UPP 是负责细胞内蛋白质降解的主要系统,在细胞基本细胞生命过程中发挥关键作用,目前研究表明,UPP是多种肿瘤相关调节异常的重要靶点,能通过其特殊的蛋白酶体裂解活性,上调或下调抑癌基因,参与肿瘤发生发展[15-16]。USF2 是“碱性-螺旋-环-螺旋-亮氨酸拉链”转录因子家族一员,定位于人染色体19q13.12,能以二聚体形式结合启动子中含有E-box DNA 序列的靶基因,进而调控靶基因表达。既往研究多报道USF2 与肾病的关系,如USF2 能通过下调血小板反应蛋白1,抑制转化生长因子β(TGF-β)/Smad 家庭成员3 信号通路改善急性肾损伤[17]。目前关于USF2 与癌症的研究报道较少,TGF-β 诱导的结直肠癌中,USF2 表达上调能通过诱导上皮-间质转化促进癌细胞迁移和侵袭[18],但关于USF2 参与结直肠癌进展的具体机制尚不明。研究表明,USF2 能通过调节Smad 泛素调节因子1(Smurf1)和Smurf2,调节UPP[19]。而UPP 是胃癌发生发展的关键途径之一[15-16]。因此推测USF2 可能在胃癌发生发展中发挥作用。本研究结果显示,胃癌组织中USF2 mRNA 表达升高,与分化程度、TNM分期、淋巴结转移有关,提示USF2 在胃癌中发挥促癌基因作用,其机制可能与USF2 能调节UPP 有关,但还需进一步明确其机制。本研究结果显示,USF2 mRNA 高表达患者术后5 年累积生存率降低,是胃癌患者预后的独立风险因素,说明miR-875-5p或可成为胃癌患者预后评估指标。本研究结果还显示,胃癌组织中miR-875-5p 与USF2 mRNA 表达呈负相关,生物学网站预测也发现USF2 可能是miR-875-5p 的靶基因,提示二者可能共同参与胃癌发生发展。周士诚等[20]通过双荧光素酶基因也证实,miR-875-5p 在胃癌中靶向负反馈调控USF2 表达,抑制胃癌细胞侵袭和转移,进一步佐证了本研究结果。
综上所述,胃癌组织中miR-875-5p 低表达,USF2 mRNA 高表达,二者与肿瘤分化程度、TNM 分期、淋巴结转移和预后有关,可作为胃癌预后评估指标。但本研究样本量较少,关于miR-875-5p、USF2参与胃癌的关系有待进一步研究。
