血清VEGF、AFP水平对晚期肝癌TACE联合PD-1抑制剂疗效的评估价值
2022-07-11吴君韩萍张志勇马瑞芳
吴君,韩萍,张志勇,马瑞芳
1 甘肃省肿瘤医院放射科,兰州 730050;2 甘肃省肿瘤医院介入治疗科
晚期肝癌患者往往丧失最佳手术时机,预后极差,临床多通过局部经导管肝动脉化疗栓塞(TACE)或消融治疗降期至米兰标准后转手术切除治疗。近年来随着免疫阻断点抑制剂治疗晚期肝癌的Ⅲ期临床试验成功,晚期肝癌的转化治疗逐渐成为研究的热点,TACE 联合免疫阻断点抑制剂治疗是晚期肝癌转化治疗的主要方案之一,对提高转化成功率,延长患者生存期有重要价值[1]。程序死亡受体-1(PD-1)是一种免疫检查点,可促使抗原特异性T 细胞凋亡,抑制免疫反应,促进免疫耐受,减弱宿主对肿瘤细胞的免疫反应,导致肿瘤进展[2]。PD-1 抑制剂通过阻断PD-1 激活T 细胞,提高抗肿瘤免疫反应,在晚期不可手术切除恶性肿瘤治疗中表现出潜在的治疗效果[3]。TACE 联合PD-1 抑制剂治疗中晚期肝癌1 个月后疾病缓解率达45.2%,平均无进展生存期6 个月,近期疗效明确[4],但缺乏评估转化结果的生物学指标。血管内皮生长因子(VEGF)在肿瘤新生血管形成、复发转移方面发挥重要作用,高水平血清VEGF 与肝癌微转移以及治疗后复发有关[5]。甲胎蛋白(AFP)由肝细胞癌变时产生,是肝癌诊断和预后评估的生物学指标[6]。本研究拟分析血清VEGF、AFP 水平在TACE 联合PD-1 抑制剂治疗晚期肝癌疗效的评估价值,以期为临床提供参考。
1 资料与方法
1.1 临床资料 选择2020 年1 月—2022 年1 月本院收治的晚期肝癌患者80 例,均至少完成2 个周期的治疗。其中男51例,女29例,年龄52~70(63.05±5.19)岁;中国肝癌分期(CNLC)分期Ⅲ期41 例,Ⅳ期39 例;Child-Pugh 分级A 级38 例,B 级42 例;美国东部肿瘤协作组体力状态活动(ECOG PS)评分(1.02±0.27)分;合并乙型肝炎49 例,丙型肝炎21例;治疗周期3~6(3.85±0.49)个。纳入标准:经术前组织病理学或影像学检查证实为肝癌;CNLC 分期Ⅲ、Ⅳ期;年龄18~70 岁;Child-Pugh 分级A、B 级;ECOG PS 评分0~2 分;具有可测量的病灶;无肝外转移。排除标准:既往接受TACE、免疫或靶向治疗;合并其他恶性肿瘤;对本研究药物过敏,治疗中途出现严重不良反应退出。本研究已获得医院医学伦理委员会批准,患者均签署知情同意书。
1.2 治疗方法 患者均接受TACE 联合PD-1 抑制剂治疗。TACE:术前禁食6 h,股动脉局部浸润麻醉(2%利多卡因),Seldinger法穿刺置管至肿瘤供血靶动脉,注入造影剂确认无动静脉瘘,先用奥沙利铂100 mg/m2、吉西他滨1 000 mg/m2灌注化疗,然后注入5~20 mL碘化油混合乳直至填塞满意。术后3~5 d 静脉滴注200 mg 帕博利珠单抗(美国默沙东公司,注册证号S20180019)+5% 葡萄糖注射液250 mL,1个周期21 d。
1.3 疗效及转化情况评估 每2 个周期进行一次疗效评价,主要考察客观缓解。完全缓解:病灶消失且持续4 周以上;部分缓解:病灶最长径总和减少≥30%。完全缓解+部分缓解为客观缓解[7]。转化成功标准[8]:Child-Pugh 评分<7 分;ECOG PS 评分≤1分;无肝外病变;保留肝脏血管结构完整且剩余肝脏体积充足。
1.4 血清VEGF、AFP 检测 分别于治疗前、治疗2个周期后(治疗后)各采集患者静脉血2 mL注入促凝试管,凝固后取上层液离心(3 000 r/min,半径10 cm,时间5 min)分离血清,通过HBS-1096A 全自动酶标分析仪(南京德铁实验设备有限公司)采用酶联免疫吸附试验检测血清VEGF,试剂盒购自美国R&D 公司;通过iBright全自动化学发光免疫分析仪(美国赛默飞公司)采用化学发光免疫法检测血清AFP,试剂盒购自上海纪宁生物科技有限公司。
1.5 统计学方法 采用SPSS25.0 统计方法。符合正态分布计量资料用±s表示,比较采用配对或成组t检验;绘制受试者工作特征曲线,用曲线下面积评价血清VEGF、AFP 水平评估晚期肝癌TACE 联合PD-1 抑制剂疗效的价值。P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效及转化情况 80 例患者治疗后客观缓解33 例,客观缓解率为41.25%;转化成功31 例,转化成功率为38.75%。将患者分为缓解组33例、未缓解组47例,转化成功组31例、转化失败组49例。
2.2 缓解组与未缓解组血清VEGF、AFP 水平比较 治疗前,两组血清VEGF、AFP 水平比较差异无统计学意义(P均>0.05);缓解组治疗后血清VEGF、AFP 水平均较治疗前降低(P均<0.05),未缓解组治疗前后血清VEGF、AFP 水平比较差异无统计学意义(P均>0.05),缓解组治疗后血清VEGF、AFP 水平低于未缓解组(P均<0.05)。见表1。

表1 缓解组与未缓解组血清VEGF、AFP水平比较(xˉ± s)
2.3 转化成功组与转化失败组血清VEGF、AFP 水平比较 治疗前,两组血清VEGF、AFP 水平比较差异无统计学意义(P均>0.05);转化成功组治疗后血清VEGF、AFP 水平均较治疗前降低(P均<0.05),转化失败组治疗前后血清VEGF、AFP 水平比较差异无统计学意义(P均>0.05),转化成功组治疗后血清VEGF、AFP 水平低于转化失败组(P均<0.05)。见表2。
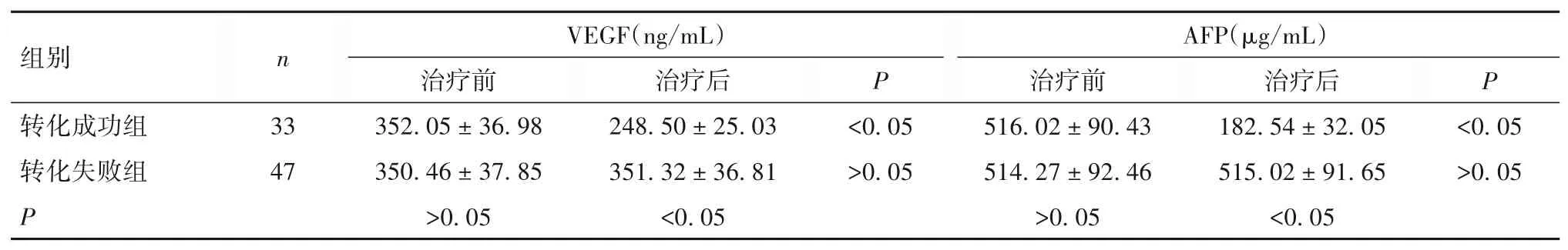
表2 转化成功组与转化失败组血清VEGF、AFP水平比较(xˉ± s)
2.4 治疗后血清VEGF、AFP对客观缓解的评估价值治疗后血清VEGF、AFP检测评估晚期肝癌患者客观缓解的曲线下面积为0.870,高于二者单独检测(0.691、0.742),比较差异均有统计学意义(P均<0.05)。见表3。

表3 治疗后血清VEGF、AFP对客观缓解的评估价值
2.5 治疗后血清VEGF、AFP对转化成功的评估价值治疗后血清VEGF、AFP检测评估晚期肝癌患者转化成功的曲线下面积为0.860,高于二者单独检测(0.695、0.733),比较差异均有统计学意义(P均<0.05)。见表4。

表4 治疗后血清VEGF、AFP对转化成功的评估价值
3 讨论
VEGF 是一种具有促血管生成的活性生长因子,主要在血管内皮细胞表达,通过与其受体结合促使内皮细胞有丝分裂,抑制内皮细胞凋亡,增加血管通透性,促进细胞迁移和新生血管形成[9]。VEGF与肝癌的发生和进展存在密切关系,肝癌组织中VEGF 阳性表达率高于癌旁组织,且与肝癌病理分期增加、包膜完整性破坏、转移有关[10]。动物研究显示超声引导下射频消融术治疗肝癌残余癌组织中VEGF mRNA 呈高表达,且VEGF mRNA 高表达与超声血流信号增加有关[11],可见VEGF 高表达可促使肝癌癌灶血管生成,促使残余癌进展。基线高水平VEGF 可评估接受乐伐替尼治疗的不可切除原发性肝癌患者Child-Pugh 分级[12]。本研究缓解组、转化成功组治疗前后血清VEGF 水平均低于未缓解组和转化失败组,表明血清VEGF 水平与晚期肝癌经TACE 联合PD-1抑制剂治疗疗效有关。分析原因为VEGF 通过直接作用于血管内皮细胞,促使新生血管形成,刺激肿瘤细胞增殖、浸润和转移,对抗肿瘤治疗反应低下。进一步分析显示,治疗后血清VEGF 评估晚期肝癌患者客观缓解、转化成功的曲线下面积分别为0.691、0.733,提示VEGF 是晚期肝癌患者接受TACE联合PD-1抑制剂治疗效果评估的生物学指标。
AFP 是一种血清糖蛋白,在胎儿期由肝脏和卵黄囊内脏内胚层产生,成人肝细胞由于丧失合成AFP 的能力,仅可在外周血中检测到微量AFP,而肝癌细胞则恢复合成AFP 的能力,导致血清AFP 水平显著升高。AFP 可抑制树突细胞成熟并诱导其凋亡,使癌细胞逃避免疫监视,并通过抑制树突细胞成熟,减少白细胞介素-12的分泌进而间接抑制自然杀伤细胞增殖分化,促进肝癌细胞的增殖和肿瘤血管的形成,在肝癌发生和进展中发挥重要作用,是肝癌诊断和预后评估的肿瘤学标志物[13]。现有研究显示,高水平AFP 与肝癌术后复发有关,是评估术后复发的指标[14]。AFP 还可作为原发性肝癌TACE 疗效评估的指标,经TACE 治疗后AFP 水平降低组、持平组和升高组疾病控制率分别为96.00%、64.29%、40.74%[15]。本研究结果显示,缓解组、转化成功组治疗后血清AFP 水平均较治疗前降低,而未缓解组和转化失败组血清AFP 水平未明显变化,说明血清AFP水平与晚期肝癌患者TACE联合PD-1抑制剂治疗后是否客观缓解和转化成功有关,可用于监测肝癌对转化治疗的反应性。进一步分析显示,AFP 在判断晚期肝癌TACE联合PD-1抑制剂治疗后病理缓解、转化成功方面具有较高的价值。部分患者在TACE联合PD-1抑制剂治疗后未出现AFP下降的原因可能为该类患者癌灶区域侧支循环血流丰富,TACE 栓塞治疗尚无法完全阻断癌细胞的氧气与营养供给[18],而高水平AFP 可进一步抑制免疫细胞活性,导致癌细胞逃脱免疫治疗的攻击,最终导致治疗反应性差。
本研究结果显示,VEGF 联合AFP 评估晚期肝癌TACE 联合PD-1 抑制剂治疗后客观缓解、转化成功的曲线下面积均较单独评估明显扩大,这与二者联合能为临床提供更丰富的信息有关。
综上所述,高水平VEGF、AFP 与晚期肝癌TACE 联合PD-1抑制剂治疗未达到客观缓解以及转化治疗失败有关,可作为临床效果评估的生物学指标。本研究局限之处在于未设计对照治疗组,仍需开展大量随机对照研究探索最佳的晚期肝癌转化治疗方案。
