健脾养荣汤治疗原发性肝癌术后癌因性疲乏的临床研究*
2022-06-30欧阳震文吴玉华
欧阳震文 吴玉华
癌因性疲乏(cancer-related fatigue,CRF)是指癌症本身或癌症治疗引起的持续性主观疲劳[1]。这种情况在恶性肿瘤患者中的发生率可达48%~56%[2],严重降低患者生活质量,影响后续治疗计划及其预后。本文主要探讨八珍汤加味治疗原发性肝癌术后癌因性疲乏的临床效果,现具体报道如下。
1 资料与方法
1.1 一般资料
诊断标准,(1)原发性肝癌诊断诊断标准参照文献[3]《内科学》中对于原发性肝癌的诊断标准。(2)癌因性疲乏诊断标准参照文献[4]《国际疾病分类标准》第10版(ICD-10)癌因性疲乏的诊断标准:疲劳感反复出现,超过14 d未缓解,同时有以下症状中的5个或5个以上,①身体沉重无力;②注意力易分散;③对事物缺乏兴趣,心情低落;④睡眠时间严重增多或减少;⑤休息不能缓解;⑥行动不便;⑦出现悲伤感、挫折感等;⑧影响患者曾经的正常生活;⑨近期记忆力下降;⑩疲劳感持续数小时。(3)气血两虚证诊断标准:参照文献[5]《新中医临床研究指导原则》(试行)诊断标准。纳入标准:(1)确诊为原发性肝癌;(2)符合癌因性疲乏诊断标准;(3)符合气血亏虚证型的中医诊断标准;(4)年龄≥20岁,卡式功能状态评分量表(KPS)评分≥60分;(5)预计生存期≥3个月。排除标准:(1)严重肝肾功能障碍;(2)孕妇和哺乳期妇女;(3)对研究药物过敏或不耐受;(4)正在参加其他临床药物研究。所有病例资料均来自2020年6月1日-2021年6月1日在湖南省中医药研究院附属医院肿瘤科门诊或住院治疗的原发性肝癌患者,符合西医与中医诊断标准,满足纳入和排除标准60例。根据随机数字表分为两组,治疗组和对照组各30例。至随访3个月结束时,两组均无失访病例。治疗组中,男21例,女9例;平均年龄(48.92±10.12)岁;平均病程(8.74±2.46)个月,平均KPS评分(67.5±5.8)分,其中Ⅰ期5例,Ⅱ期11例,Ⅲ期14例。对照组中,男21例,女9例;平均年龄(50.27±11.16)岁;平均病程(9.38±2.54)个月,平均KPS评分(68.4±6.3)分,其中Ⅰ期患者4例,Ⅱ期11例,Ⅲ期15例。两组性别、年龄及病程方面比较,差异无统计学意义(P>0.05),具有可比性。本研究已得到医院医学伦理委员会批准。患者知情同意和自愿参与。
1.2 方法
1.2.1 对照组 基础治疗,包括运动疗法、营养咨询、睡眠管理和心理社会疏导等方式进行辅助治疗[6]。
1.2.2 治疗组 基础治疗联合口服健脾养荣汤的中药汤剂治疗,其中药物包括人参10 g,茯苓10 g,白术 10 g;甘草 10 g,白芍 10 g,川芎 10 g,熟地黄10 g,当归 10 g,黄芪 30 g,黄精 20 g,山药 15 g,1剂/d,由湖南省中医研究院附属医院中药房统一提供,由煎药室统一煎煮,每剂煎2次,两次煎药混合到 400 ml,早晚两次温服,200 ml/次。
两组疗程均为3个月,3个月后观察疗效。
1.3 观察指标及评价标准
1.3.1 Piper疲乏修订量表中文版(RPFS-Chinese version,RPFS-CV)(以下简称Piper疲乏量表)包含行为、情感、躯体、认知四个维度。分数越高表明疲劳程度越高,无疲乏得0分,轻度疲乏得1~3分,中度疲乏得4~6分,重度疲乏得7~10分[7]。
1.3.2 营养状态指标 比较治疗前后血红蛋白(Hb,参考值范围,男:120~165 g/L,女:110~150 g/L)、白蛋白(Alb,参考值范围 35~51 g/L)、总蛋白(TP,参考值范围60~80 g/L)水平变化。
1.3.3 炎症因子指标 采用酶联免疫吸附法检测,比较治疗前后白细胞介素-1(IL-1,参考值范围:5~15 ng/L)、IL-6(参考值范围:0.1~7 ng/L)、IL-8(参考值范围:8.1~21.3 ng/L)和肿瘤坏死因子-α(TNF-α)水平(参考值范围:7.4~15.4 ng/L)。以上检验均由湖南中医药研究院附属医院检验科完成。
1.3.4 HAD 情 绪 测 定 表(hospital anxiety and depression scale,HAD) 用于评价患者的焦虑抑郁状况。该表分A、D两种测试题,各7个问题,A评价焦虑情况,D评价抑郁情况,根据患者的自我评价程度分为0~3分,分值越高表示程度越重,各题得分之和分别为每种类型的测试题的总分,0~7提示正常,8~10分提示处于轻度焦虑或抑郁状态,11~14分提示处于中度焦虑或抑郁状态,15~21分提示处于重度焦虑或抑郁状态[8]。
1.3.5 生活质量评分 将Kamofsky(KPS)百分制评分作为判定患者生活质量状态的依据。
1.3.6 安全性评价 记录试验过程中发生的未预知的不良反应,包括临床表现、严重程度、处理措施等。
1.4 统计学处理
2 结果
2.1 两组治疗前后RPFS-CV评分比较
治疗前两组RPFS-CV各维度得分差异均无统计学意义(P>0.05),治疗后各维度得分均较治疗前有所下降,且治疗组明显低于对照组(P<0.05),见表1。
表1 两组RPFS-CV评分比较[分,(±s)]
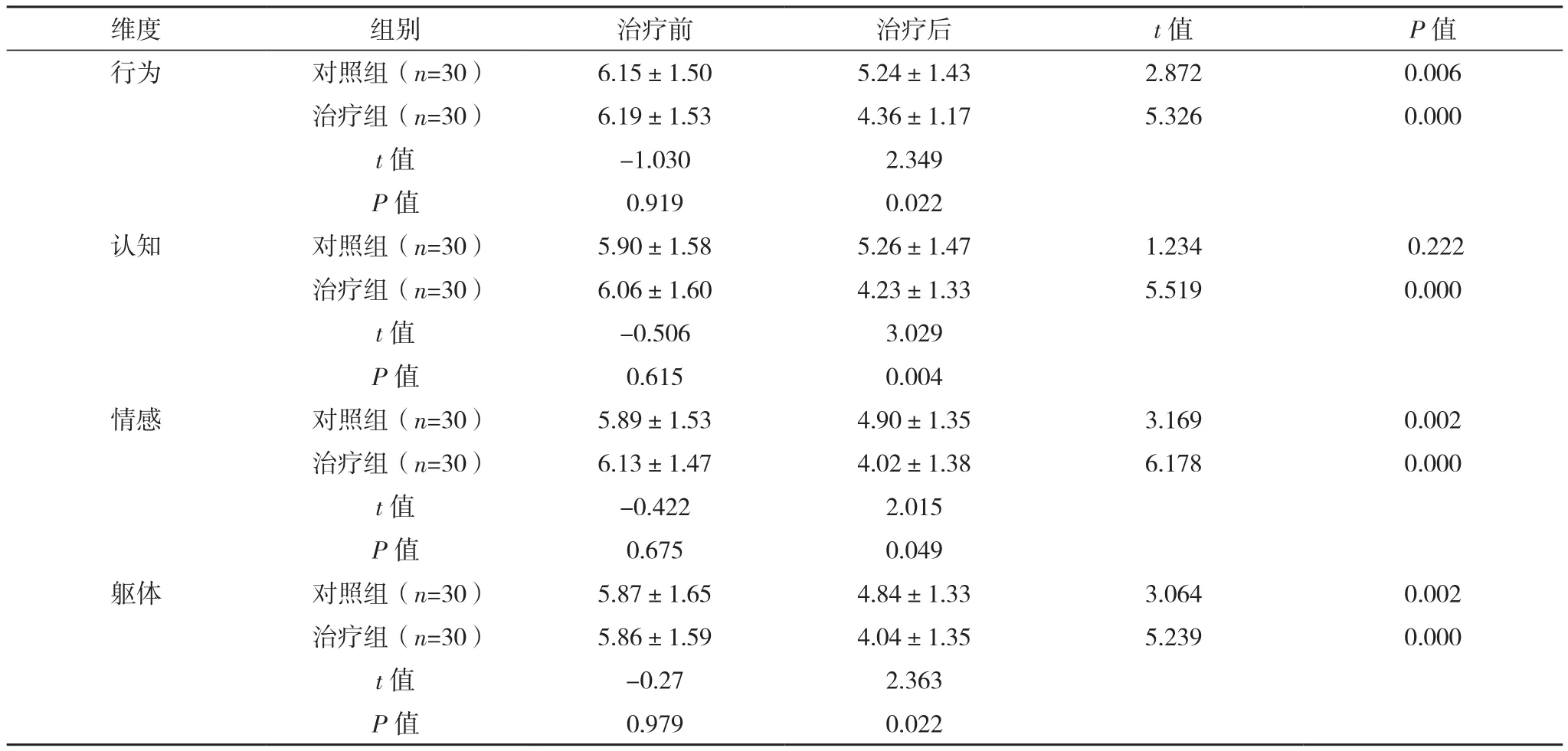
表1 两组RPFS-CV评分比较[分,(±s)]
维度 组别 治疗前 治疗后 t值 P值行为 对照组(n=30) 6.15±1.50 5.24±1.43 2.872 0.006治疗组(n=30) 6.19±1.53 4.36±1.17 5.326 0.000 t值 -1.030 2.349 P值 0.919 0.022认知 对照组(n=30) 5.90±1.58 5.26±1.47 1.234 0.222治疗组(n=30) 6.06±1.60 4.23±1.33 5.519 0.000 t值 -0.506 3.029 P值 0.615 0.004情感 对照组(n=30) 5.89±1.53 4.90±1.35 3.169 0.002治疗组(n=30) 6.13±1.47 4.02±1.38 6.178 0.000 t值 -0.422 2.015 P值 0.675 0.049躯体 对照组(n=30) 5.87±1.65 4.84±1.33 3.064 0.002治疗组(n=30) 5.86±1.59 4.04±1.35 5.239 0.000 t值 -0.27 2.363 P值 0.979 0.022
2.2 两组治疗前后TP、Alb、Hb水平比较
治疗前两组TP、Alb、Hb水平比较,差异无统计学意义(P>0.05),治疗后两组TP、Alb、Hb水平均较前升高,治疗组高于对照组(P<0.05),见表2。
表2 两组TP、Alb、Hb水平比较[g/L,(±s)]

表2 两组TP、Alb、Hb水平比较[g/L,(±s)]
指标 组别 治疗前 治疗后 t值 P值TP 对照组(n=30) 45.86±4.28 48.48±4.18 -4.874 0.000治疗组(n=30) 45.67±4.29 58.12±5.46 -17.025 0.000 t值 0.031 -14.467 P值 0.976 0.000 Alb 对照组(n=30) 23.56±4.52 25.48±4.47 -3.457 0.002治疗组(n=30) 23.67±4.38 32.12±4.91 -13.533 0.000 t值 -3.470 -10.420 P值 0.730 0.000 Hb 对照组(n=30) 96.86±6.57 101.27±6.42 -4.172 0.000治疗组(n=30) 96.12±6.28 111.32±7.20 -12.811 0.000 t值 0.746 -15.330 P值 0.894 0.000
2.3 两组治疗前后IL-1、IL-6、IL-8和TNF-α水平变化比较
治疗前两组IL-1、IL-6、IL-8和TNF-α水平差异无统计学意义(P>0.05);治疗后两组各项指标均较前降低(P<0.05);治疗组降低效果更显著(P<0.05),见表 3。
表3 两组IL-1、IL-6、IL-8、TNF-α水平比较[ng/L,(±s)]
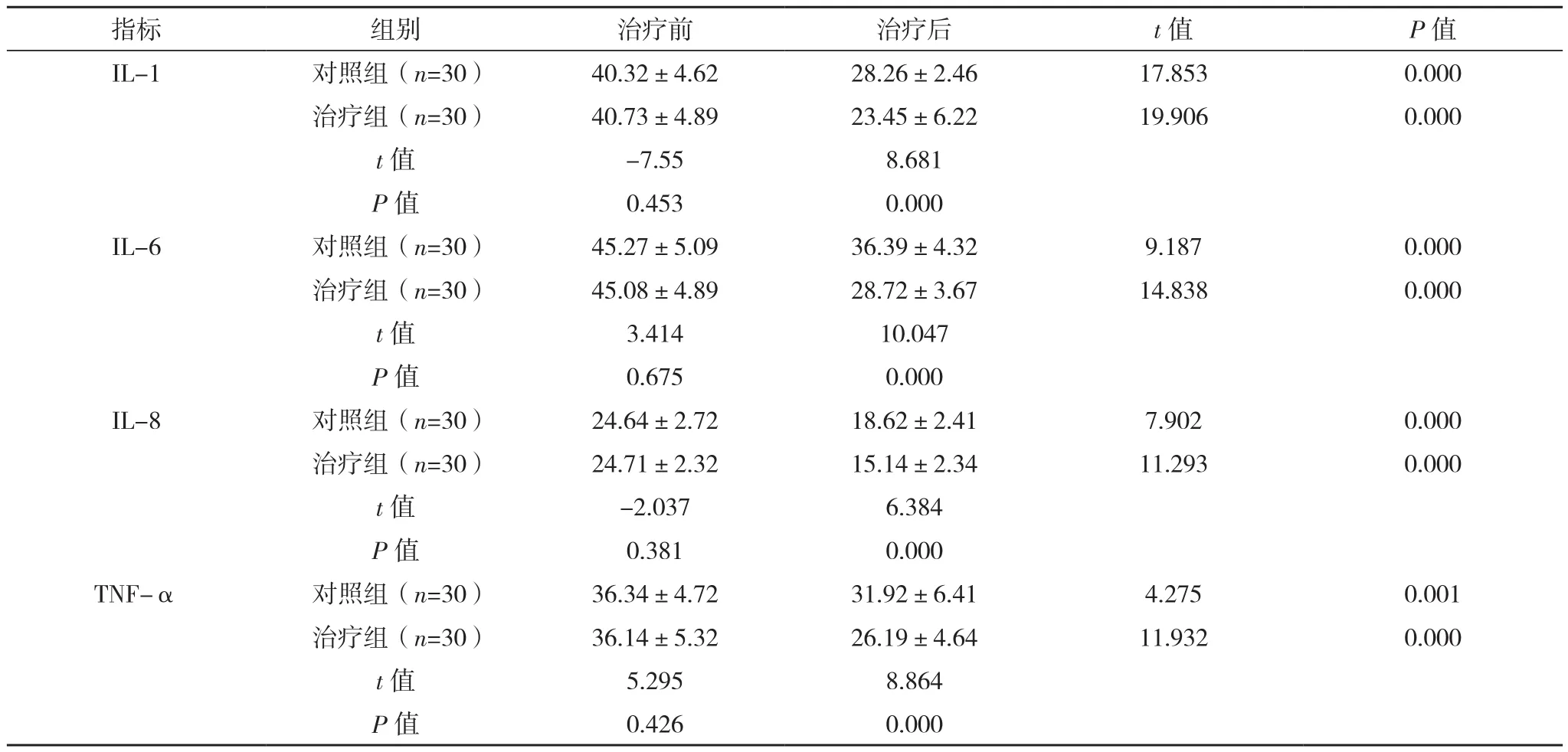
表3 两组IL-1、IL-6、IL-8、TNF-α水平比较[ng/L,(±s)]
指标 组别 治疗前 治疗后 t值 P值IL-1 对照组(n=30) 40.32±4.62 28.26±2.46 17.853 0.000治疗组(n=30) 40.73±4.89 23.45±6.22 19.906 0.000 t值 -7.55 8.681 P值 0.453 0.000 IL-6 对照组(n=30) 45.27±5.09 36.39±4.32 9.187 0.000治疗组(n=30) 45.08±4.89 28.72±3.67 14.838 0.000 t值 3.414 10.047 P值 0.675 0.000 IL-8 对照组(n=30) 24.64±2.72 18.62±2.41 7.902 0.000治疗组(n=30) 24.71±2.32 15.14±2.34 11.293 0.000 t值 -2.037 6.384 P值 0.381 0.000 TNF-α 对照组(n=30) 36.34±4.72 31.92±6.41 4.275 0.001治疗组(n=30) 36.14±5.32 26.19±4.64 11.932 0.000 t值 5.295 8.864 P值 0.426 0.000
2.4 两组HAD情绪测定评分比较
治疗前,两组HAD抑郁、焦虑评分差异无统计学意义(P>0.05);两组治疗后抑郁、焦虑评分均有所下降,但对照组治疗效果不明显(P>0.05),而治疗组明显低于对照组(P<0.05),见表4。
表4 两组HAD情绪测定评分比较[分,(±s)]
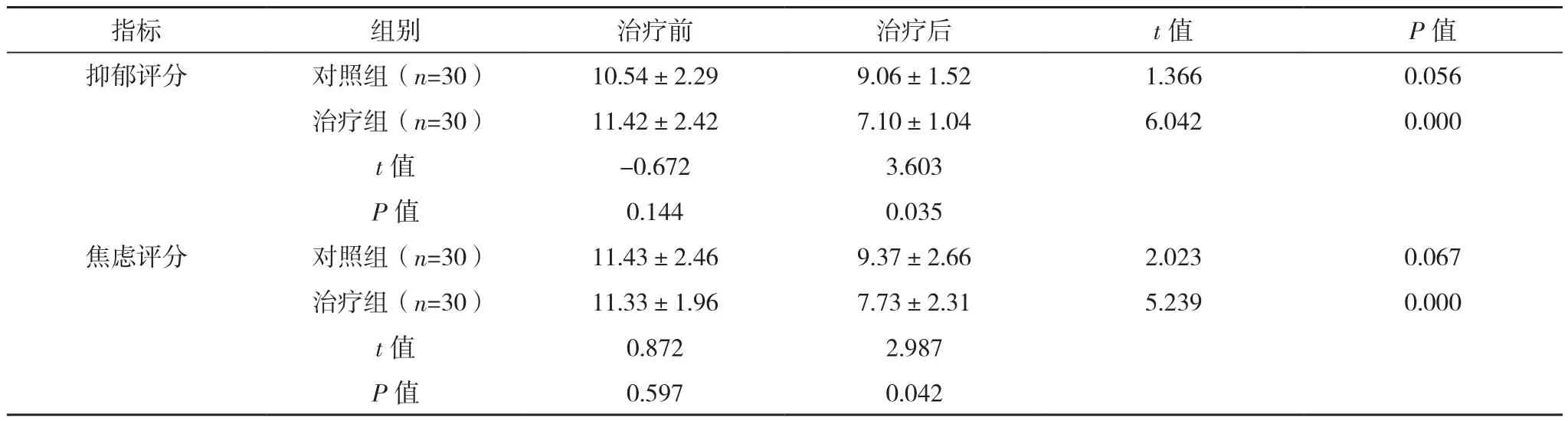
表4 两组HAD情绪测定评分比较[分,(±s)]
指标 组别 治疗前 治疗后 t值 P值抑郁评分 对照组(n=30) 10.54±2.29 9.06±1.52 1.366 0.056治疗组(n=30) 11.42±2.42 7.10±1.04 6.042 0.000 t值 -0.672 3.603 P值 0.144 0.035焦虑评分 对照组(n=30) 11.43±2.46 9.37±2.66 2.023 0.067治疗组(n=30) 11.33±1.96 7.73±2.31 5.239 0.000 t值 0.872 2.987 P值 0.597 0.042
2.5 两组治疗前后生活质量评分
两组治疗后KPS评分水平升高,且治疗组明显高于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组KPS评分比较[分,(±s)]
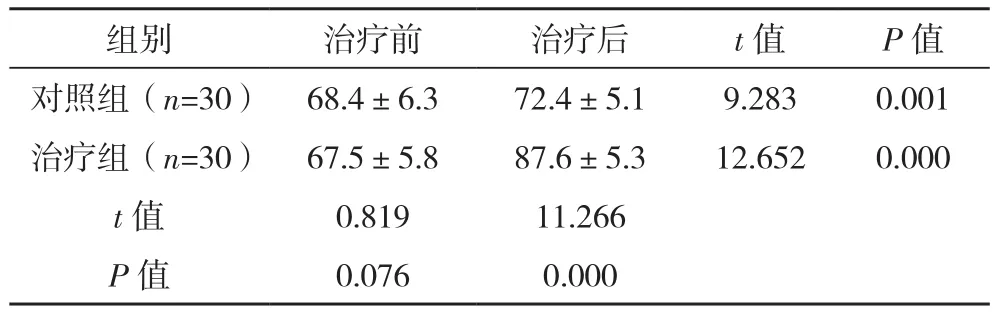
表5 两组KPS评分比较[分,(±s)]
组别 治疗前 治疗后 t值 P值对照组(n=30) 68.4±6.3 72.4±5.1 9.283 0.001治疗组(n=30) 67.5±5.8 87.6±5.3 12.652 0.000 t值 0.819 11.266 P值 0.076 0.000
2.6 两组安全性比较
研究过程中,两组均未发现明显相关不良反应。
3 讨论
CRF的病因及发病机制尚不清楚,目前各项研究均表明其可能受到肿瘤本身、治疗、并发症、社会心理等多方面的影响。一方面,肿瘤的细胞增殖、发展能激活促炎细胞因子网络,释放如肿瘤坏死因子(TNF)等炎症因子,影响正常人体细胞功能代谢的功能,从而导致机体功能降低,造成免疫因子紊乱,引发内分泌功能的改变,使肿瘤患者产生疲劳、疼痛、失眠、焦虑等不适表现[9]。另一方面,肿瘤的治疗,如手术、放化疗等,应激导致蛋白动员增加,增加能量消耗,加重了机体负荷[10]。此外,肿瘤患者易受贫血、恶病质、癌性疼痛等并发症影响,产生焦虑抑郁的心理状况。受此诸多方面影响,肿瘤患者患CRF概率很高,并且贯穿肿瘤的发展、治疗及预后全过程,影响生活质量、后续治疗计划及其预后,患者及其家人都深受其害,却缺乏行之有效的干预措施。目前,西医CRF的药物治疗主要包括EPO、皮质类固醇激素、精神兴奋剂等,尚只有对症支持治疗,且受到副作用的限制,无法广泛而长期的使用[11]。健康宣教、心理疏导、运动锻炼、饮食干预等非药物治疗方式有一定的疗效,但是在依从性与具体的干预措施等方面还需进一步完善和研究[12]。
中医认为人体是以五脏为中心的有机整体,讲究整体观念,注重辨证论治,在缓解不良反应,改善生活质量方面有着诸多优势。根据CRF的症状描述,其在中医上应当归为“虚劳”范畴。熊家青等[13]认为肝癌术后患者CRF病因当属大病久病,失于调理;病机当为五脏虚损,久虚不复,主要病位在脾肾,脾肾亏虚,则气血生化无源,故气血亏虚证多见,治疗应以扶正为主,驱邪为辅。在此理论基础之上,吴玉华老师常选用自拟健脾养荣汤来治疗肝癌术后CRF患者。健脾养荣汤由八珍汤加减化裁而来,方中各味中药所发挥的药理学作用已被证实,有研究表面人参最重要的成分人参皂苷能对肿瘤细胞产生抑制作用,并促进肿瘤细胞的死亡[14];熟地黄可有效抑制血清尿素氮及血乳酸的生成,起到抗疲劳的效果[15];白术、茯苓均能通过提高免疫系统功能,抑制炎症因子而增强抗肿瘤作用[16-17];川芎、白芍具有保护肝功能,止痛及抗炎的功能[18-19];当归有缓解血管平滑肌痉挛,减少血小板聚集的作用[20];甘草有着抗炎、调节免疫、抗氧化、抗肝纤维化等作用[21];黄芪多糖可通过阻滞肝癌细胞周期,激活细胞的自噬作用,使细胞凋亡[22];黄精多糖在抗肿瘤和免疫调节上均有较强的药理活性[23];柴胡中的柴胡皂苷D能通过阻滞细胞周期、抑制其增殖,发挥抗肿瘤作用[24]。诸药合用以达到改善造血、血流、调节免疫、抑制炎症因子、抗氧化等药理作用。
本研究结果显示,治疗组在改善RPFS-CV评分、营养指标、炎症因子水平、HAD评分、KPS评分等方面颇具疗效(P<0.05),而对照组在RPFSCV评分中的认知维度与焦虑抑郁评分无明显改善(P>0.05),其余各项指标有所好转;与对照组相比,治疗组明显优于对照组,差异有统计学意义(P<0.05);两组均未出现相关不良反应。说明口服健脾养荣汤复方能通过减轻炎症水平,调节机体免疫功能,改善营养状态,缓解焦虑抑郁状态,从而改善原发性肝癌术后癌因性疲乏程度,提高生活质量,且药物的安全性良好,具有广泛的临床应用价值。
