宫颈病变中NOB1、miR-21的表达及与高危型HPV感染关系
2022-06-21祁美霞吴小蕊
李 宏 祁美霞 纪 桢 吴小蕊
天津市第五中心医院(300450)
宫颈癌为临床常见恶性肿瘤。人乳头瘤病毒(HPV)感染是宫颈癌的主要致病因素[1]。有学者[2]指出,NOB1、miRNA与多种恶性肿瘤的发生发展有关。但关于NOB1、miR-21在宫颈癌中的表达,以及与高危型HPV感染相关性研究报道较少。故本次选取宫颈病变患者临床资料进行回顾性分析,探讨NOB1、miR-21在宫颈病变中的表达及其与高危型HPV感染的可能关系。
1 资料与方法
1.1 临床资料
经本院伦理委员会审批,回顾性收集2018年1月-2020年5月本院诊治的宫颈病变患者138例临床资料。宫颈癌诊断符合相关指南标准[3],经病理组织学确诊。纳入标准:①临床资料完整;②首次发病就诊;③无他恶性肿瘤疾病;④接受本次研究前1个月未服用相关治疗药物;⑤认知功能正常。排除标准:①接受过抗HPV病毒治疗;②合并胃癌或肺癌等恶性肿瘤疾病;③伴有精神疾病;④妊娠或哺乳期。
1.2 方法
患者入院3d内采集3份清晨空腹静脉血冷冻保存待检。①NOB1检测及阳性判定标准:标本经10.0%甲醛固定、石蜡包埋、切片、染色等常规处理后,采用SP法。NOR1多克隆抗体由Proteinterch Group公司提供,试剂盒由广州基因公司提供。在高倍光镜下(×400)观察,即每张片随机选择5个视野,每个视野计数100个阳性细胞,采用半定量分级计分法评估:染色程度,0分无着色,1分浅棕色,2分棕黄色,3分棕褐色;染色细胞比例,染色阳性细胞占比≤5%为0分,6%~25%为1分,26%~50%为2分,≥50%为3分;根据染色程度和染色细胞比例的得分乘积,0~1分为阴性(-),2~3分弱阳性(+),4~6分中度阳性(++),强7~9分阳性(+++)。②miR-21检测:采用Trizol提取miRNA,超微量分光光度计检测;采用miRNA反转录试剂盒将miRNA反转录为cDNA,SYBR-Green荧光定量PCR检测试剂盒(美国赛默飞世尔科技有限公司)检测血浆miR-21;反应条件:50℃2min,95℃10min,60℃1min,90℃15s,共进行40个循环,miR-21相对表达量根据2-∆∆Ct法计算。miR-21上游引物Hmirqp0316,下游引物QP010-03。③高危型HPV DNA检测:采用HPV-DNA分型检测试剂盒(美国Digene)检测HPV-DNA含量,一次可检出13种HR-HPV,根据样本检测出的HPV-DNA的RLU与标准阳性对照样本的RLU的比值进行分级,比值≥0.1表示标本检出HPV-DNA含量>1.0pg/ml为阳性,<1.0为阴性;再根据比值大小计算HR-HPV DNA负荷量。
1.3 观察指标
①评估患者NOB1阳性率、阳性细胞比例和染色强度综合评分、miR-21表达量及HR-HPV阳性率及DNA负荷量。②分析NOB1、miR-21与高危型HPV感染的相关性。③评估NOB1、miR-21诊断宫颈癌和预测高危型HPV感染的AUC值、敏感度、特异度及约登指数。
1.4 统计学方法
2 结果
2.1 NOB1、miR-21表达量
138例年龄(47.25±3.25)岁(30~65岁),其中宫颈癌52例(37.7%)(宫颈癌组)、宫颈鳞状上皮内病变54例(39.1%)(宫颈上皮内变组)、慢性宫颈炎32例(23.2%)(宫颈炎组)。NOB1阳性率、阳性细胞比例和染色强度综合评分及miR-21表达量均宫颈癌组最高、宫颈上皮内变组其次、宫颈炎组最低(P<0.05)。见表1。

表1 各组NOB1、miR-21表达比较
2.2 HR-HPV阳性率及DNA负荷量
A组的宫颈癌组HR-HPV阳性率、HR-HPV DNA负荷量中100~1000、≥1000占比均高于另外两组(P<0.05),而HR-HPV DNA负荷量1~100占比3组无差异(P>0.05)。见表2。
2.3 相关性分析
Kendall’s tau-b相关性分析显示,NOB1阳性细胞比例和染色强度综合评分、miR21表达量与HR-HPV DNA负荷量呈正相关(r=0.137、0.143,P=0.035、0.027)。

表2 各组HR-HPV阳性及DNA负荷量比较[例(%)]
2.4多元逐步回归分析
以HR-HPV阳性率为因变量,以miR21表达量、NOB1阳性细胞比例和染色强度综合评分为自变量行多元逐步回归分析。结果表明,NOB1阳性细胞比例和染色强度综合评分进入分析模型(P<0.05),R方=0.170(F=13.813,P<0.05),其中回归方程Y=0.179+0.138×NOB1阳性细胞的比例和染色强度综合评分。回归分析见表3。
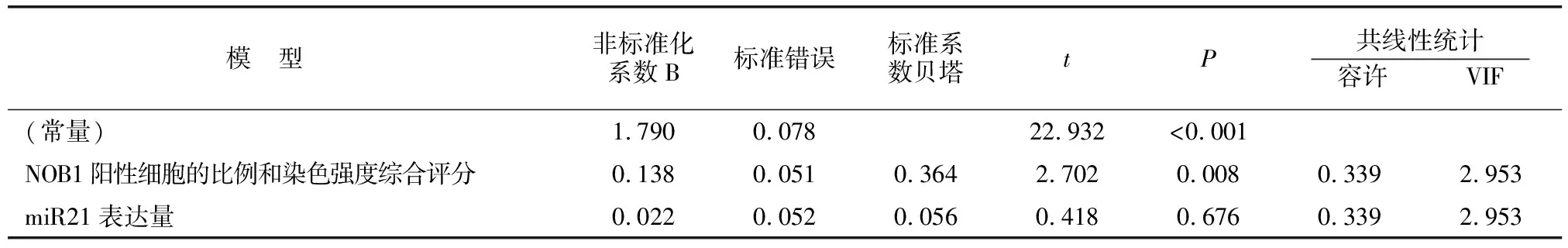
表3 多元逐步回归分析
2.5 效能分析
ROC曲线分析显示,NOB1阳性细胞比例和染色强度综合评分、miR-21诊断宫颈癌效能及预测高危型HPV感染效能见表4。

表4 NOB1、miR-21诊断宫颈癌和预测高危HPV感染效能分析
3 讨论
据文献[4]报道,有95.0%宫颈癌患者感染HPV,且认为高危型HPV持续感染是促进宫颈癌及癌前病变发展的重要条件,然而临床上对其发病机制尚未明确。探讨宫颈癌发病机制对临床早期发现、早期治疗具有重要意义。NOB1是2005年采用EST同源克隆技术得到的一种核蛋白基因。既往研究[5]表示,该基因的过度表达可能是诱导宫颈病变的重要因子,其在肿瘤侵袭过程中具有重要作用。分析认为可能是与核糖体、蛋白酶体的生物合成有关;而核糖体、蛋白酶体的变化又与肿瘤细胞的分化、增殖、转移密切相关。本研究NOB1阳性率、阳性细胞比例和染色强度综合评分均在宫颈癌组、宫颈上皮内变组、宫颈炎组依次降低;与赵洪萍等[6]研究结果一致。说明NOB1表达水平会随着宫颈恶性病变程度的加重而增加,也证实了其与宫颈恶性病变程度有关。
近年来,随着基因学的不断发展,miRNA参与肿瘤发生发展及在治疗中发挥重要作用已被证实。胡军等[7]研究发现miR-21在非小细胞肺癌患者血浆中异常表达,NSCLC患者miR-21相对表达量高于正常人。故本文推测miR-21可能参与了宫颈癌的发生发展。本研究结果显示,宫颈癌组miR-21表达量均高于另外两组,与夏红等[8]研究结果基本一致。证实了miR-21与宫颈癌的发生有关。分析认为:miR-21在宫颈癌中可能是通过调控基质金属蛋白酶抑制剂表达,影响宫颈癌细胞增殖及迁移等生物学过程;另外,miR-21还能通过抑制PDCD4、PTEN等基因表达,促进细胞增殖、抑制凋亡及提高细胞侵袭能力[9-11]。故推测miR-21可能成为宫颈癌基因治疗的新靶点。
基于上述研究,本文Kendall’s tau-b相关性分析显示,NOB1表达阳性、miR21表达量与HR-HPV DNA负荷量呈正相关,推测HR-HPV可能与上述指标共同参与了宫颈癌的发生发展。其中,HPV感染是宫颈癌发生的首要条件,但不是必要条件[12]。既往研究[13]指出,正常人群也会感染HPV,即在感染后处于隐匿状态,并不会整合至子宫颈鳞状上皮内,提示该类人群有HPV感染但无临床及形态学改变。有学者[14]表示,正常人群感染HPV 6~12个月内可能会自行消失,即为一过性感染;若持续性感染高危型HPV,则会引起鳞状上皮增生,且随着时间的延长发生恶性生物学行为,如细胞肿瘤性增生,最终形成恶性肿瘤[15-17]。由此可见,持续性高危型HPV感染在宫颈癌的发生发展中有重要作用。本文为进一步论证NOB1、miR-21与HR-HPV的可能关系,将其纳入多元逐步回归分析中,结果显示NOB1阳性表达与HR-HPV阳性呈正相关,也是导致HR-HPV感染的高危因素;但miR21与HR-HPV的研究中,多元逐步回归分析并未发现两者间有关联,可能与样本量较小有关,仍需扩大样本进一步研究。
综上所述,NOB1阳性、miR-21在宫颈癌患者中呈高表达,且表达与HR-HPV DNA负荷量呈正相关。
