淫羊藿苷通过抑制Nod样受体家族蛋白3炎症小体相关蛋白表达抑制BV2小胶质细胞炎症反应
2022-06-13郑层层杨翠翠郝晋萍胡朝英
郑层层,杨翠翠,郜 丹,郝晋萍,张 兰,胡朝英
(首都医科大学宣武医院药学部,北京市神经药物工程研究中心,北京 100053)
多发性硬化(multiple sclerosis,MS)是一种主要累及中枢神经系统(central nervous system,CNS)白质的自身免疫性疾病,以慢性炎症浸润、脱髓鞘以及CNS轴突和神经元丢失为主要病理特征[1],临床表现具有症状和体征的空间多发性、病程的时间多发性及复发、迁延和致残率高等特点,多发于视神经、脊髓和脑干。目前,MS已成为致青壮年肢体残疾的第二大诱因,给家庭和社会造成沉重的经济和心理负担[2-4]。MS发病初期多为复发缓解型,多以抑制炎性脱髓鞘病变进展、防止急性期病变恶化及缓解期复发为主要治疗方针,有限的药物选择和沉重的治疗负担是治疗MS面临的两大难题。
神经系统和免疫系统之间存在多维度的交互作用[5-6]。在MS炎症反应早期,小胶质细胞在维持CNS免疫微环境稳态的过程中占主导地位[7]。小胶质细胞作为CNS固有免疫细胞以及联接固有免疫和获得性免疫的桥梁,是CNS最主要的免疫防线。对于内、外源性刺激,小胶质细胞首先被激活并分泌一系列炎症细胞因子和神经毒性因子,这些因子可能导致邻近神经元受损,进而引发更多小胶质细胞激活[7]。此外,小胶质细胞的低水平持续激活,持续释放多种炎症介质,被认为与复发缓解型MS脑和脊髓的持续慢性损伤有关[8-10]。因此,小胶质细胞是治疗MS,尤其是复发缓解型MS的重要靶点。
在CNS中,Nod样受体家族蛋白3(Nod-like receptor family protein 3,NLRP3)炎症小体主要表达于小胶质细胞,被认为是CNS免疫炎症反应的启动子,是控制CNS免疫炎症反应的新靶点[11-12]。小胶质细胞中NLRP3炎症小体的异常过度激活可促进细胞因子白细胞介素1β(interlukin-1β,IL-1β)和IL-18的分泌并促进炎症反应发生,引起细胞凋亡[13-15]。据报道,敲除小胶质细胞内NLRP3炎症小体主要组成蛋白,可减轻CNS炎症[16]。在实验性变态反应性脑脊髓炎模型小鼠中,小胶质细胞NLRP3炎症小体缺失可延缓MS进程,也提示NLRP3炎症小体的激活参与MS进程[17]。
淫羊藿苷(icariin,ICA)是从淫羊藿中提取的黄酮类化合物,具有多种药理学作用,如抗衰老、抗氧化和抗炎作用[18],且可通过血脑屏障[19]。本课题组前期研究结果表明,ICA能够明显抑制MS模型小鼠小胶质细胞的过度活化,抑制炎症因子分泌[20-21],但其作用机制尚不明确。本研究进一步探讨ICA的抗神经炎症作用是否与其抑制NLRP3炎症小体的形成有关。
1 材料与方法
1.1 药物、细胞、试剂和仪器
ICA(ID:E065-N15W,批号:110737-201516,HPLC纯度≥94.2%,中国食品药品检验研究院)。小鼠BV2小胶质细胞(批号:3111C0001CCC00-0063,中国医学科学院基础医学研究所基础医学细胞中心)。DMEM高糖培养基、4%细胞固定液和PBS(美国Hyclone公司);胎牛血清(美国Gibco公司);青、链霉素混合液和ECL化学发光底物(美国Thermo Fisher公司);细菌脂多糖(lipopolysaccharides,LPS)(美国Sigma公司);干扰素γ(interferon-γ,IFN-γ)和Luminex多因子检测试剂盒(美国R&D Systems公司);大鼠抗人CD16/CD32单克隆抗体和兔抗人CD206多克隆抗体(美国Abcam公司);Alexa Fluor 488山羊抗大鼠IgG(H+L)和Alexa Fluor 594山羊抗兔IgG(H+L)多克隆抗体(美国Invitrogen公司);兔抗小鼠NLRP3单克隆抗体(美国Cell Signaling Technology公司);小鼠抗人凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、胱天蛋白酶1(caspase 1)和胱天蛋白酶原1(procaspase 1)单克隆抗体(美国Santa公司);小鼠抗人GAPDH单克隆抗体(中国Abclonal公司);辣根过氧化物酶标记山羊抗兔IgG(H+L)和山羊抗小鼠IgG(H+L)多克隆抗体、DAPI封片剂、山羊血清和Triton X-100(北京中杉金桥公司)。Multiskan Spectrum全波长酶标仪(美国Thermo Scientific公司);Bio-Plex 200自动免疫分析仪系统(美国Bio-Rad公司);Tanon曝光仪(上海天能科技有限公司);荧光显微镜(日本Nikon公司)。
1.2 细胞培养、分组和药物处理
小鼠BV2细胞用含有10%胎牛血清和1.0%青、链霉素混合液配制的DMEM高糖培养基于37℃、5% CO2和饱和湿度培养箱中培养。将生长良好的BV2细胞悬液以3×107L-1接种于6孔培养板,或以2×107L-1接种于放有灭菌盖玻片的24孔板中。BV2细胞生长至约70%融合度时,用LPS联合IFN-γ诱导BV2细胞,构建拟神经炎症反应的小胶质细胞(microglia with analog neuroinflammation,MANF)模型。BV2细胞分为6组:细胞对照、ICA 10 μmol·L-1、模型及模型+ICA 5,10和20 μmol·L-1组。细胞对照和模型组加入DMEM高糖培养基,ICA组加入ICA 10 μmol·L-1,模型+ICA组分别加入ICA 5,10和20 μmol·L-1,孵育24 h;随后模型和模型+ICA组加入LPS 100 μg·L-1和IFN-γ 20 μg·L-1,细胞对照和ICA组用等体积培养基代替,孵育18 h;最后模型+ICA组加入相应浓度的ICA,其他各组加入等体积培养基,继续孵育24 h。处理结束后,吸取24孔板细胞上清进行Luminex多细胞因子检测,固定细胞后进行免疫荧光染色;提取6孔板细胞蛋白质进行Western印迹实验。
1.3 Luminex多细胞因子试剂盒检测细胞培养上清中lL-3,lL-5,lL-17和单核/巨噬细胞趋化因子11(monocyte/macrophage chemokine 11,CCL11)浓度
收集1.2中24孔板细胞上清液,每组4复孔,低温离心去除细胞颗粒备用。试剂盒平衡至室温,按使用说明书依次向微孔板中加入样品或标准品、蛋白微粒混合物、生物素-抗体检测试剂、链霉亲和素-PE制剂和洗涤缓冲液,室温摇床30 min。将微孔板置于磁力架上,清洗液清洗3次,每孔加入洗涤缓冲液100 μL,使微粒重新悬浮,在摇床上培养2 min。用Bio-Plex 200自动免疫分析仪检测细胞上清液中IL-3,IL-5,IL-17和CCL11浓度。
1.4 免疫荧光染色检测BV2细胞M1型和M2型细胞百分比
收集1.2中24孔板细胞,每组3复孔,加4%细胞固定液室温固定30 min,PBS洗涤3次,每次5 min;采用0.5% Triton X-100磷酸盐缓冲液(PBST)室温透膜 20 min,PBS 洗涤 3次,每次5 min;5%山羊血清37℃封闭30 min;加入大鼠抗人CD16/CD32单克隆抗体和兔抗人CD206多克隆抗体(稀释比1∶200)4℃孵育过夜;PBS洗涤3次,每次5 min;加Alexa Fluor 488山羊抗大鼠IgG(H+L)或Alexa Fluor 594山羊抗兔 IgG(H+L)多克隆抗体(稀释比1∶200)37℃孵育1 h;PBS洗涤3次,每次5 min,DAPI封片剂封片,拍照。绿色荧光表示CD16/CD32阳性,即M1型BV2细胞;红色荧光表示CD206阳性,即M2型BV2细胞。蓝色表示细胞核,即总细胞数。以绿色或红色与蓝色共标的细胞数除以蓝色细胞总数计算M1型或M2型BV2细胞百分比。
1.5 Western印迹法检测BV2细胞NLRP3炎症小体相关蛋白表达
收集1.2中6孔板细胞,每组3复孔,加入RIPA裂解液(含1%苯甲基磺酰氟和2%蛋白酶抑制剂)冰上裂解细胞,使用BCA蛋白定量试剂盒测定蛋白质浓度。10%和15% SDS-PAGE凝胶电泳,恒流400 mA转膜至PVDF膜,5%脱脂奶粉室温摇床封闭1 h,加入兔抗小鼠NLRP3蛋白(1∶1500)、小鼠抗人ASC(1∶500)、小鼠抗人胱天蛋白酶1(1∶500)和小鼠抗人GAPDH(1∶5000)单克隆抗体,4℃孵育过夜。TBST洗涤3次,每次8 min;加入辣根过氧化物酶标记山羊抗兔IgG(H+L)和山羊抗小鼠IgG(H+L)多克隆抗体(二抗,1∶2000)室温孵育1 h。TBST洗涤3次,每次8 min,加入发光液,曝光。以待测蛋白与内参蛋白GAPDH条带积分吸光度比值表示待测蛋白相对表达水平。
1.6 统计学分析
实验结果数据以±s表示,采用SPSS 22和GraphPad Prism 8.0软件进行数据处理和统计学分析。免疫荧光染色结果采用Image J软件进行统计学分析。组间比较采用单因素方差分析,两组间比较采用LSD检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 lCA对MANF模型炎症因子分泌的影响
如表1所示,与细胞对照组相比,ICA组细胞上清中IL-3,IL-5,IL-17和CCL11水平无明显变化,模型组均显著升高(P<0.01)。与模型组相比,模型+ICA 5 μmol·L-1组上述细胞因子水平无明显变化;模型+ICA 10 μmol·L-1组除IL-5降低(P<0.05)外,其他均无明显变化;模型+ICA 20 μmol·L-1组上述细胞因子水平均显著下降(P<0.05,P<0.01)。
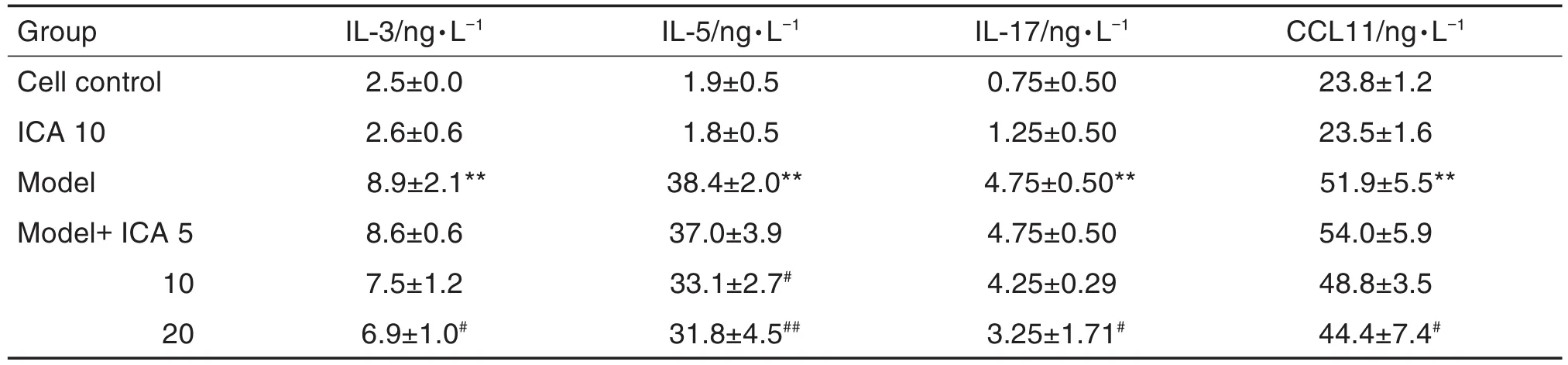
Tab.1 Effect of icariin(lCA)on secretion of interlukin-3(lL-3),lL-5,lL-17 and monocyte/macrophage chemokine 11(CCL11)in microglia with analog neuroinflammation(MANF)model
2.2 lCA对MANF模型M1和M2型细胞百分比的影响
图1结果显示,与细胞对照组相比,ICA组CD16/CD32和CD206阳性细胞百分比无明显变化;模型组CD16/CD32阳性细胞百分比明显增加(P<0.01),CD206阳性细胞百分比显著减少(P<0.01),提示拟神经炎症反应的BV2细胞向M1型炎症表型极化。与模型组相比,模型+ICA 5 μmol·L-1组CD16/CD32阳性细胞百分比无明显变化,CD206阳性细胞百分比明显增加(P<0.05);模型+ICA 10和20 μmol·L-1组 CD16/CD32阳性细胞百分比减少(P<0.01),CD206阳性细胞百分比显著增多(P<0.01),提示拟神经炎症反应的BV2细胞向M2型极化。
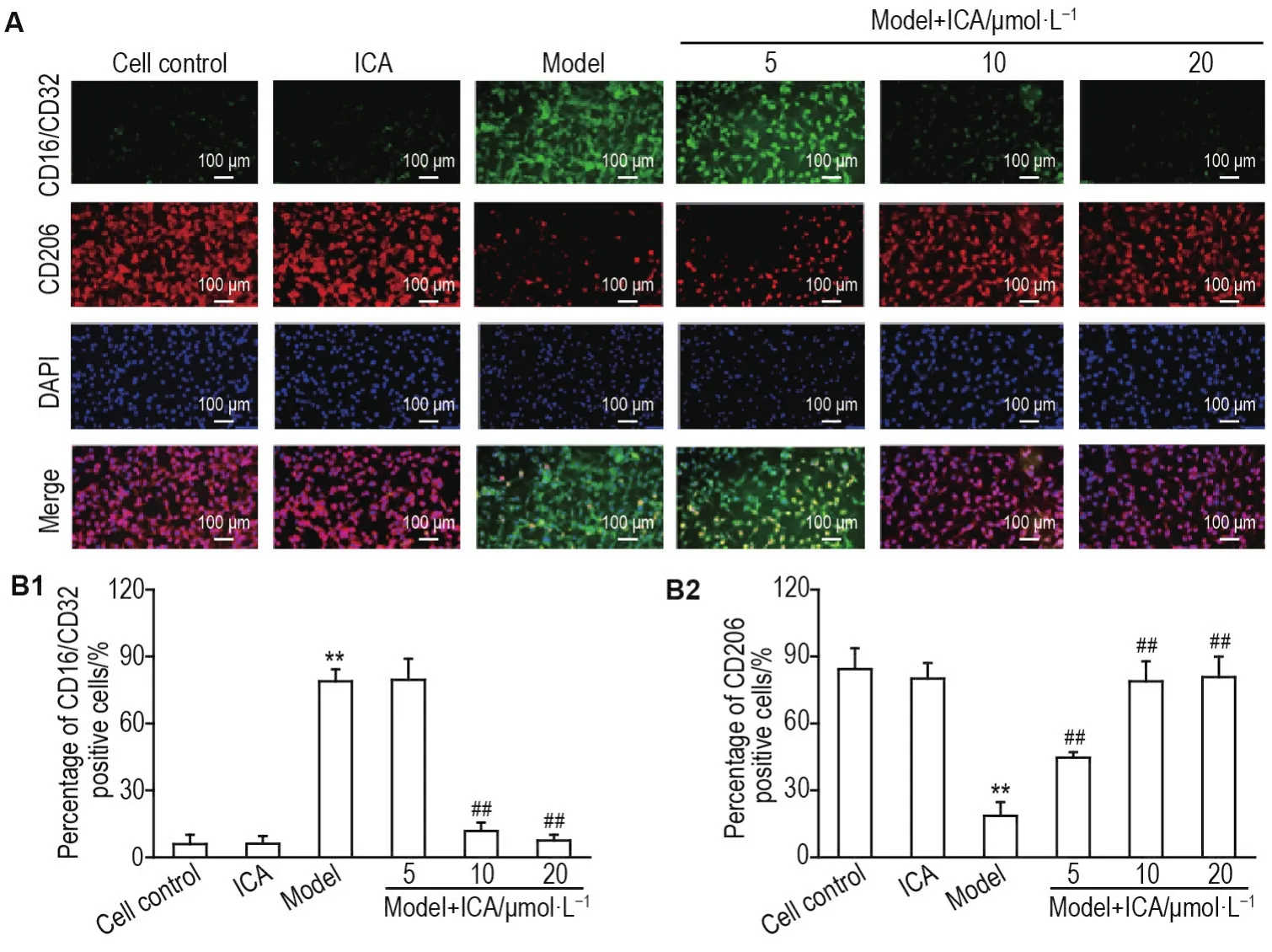
Fig.1 Effect of lCA on percentage of M1 and M2 types BV2 cells of MANF model detected by immunofluorescence staining.See Tab.1 for the cell treatment.A:the representative fluorescence image of BV2 cell phenotypes,green fluorescence represents CD16/CD32 positive cells and red fluorescence represents CD206 positive cells;B1(the percentage of CD16/CD32 positive cells)and B2(the percentage of CD206 positive cells)were the semi-quantitative results of A.x±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with model group.
2.3 lCA对MANF模型NLRP3炎症小体相关蛋白表达的影响
Western印迹结果(图2)显示,与细胞对照组相比,ICA组NLRP3、ASC、胱天蛋白酶1和胱天蛋白酶原1蛋白表达均无明显变化;模型组NLRP3、ASC和胱天蛋白酶1蛋白表达增多(P<0.05,P<0.01),胱天蛋白酶原1蛋白表达明显减少(P<0.05);与模型组相比,模型+ICA 5,10 和 20 μmol·L-1组NLRP3、ASC和胱天蛋白酶1蛋白的表达均显著降低(P<0.05,P<0.01),胱天蛋白酶原1表达无明显改变。
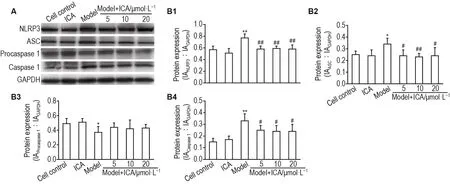
Fig.2 Effect of lCA on protein expressions of Nod-like receptor family protein 3(NLRP3),apoptosis-associated speck-like protein(ASC),procaspase 1 and caspase 1 in MANF model detected by Western blotting.See Tab.1 for the cell treatment.IA:integrated absorbance.B1,B2,B3 and B4 were the semi-quantitative results of A,respectively.±s,n=4.*P<0.05,**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with model group.
3 讨论
炎症因子的过表达是脑炎症损伤病理的经典特征,其中CCL11吸引免疫细胞到炎症反应部位[22],IL-3和IL-5刺激参与T细胞和B细胞增殖和分化[23-24],IL-17可促使IL-6和细胞黏附分子1等炎症因子的合成和释放[25],从而使炎症反应持续。本研究用LPS联合IFN-γ诱导BV2细胞,构建MANF模型。研究结果表明,与细胞对照组相比,细胞+ICA组细胞上清中IL-3,IL-5,IL-17和CCL11水平无明显变化,模型组均显著升高;ICA 20 μmol·L-1可使MANF模型细胞上述细胞因子水平明显降低,提示ICA可抑制BV2细胞神经炎症反应。
正常情况下,小胶质细胞处于静息状态。神经系统受到内在或外来炎症损伤初期,小胶质细胞向M2型极化以发挥抗炎保护作用;随着损伤程度加深,小胶质细胞则表现向M1型促炎表型极化,进一步加深神经系统炎症。CD16/CD32是促炎型小胶质细胞M1型表型标志物,CD206是抑炎型小胶质细胞M2型表型标志物。本研究结果表明,与细胞对照组相比,ICA对BV2细胞CD16/CD32和CD206阳性细胞百分比无明显影响;MANF模型组CD16/CD32阳性细胞百分比明显增加,CD206阳性细胞百分比显著减少,提示MANF模型细胞向M1型炎症表型极化。与模型组相比,ICA 10和20 μmol·L-1可使MANF模型细胞CD16/CD32阳性细胞百分比明显减少,CD206阳性细胞百分比显著增加,表明ICA可使MANF模型细胞向M2型抗炎表型极化。
MS进程中存在NLRP3炎症小体的激活。炎症发生初期,小胶质细胞呈现M2型,此时NLRP3激活以抵御外界炎症损伤,维持中枢功能平衡;疾病后期,NLRP3大量激活,M1型小胶质细胞占主导地位。NLRP3炎症小体是以NLR3蛋白为受体蛋白、胱天蛋白酶作为效应蛋白(effector)、ASC为接头蛋白的复合体。炎症发生时,炎症因子分泌增多可刺激NLRP3和ASC表达增加,使胱天蛋白酶原1转为成熟的胱天蛋白酶1,进一步加重炎症反应。本研究结果表明,与细胞对照组相比,ICA对BV2细胞NLRP3、ASC、胱天蛋白酶1和胱天蛋白酶原1蛋白表达均无明显影响;模型组NLRP3、ASC和胱天蛋白酶1蛋白表达增多,胱天蛋白酶原1蛋白表达明显减少;ICA 5,10 和 20 μmol·L-1可使 MANF模型细胞NLRP3、ASC和胱天蛋白酶1蛋白表达减少,提示ICA发挥抗炎作用可能与其抑制NLRP3炎症小体相关蛋白表达有关。
综上所述,ICA可明显改善LPS和IFN-γ联合诱导的MANF模型细胞炎症反应,有较好的抑制神经炎症的作用。据报道,ICA可通过靶向核因子E2相关因子2信号通路抑制小胶质细胞介导的神经炎症反应[18]。因此,需开展动物实验研究,对ICA改善神经炎症反应的作用机制进行深入探索。
