2周重复给予重组全人源抗新型冠状病毒单克隆抗体2B11注射液未导致恒河猴出现毒性反应
2022-06-13周建花敬兆飞潘勇兵
周建花,桂 芳,张 囡,敬兆飞,乐 鑫,潘勇兵
(武汉生物制品研究所有限责任公司抗体研究室,湖北 武汉 430207)
自2019年12月首次报告新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARSCoV-2)感染病例以来[1],新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)疫情已引起全球大流行。COVID-19的大流行,对全球人类健康、社会生活方式以及经济发展带来了巨大影响,迫切需要安全有效的防治手段。具备中和活性的单克隆抗体(单抗)具有靶点明确、特异性好、安全性高、便于大规模制备等优势,成为COVID-19疫情防控研究的热点。目前,抗SARS-CoV-2中和抗体药物的研发进展迅速,国内外已有多款抗体药物获批上市或处于Ⅲ期临床阶段。如腾盛博药医药技术有限公司的BRⅡ-196/BRⅡ-198单抗组合和韩国Celltrion生物制药公司的CT-P59[2]分别在中国和欧盟获批上市,美国礼来制药公司的LY-CoV555[3]/LYCoV016[4]、美国再生元制药公司的 REGN-COV2[5](REGN10933/REGN10987单抗组合)、美国Vir制药公司和英国葛兰素史克公司联合开发的VIR-7831[6]以及英国阿斯利康制药公司的 AZD7442[7](AZD8895/AZD1061单抗组合)等中和单抗均处于Ⅲ期临床阶段,且已取得美国FDA的紧急使用授权。
本实验室研发的重组全人源抗SARS-CoV-2单克隆抗体(代号2B11)通过噬菌体展示技术筛选获得,体内外研究结果均显示,其对SARS-CoV-2具有非常高的中和活性[8],在用于COVID-19的短期预防及早期治疗方面具有较大的临床应用前景。在完成非临床药学研究的基础上,采用中试规模反应器进行CHO细胞培养制备单抗,并依据相关法规及指导原则[9-13]用恒河猴进行2周重复给药毒性实验,观察其可能引起的毒性反应,包括毒性反应的性质、程度、剂量-反应关系、时间-反应关系和可逆性等,判断毒性靶器官或靶组织,确定无毒性反应的安全剂量;同时测定不同时间点恒河猴体内的血药浓度,观察恒河猴iv给予2B11注射液的给药剂量、给药时间与重复给药毒性之间的关系,为开展相关临床研究提供参考。
1 材料与方法
1.1 药品、试剂和主要仪器
2B11注射液(20 mg·mL-1,批号202012002),本研究室提供;溶媒对照品0.9%氯化钠注射液(批号200327521和200612523),武汉福星生物药业有限公司。
戊巴比妥钠,德国默克公司;RBD-His蛋白,北京义翘神州科技股份有限公司;淋巴细胞亚群和细胞因子Cytometric Bead Array(CBA)试剂盒,美国BD公司;免疫球蛋白、补体和循环免疫复合物(circulating immunocomplex,CIC)检测试剂盒,瑞士罗氏公司;TMB显色液,湖州英创生物科技有限公司;辣根过氧化物酶标记的山羊抗人IgG(H+L),美国BETHYL公司;硫酸,国药集团化学试剂有限责任公司;阳性对照血清(兔抗2B11多克隆抗体血清)和恒河猴阴性血清,湖北天勤生物科技有限公司提供;辣根过氧化物酶标记的2B11单抗,本研究室提供。
手持式裂隙灯(HSL150),德国海尼公司;检眼镜(YZ11D),苏州六六视觉科技股份有限公司;血压计(BP-2010E),北京软隆生物技术有限公司;动物心电图机(ECG-1103GVET),深圳市凯沃尔电子有限公司;全自动模块式血液体液分析仪(XN-1000IV)和全自动生化分析仪(BX-3010),日本希森美康公司;全自动凝血分析仪(ACLTO-P300-CTS),美国沃芬集团;多参数电解质分析仪(Klite8G),广东康立公司;干化学尿液分析仪(H800),长春迪瑞医疗科技股份有限公司;流式细胞仪(BD FACS Calibur),美国BD公司;酶标仪(Bio-Rad),美国Bio-Rad公司。
1.2 动物、分组和给药
普通级恒河猴,体重3.04~4.90 kg,年龄3~5岁,雌雄各半,湖北天勤生物科技有限公司;实验动物生产许可证号:SCXK(鄂)2016-0010;实验动物质量合格证号:No.421218300000129和No.4212-18300000133;实验动物使用许可证号:SYXK(鄂)2016-0090;本实验所涉及的动物管理、使用和相关操作均经过湖北天勤生物科技有限公司实验动物管理和使用委员会审核与批准,批准文号:IACUC(准)-2020-160。
选取30只健康恒河猴,随机分成3组,每组10只,雌雄各半。溶媒对照组给予0.9%氯化钠注射液,实验组分别给予2B11 100和400 mg·kg-1。首次给药前2 d定义为-D2,给药首天定义为D1,依此类推。每隔6天iv给药1次,分别在D1、D8和D15给药,2周共给药3次,给药体积为20 mL·kg-1。给药结束后(D23)每组解剖雌雄恒河猴各3只;剩余每组雌雄各2只,恢复9周,恢复期结束后(D78)解剖。
1.3 一般症状观察及体重、体温和摄食量检测
给药后每天进行外观体征、行为活动、姿势、饮食、被毛、刺激反应、腺体分泌物、排泄物、呼吸状态和死亡数等一般症状观察;-D2,D7,D14,D21,D28,D35,D42,D49,D56,D63,D70和D77对各组恒河猴称量体重;-D2,D1,D8,D15和D77对各组恒河猴进行体温测量(肛温);记录实验期间摄食量。
1.4 眼科检查、血压和心电指标检测
-D2,D21和D77用手持式裂隙灯和检眼镜分别对各组所有动物进行眼睑、结膜、角膜、瞳孔和虹膜等眼科检查;-D2,D8,D15和D77分别对各组恒河猴收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)和平均动脉压(mean arterial pressure,MAP)等血压指标检测及心率(heart rate,HR)、QRS时限、Q-T间期和P-R间期等心电指标进行检测。
1.5 血常规、止凝血、血液生化、电解质及尿液一般指标检测
-D1,D22和D78采集全血进行血常规、止凝血、血液生化、电解质及尿液一般指标检测。使用血液体液分析仪检测全血中白细胞(white blood cell,WBC)数、红细胞(red blood cell,RBC)数、血红蛋白(hemoglobin,HGB)、红细胞 压积(hematocrit,HCT)、平均红细胞血红蛋白量(mean corpuscular hemoglobin,MCH)和平均红细胞体积(mean corpuscular volume,MCV)等血常规指标。使用凝血分析仪检测血清中部分凝血活酶时间(activated partial thromboplastin time,APTT)、血浆凝血酶原时间(prothrombin time,PT)、血浆凝血酶时间(thrombin time,TT)和纤维蛋白原(fibrinogen,FIB)等止凝血指标。使用多参数电解质分析仪和生化分析仪检测血清中葡萄糖(glucose,GLU)、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TCHO)、碱性磷酸酶(alkaline phosphatase,ALP)和Cl-等血液生化及电解质指标。
分别于-D1,D21和D77对尿液颜色进行观察,并使用干化学尿液分析仪进行透明度、尿糖和尿蛋白等尿液指标检测。
1.6 脏器系数和组织病理检测
用戊巴比妥钠麻醉恒河猴后解剖,肉眼观察脏器是否有异常。然后进行脏器系数检测,称重并计算脏器系数的脏器有脑、心、肝、肾、子宫、卵巢和睾丸等。最后用HE染色进行组织病理检测。
1.7 免疫学指标检测
1.7.1 淋巴细胞亚群、免疫球蛋白、补体及ClC水平检测
分别于-D1,D22和D78进行淋巴细胞亚群、免疫球蛋白、补体及CIC检测。按照淋巴细胞亚群检测试剂盒的说明书进行操作,对全血中CD3+,CD4+,CD8+,CD20+和 CD16+等分子进行染色,然后使用流式细胞仪检测T、B、NK淋巴细胞亚群(CD3+,CD3+CD4+,CD3+CD8+,CD3-CD20+和CD3-CD16+)的百分比及 CD3+CD4+/CD3+CD8+比值。分别按照免疫球蛋白、补体和CIC检测试剂盒的说明书进行操作,使用生化分析仪检测血清中免疫球蛋白(IgA,IgG和IgM)和补体(C3和C4)含量,使用酶标仪检测血清中CIC含量。
1.7.2 细胞因子水平检测
分别于-D1,D1给药后2和24 h,D22和D78进行血清细胞因子检测。按照CBA试剂盒的说明书进行操作,将血清与有特定荧光强度的CBA微球进行共孵育,然后加入荧光标记的检测试剂形成复合物,使用流式细胞仪检测白细胞介素2(interleukin 2,IL-2)、IL-4、IL-5、IL-6、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)和干扰素 γ(interferon γ)等细胞因子水平。
1.8 抗药抗体(anti-drug antibody,ADA)浓度检测
分别于-D1,D8,D15,D22,D29,D36,D50,D57和D78,采用桥联-ELISA法检测血清中ADA浓度。2B11注射液稀释至5 mg·L-1包被于酶标板中,用醋酸0.6 mol·L-1酸化处理待检血清、阳性对照血清(兔抗2B11多克隆抗体血清)和恒河猴阴性血清,待血清中ADA和药物复合物解离后加入酶标板,与2B11抗体结合,洗板去除未结合的抗体和其他成分。再进行酸化处理,使ADA与2B11的结合解离,将ADA重新包被于另一块酶标板上,与辣根过氧化物酶标记的2B11单抗结合,洗涤后加入TMB显色液进行显色反应,终止反应后用酶标仪在450 nm波长处测定吸光度(A450nm)值。
为避免外界环境因素对实验结果的影响,本实验所有孔均设复孔,并采用信噪比(signal noise ratio,SNR)替代A450nm值计算所有参数,SNR=待检血清或阳性对照血清A450nm均值/阴性血清A450nm均值。经方法学验证,筛选阈值(screening cut point,SCP)的SNR为1.195,阳性对照血清SNR>1.589,阴性血清A450nm<0.085。若待检血清的SNR≥SCP,则表示该样本为阳性,反之则为阴性。
1.9 毒代动力学(toxicokinetics,TK)参数检测
溶媒对照组分别在D1和D15给药前0 h及给药后2 h,2B11 100和400 mg·kg-1组D1给药前(0 h)及给药结束后0.167,2,8,24,72,120和168 h,D8给药前(0 h)及给药后2 h,D15给药前(0 h)及给药结束后0.167,2,8,24,72,120和168 h采血并分离血清,采用配体结合ELISA法检测其血药浓度。RBD-His抗原稀释至1 mg·L-1包被于酶标板中,与2B11单抗或待测血清中的2B11结合,然后与辣根过氧化物酶标记的山羊抗人IgG抗体结合,显色并终止后测定A450nm值。制备标准曲线,代入标准曲线方程计算血清中2B11浓度,用GraphPad Prism8.0.1软件拟合药物浓度-时间曲线,用Phoenix WinNonlin软件非房室模型计算毒代动力学参数,对最大血药浓度(Cmax)、达峰时间(Tmax)和药物浓度-时间曲线下面积(AUC0-t)等毒代动力学参数进行评估。
1.10 统计学分析
采用SPSS 21.0软件进行统计学分析,当样本量≤2时,仅列出个体数据,不进行统计;计量资料,如体重、血常规、止凝血、血液生化和电解质等,进行单因素方差分析,组间两两比较采用t检验;计数资料采用卡方检验;等级资料采用Kruskal-WallisH检验,总体差异有统计学意义时用Mann-WhitneyU检验进行组间差异的比较;P<0.05表示差异具有统计学意义。
2 结果
2.1 恒河猴一般症状、体重、摄食量和体温变化
实验期间,2B11 2个剂量组恒河猴无死亡,恒河猴外观体征、行为活动、姿势、饮食、被毛、刺激反应、腺体分泌物、排泄物和呼吸状态等均未见明显异常,体重无明显变化,亦未出现摄食量减少情况。与溶媒对照组比较,D15 2B11 100和400 mg·kg-1组雄性恒河猴体温均升高(P<0.01),D77各组雌雄恒河猴体温未见明显趋势性改变(表1)。上述指标的改变轻微或在正常值范围内,不具有毒理学意义。
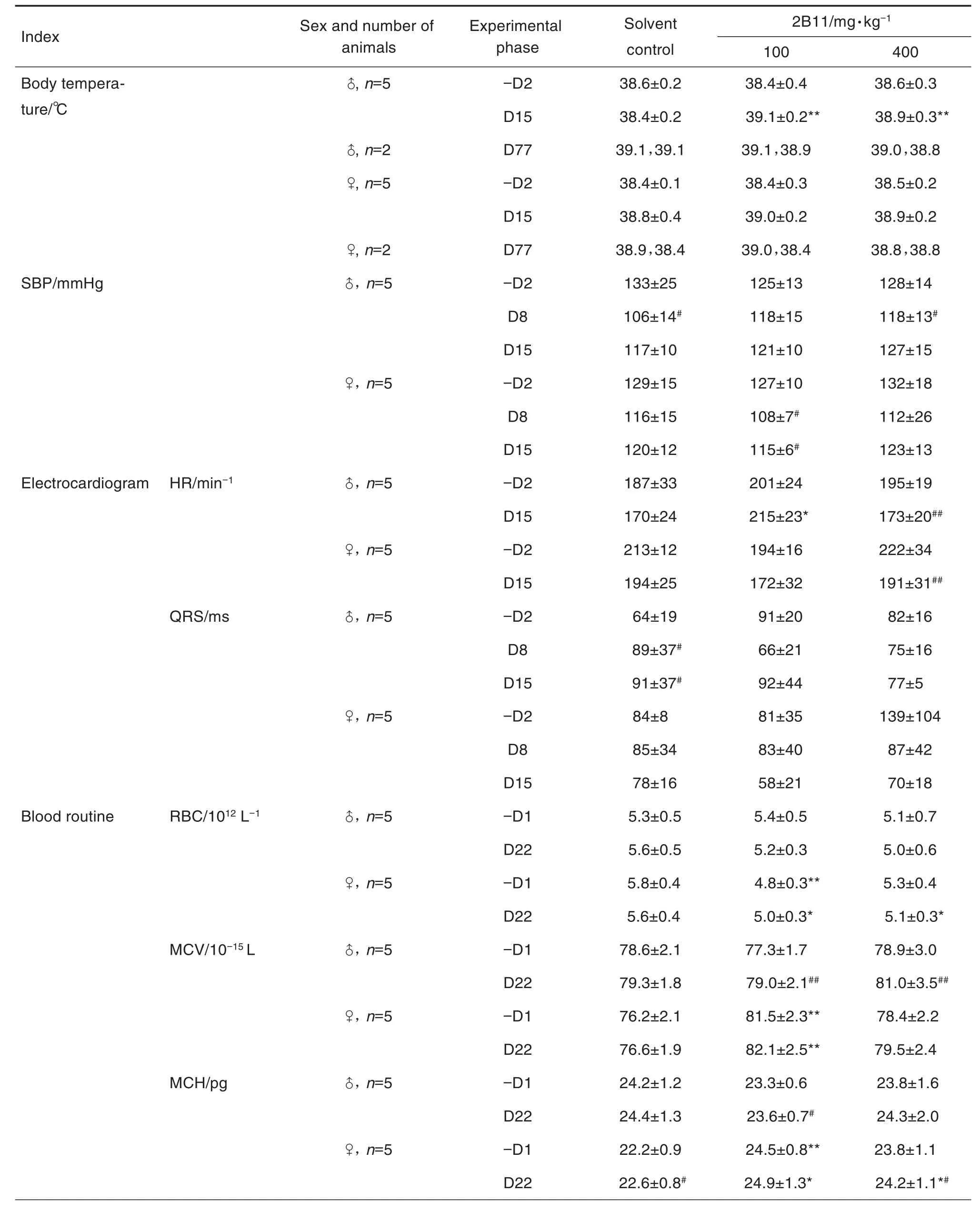
Tab.1 Effect of 2-week repeated administration toxicity test of 2B11 injection on body temperature,blood pressure,electrocardiogram,blood routine,anticoagulation,blood biochemistry and electrolytes of rhesus monkeys
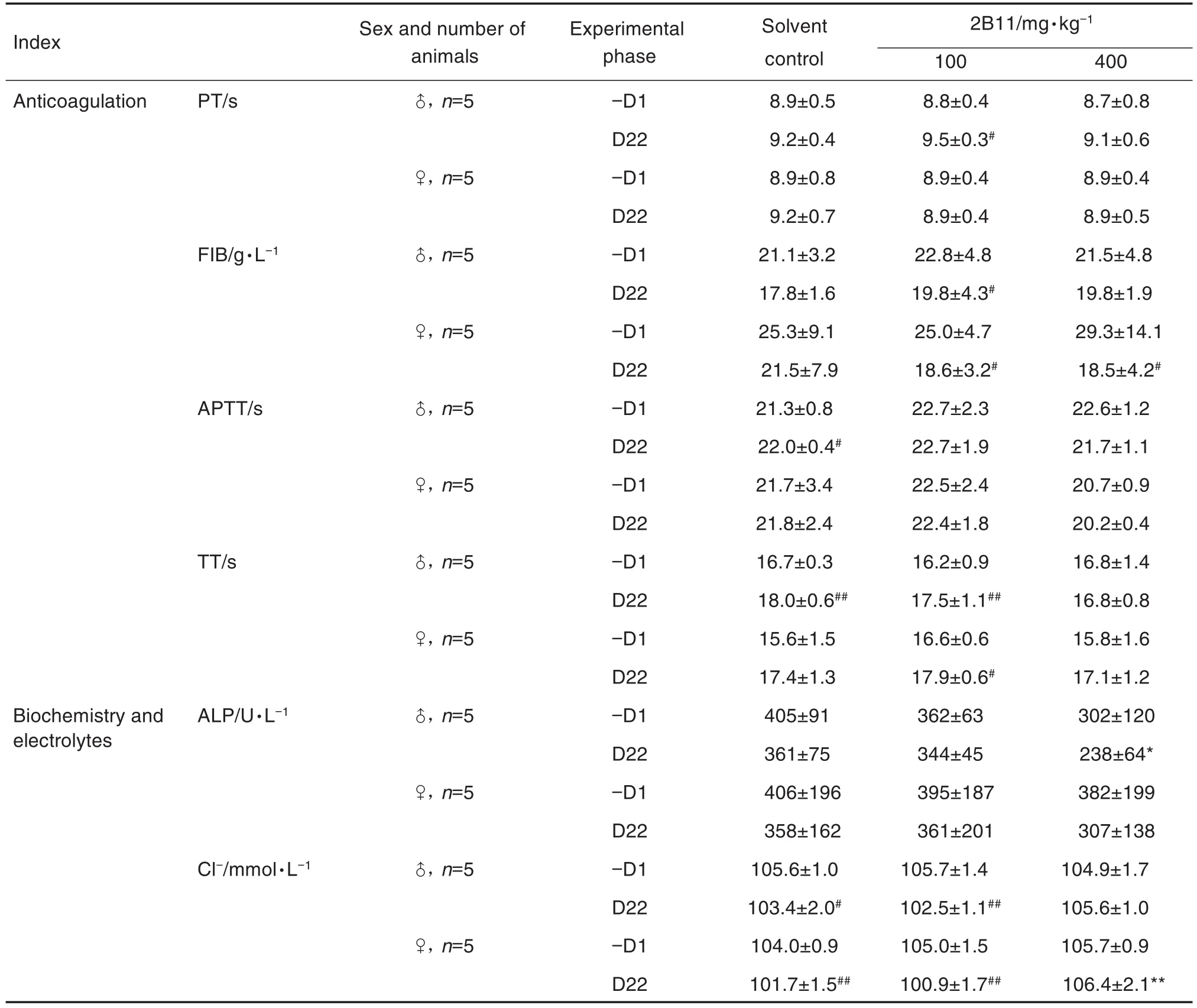
Tab.1(continued)
2.2 眼科检查、血压和心电图变化
实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴眼科检查及血压指标DBP和MAP未见明显变化。与同组给药前比较,D8溶媒对照组和400 mg·kg-1组雄性恒河猴SBP显著降低(P<0.05);D8和D15,100 mg·kg-1组雌性恒河猴SBP降低(P<0.05)(表1)。SBP波动范围较小(7.8%~20.3%),无明显剂量-反应关系或时间-反应关系,与同期溶媒对照组比较均无统计学差异,故可认为上述血压指标的变化不具有毒理学意义。
实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴Q-T间期和P-R间期心电指标未见明显变化。与同期溶媒对照组相比,D15 100 mg·kg-1组雄性恒河猴HR显著升高(P<0.05)。与同组给药前相比,400 mg·kg-1组雌雄恒河猴HR降低(P<0.01);D8和D15,溶媒对照组雄性恒河猴QRS时限均显著升高(P<0.05)(表1)。与给药前比较,溶媒对照组心电指标虽变化幅度较大,但因未给予受试物,考虑为动物正常的生理性波动;D15,100和400 mg·kg-1组恒河猴的HR变化幅度较小,且无明显剂量-反应关系,与同期溶媒对照组比较均无统计学差异。
2.3 血常规、止凝血、血液生化、电解质及尿液一般指标变化
实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴WBC,HGB和HCT等血液学指标未见明显变化。D22,与同期溶媒对照组比较,100 mg·kg-1和400 mg·kg-1组雌性恒河猴RBC均降低(P<0.05),MCH均升高(P<0.05),100 mg·kg-1组雌性恒河猴MCV升高(P<0.05)。与同组给药前比较,100和400 mg·kg-1组雄性恒河猴MCV均升高(P<0.01),100 mg·kg-1组雄性恒河猴和400 mg·kg-1组雌性恒河猴MCH升高(P<0.05)(表1)。以上血常规指标的变化虽然具有统计学意义(P<0.05,P<0.01),但与同期溶媒对照组比较,给药前(-D1)100 mg·kg-1组雌性恒河猴RBC,MCV和MCH已存在统计学差异(P<0.01),且这些指标均在小范围内波动,无明显剂量-反应关系。
实验期间,与同期溶媒对照组比较,2B11 2个剂量组雌雄恒河猴APTT,PT,TT和FIB等止凝血指标均无明显变化。D22,与同组给药前比较,溶媒对照组雄性恒河猴APTT和TT均升高(P<0.05),100 mg·kg-1组雄性恒河猴PT和TT均升高(P<0.05),FIB降低(P<0.05);100 mg·kg-1组雌性恒河猴TT升高(P<0.05),100和400 mg·kg-1组雌性恒河猴FIB均降低(P<0.05)(表1)。与给药前比较,溶媒对照组雄性恒河猴APTT和TT均升高,虽变化幅度较大,但溶媒对照组恒河猴仅给予氯化钠注射液;100和400 mg·kg-1组其他止凝血指标虽变化幅度较大,但与同期溶媒对照组比较均无统计学差异,且无明显剂量-反应关系。
实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴GLU,TG和TCHO等血液生化及电解质指标均无明显变化。D22,与同期溶媒对照组比较,400 mg·kg-1组雄性恒河猴ALP降低(P<0.05),雌性恒河猴Cl-浓度升高(P<0.01)。与同组给药前比较,溶媒对照组和100 mg·kg-1组雄雌恒河猴Cl-浓度降低(P<0.05)(表1)。400 mg·kg-1组雄性恒河猴ALP变化幅度较大(34.1%),但单纯的ALP降低,其他指标无异常,可认为单纯的ALP降低无明确毒理学意义;400 mg·kg-1组雌性恒河猴和100 mg·kg-1组雄雌性恒河猴Cl-变化幅度较小。
实验期间,与溶媒对照组比较,2B11 2个剂量组送检尿液样本外观均为正常的黄色或淡黄色的澄明液体,各尿液指标未见明显异常的规律性变化。
2.4 脏器系数和组织病理变化
D22和D78,与溶媒对照组比较,2B11 2个剂量组恒河猴脏器重量和系数均无明显变化。
D22,与溶媒对照组比较,2B11 2个剂量组恒河猴未见与给药相关的病理改变(部分病理图结果见图1),仅有部分恒河猴可观察到常见的自发性背景性病变(病变总结见表2)。如肉眼可见雄性恒河猴生殖系统(睾丸、附睾、前列腺及精囊腺)体积小,组织病理学观察见其未发育成熟,但是这些指标与动物年龄和生长发育相关;少数恒河猴肉眼可见脑表面颜色呈淡黄色,脑组织与硬脑膜粘连,组织病理学观察见大脑脑膜纤维结缔组织轻度增生,这些自发性背景性病变均与受试物不相关。溶媒对照组和2B11 2个剂量组部分恒河猴出现了一些轻微或轻度病理改变,溶媒对照组(3/6)和100 mg·kg-1组(1/6)肾组织轻微或轻度局灶炎症细胞浸润;溶媒对照组(2/6)和400 mg·kg-1组(2/6)给药局部血管周围结缔组织成纤维细胞轻微或轻度增生。溶媒对照组未出现但100 mg·kg-1组恒河猴出现的一些轻微病理改变,如100 mg·kg-1组(1/6)肺轻微瘀血;(1/6)肺血管内见均质红染物,内含中性粒细胞;(1/6)腮腺局灶性炎症细胞轻微浸润,以淋巴细胞为主;(1/6)胃黏膜炎症细胞轻微浸润,以淋巴细胞为主。综上所述,上述病变镜下表现的程度均为轻微或轻度,各组间出现病变恒河猴的数量和病变程度未见明显差异,无明显剂量-反应关系。D78,与溶媒对照组相比,100和400 mg·kg-1组恒河猴各脏器均未见明显与给药相关的病理改变。
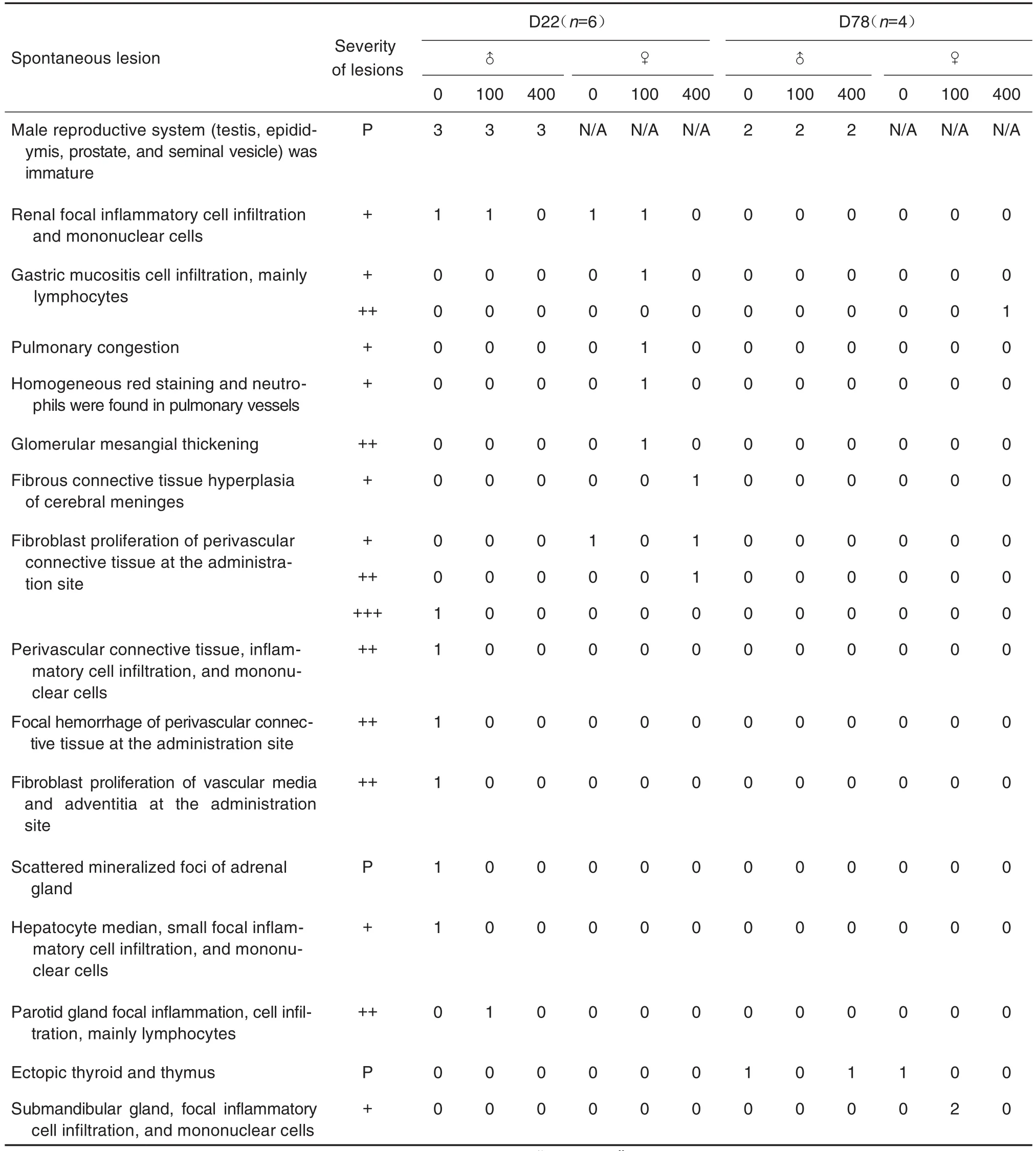
Tab.2 Summary of spontaneous lesions in rhesus monkeys after 2-week repeated administration of 2B11 injection
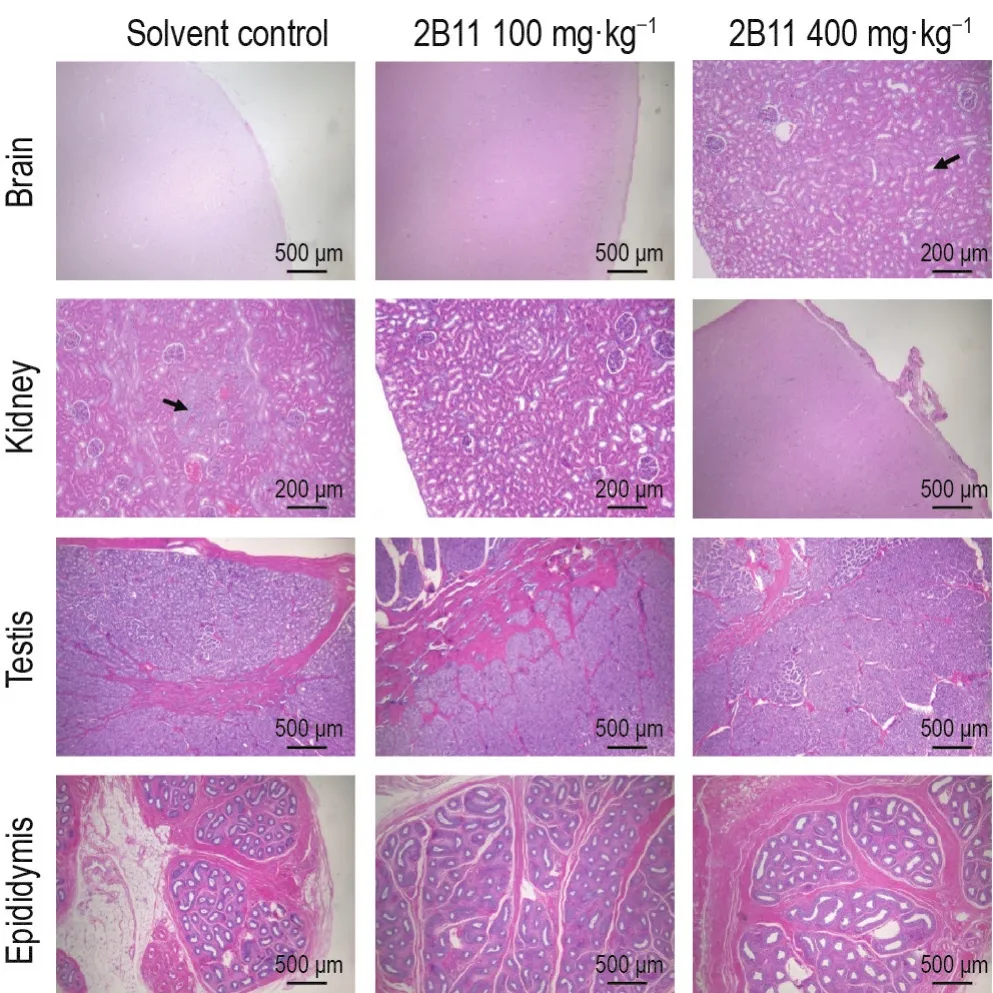
Fig.1 HE staining results of partial histopathological examination in rhesus monkeys after 2-week repeated administration toxicity test of 2B11 injection at D22.See Tab.1 for the animal treatment.Black arrows indicate where the tissue was diseased.Some animals in 400 mg·kg-1group had mild hyperplasia of cerebral meningeal fibrous connective tissue,while some in the solvent control group had slight or mild infiltration of focal inflammatory cells and mononuclear cells in the kidney.Reproductive systems(testis and epididymis)of some male animals were small in each group.
2.5 免疫学指标变化
2.5.1 淋巴细胞亚群(T、B和NK淋巴细胞亚群)水平
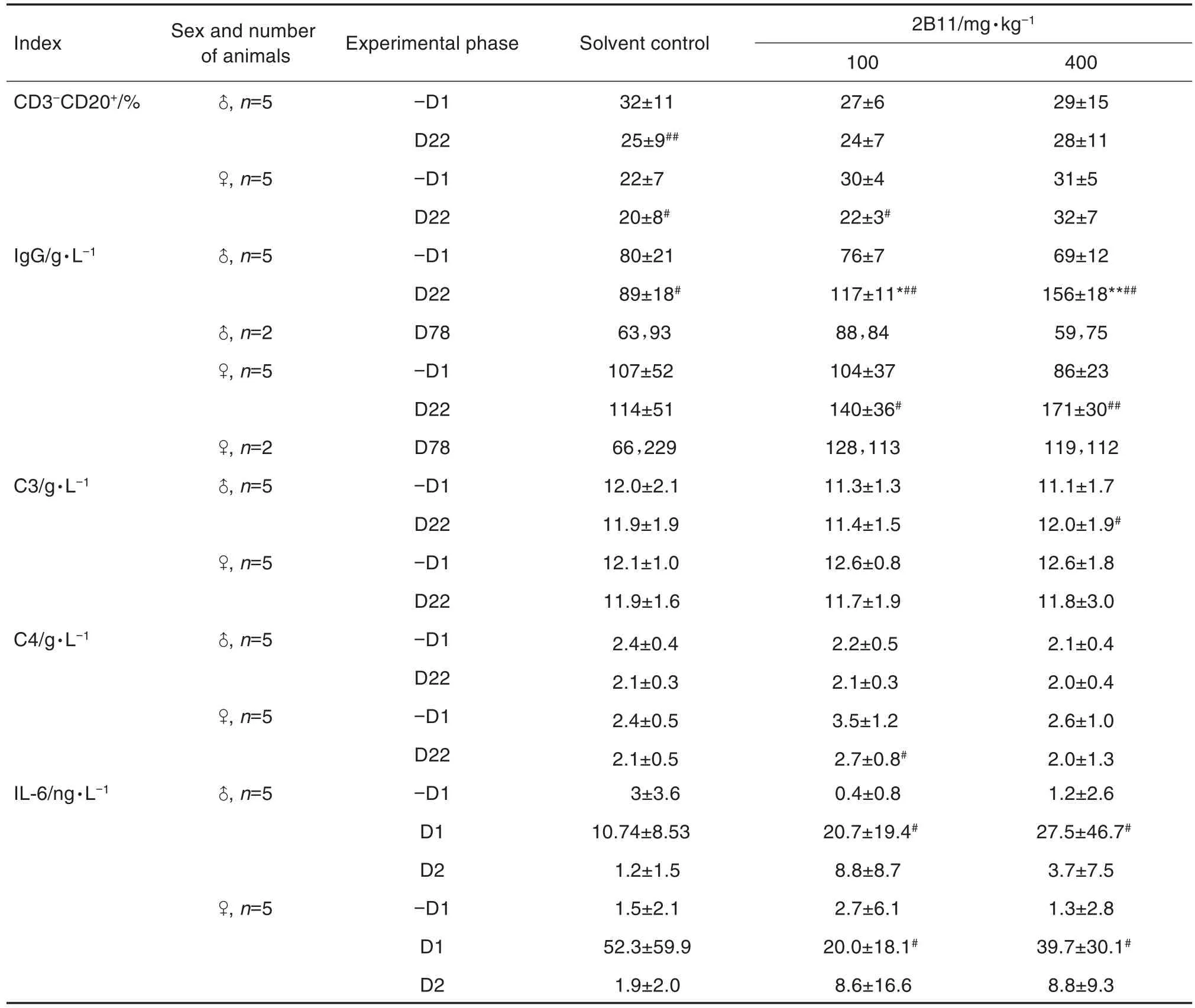
实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴 CD3+、CD3+CD4+、CD3+CD8+和 CD3-CD16+等淋巴细胞亚群百分比及CD3+CD4+/CD3+CD8+比值均无明显变化。D22,与同组给药前比较,溶媒对照组雌雄性恒河猴CD3-CD20+淋巴细胞亚群百分比降低(P<0.05),100 mg·kg-1组雌性恒河猴CD3-CD20+淋巴细胞亚群百分比降低(P<0.05)(表3)。因溶媒对照组仅给予氯化钠注射液,引起的范围波动认为是动物正常的生理性波动;100 mg·kg-1组雌性恒河猴CD3-CD20+淋巴细胞亚群百分比的变化无明显剂量-反应关系,且与同期溶媒对照组比较均无统计学差异。
Tab.3 Effects of 2-week repeated administration toxicity test of 2B11 injection on immunological of rhesus monkeys
2.5.2 免疫球蛋白水平
实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴IgA和IgM检测结果无明显变化。D22,与同期溶媒对照组比较,100和400 mg·kg-1组雄性恒河猴IgG含量升高(P<0.05);与同组给药前比较,溶媒对照组雄性恒河猴IgG含量升高(P<0.05),100和400 mg·kg-1组雌雄恒河猴IgG含量均升高(P<0.05)(表3)。溶媒对照组仅给予氯化钠注射液,前后差异认为是动物正常生理性波动;100和400 mg·kg-1组恒河猴IgG含量升高是由于2B11本身是一种免疫球蛋白(IgG),重复iv给予2B11注射液,会提高恒河猴体内IgG含量,随着给药期结束IgG含量也会降低。
2.5.3 补体和ClC水平
D22,与同组给药前比较,400 mg·kg-1组雄性恒河猴C3含量升高(P<0.05),100 mg·kg-1组雌性恒河猴C4含量降低(P<0.05)(表3)。上述补体含量的波动范围较小,且与同期溶媒对照组比较均无统计学差异,亦无明显剂量-反应关系,认为改变不具有毒理学意义。实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴CIC含量无明显变化。
2.5.4 细胞因子水平
实验期间,与溶媒对照组比较,2B11 2个剂量组恒河猴IL-2,IL-4,IL-5,TNF-α和IFN-γ等细胞因子含量无明显变化。D1给药后2 h,与同组给药前比较,10和400 mg·kg-1组雌雄恒河猴IL-6含量均升高(P<0.05);D1给药后24 h,IL-6含量均恢复正常(表3)。上述IL-6含量的变化可能与当天给予较大体积的受试物引起动物不舒适有关,且与同期溶媒对照组比较均无统计学差异。一过性IL-6含量升高考虑为动物免疫应激反应,认为上述变化不具有毒理学意义。
2.6 ADA浓度变化
ADA检测过程中,不同分析批阳性对照血清SNR>1.589,阴性血清A450nm<0.085。实验期间,2B11 2个剂量组恒河猴血清中ADA检测结果全部为阴性。
2.7 毒代动力学参数
D1,D8和D15给药后,100和400 mg·kg-1组恒河猴体内血药浓度-时间曲线见图2。D1,D8和D15给药后2 h,血浆药物浓度均比前一次给药后浓度高;D1和D15给药后,100和400 mg·kg-1组血浆药物浓度变化基本一致,且与给药剂量呈正比。
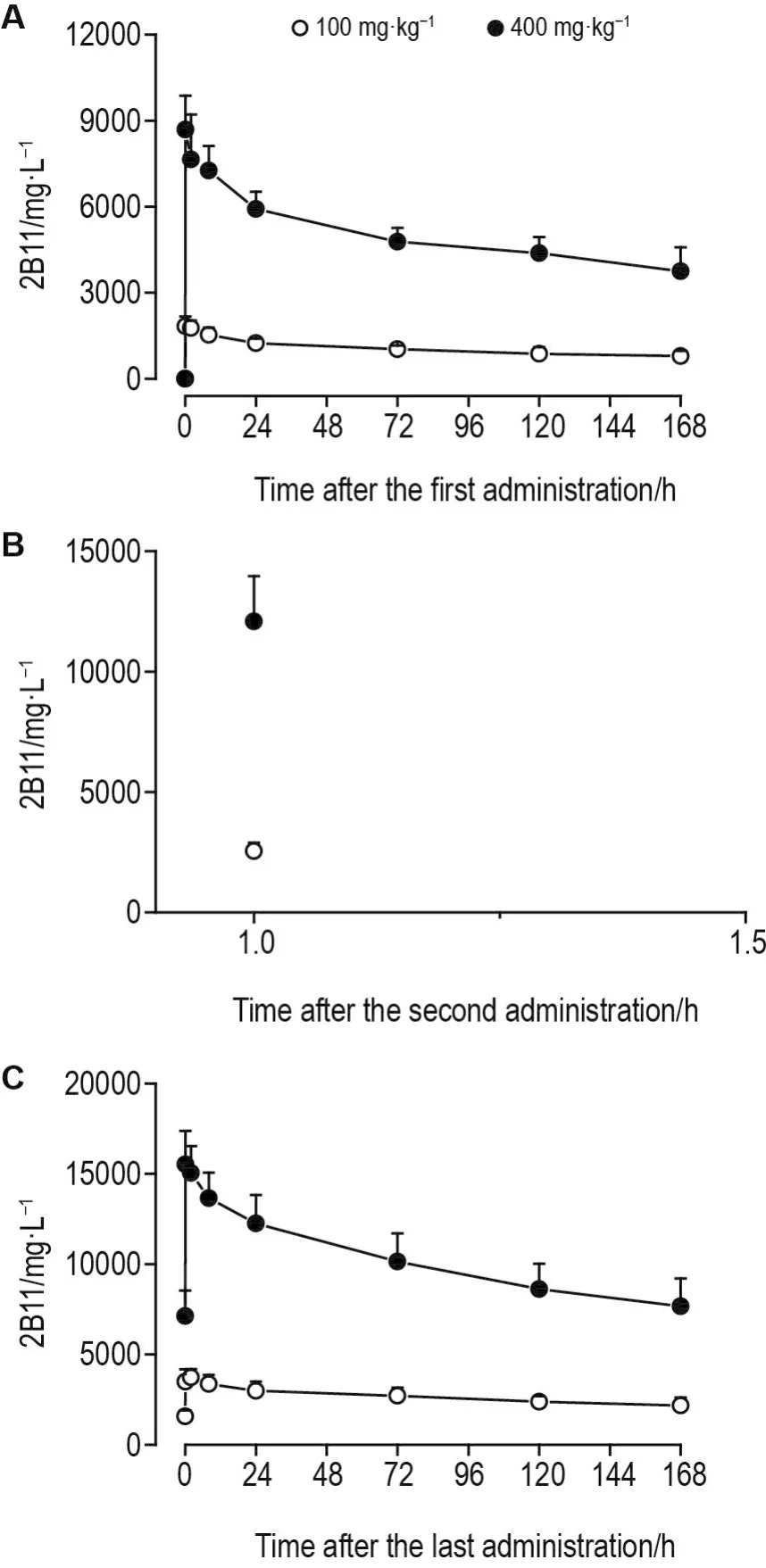
Fig.2 Plasma drug concentration-time curve of 2B11 injection in rhesus monkeys after 2-week repeated administration toxicity test.See Tab.1 for the animal treatment.A,B and C are plasma drug concentration-time curves after the D1,D8 and D15 administration,respectively.±s,n=10.
D1和D15给药后,100和400 mg·kg-1组恒河猴血药浓度达峰时间Tmax、峰浓度Cmax和AUC0-t值见表4。D1给药后,100和400 mg·kg-1组剂量比为1∶4,Cmax之比为1∶4.58,AUC0-t之比为1∶4.77;D15给药后,100 和400 mg·kg-1组剂量比为 1∶4,Cmax之比为1∶4.06,AUC0-t之比为 1∶3.81;D1和D15给药后,100 和400 mg·kg-1组Cmax之比、AUC0-t之比与给药剂量呈正比,2B11注射液在体内基本呈线性动力学特征。D15与D1给药后,100和400 mg·kg-1组Cmax的比值分别为2.07±0.41和1.82±0.25,AUC0-t的比值(蓄积因子)分别为2.59±0.50和2.03±0.14,认为2周内连续给药3次2B11后,2B11在恒河猴体内未表现出明显蓄积。
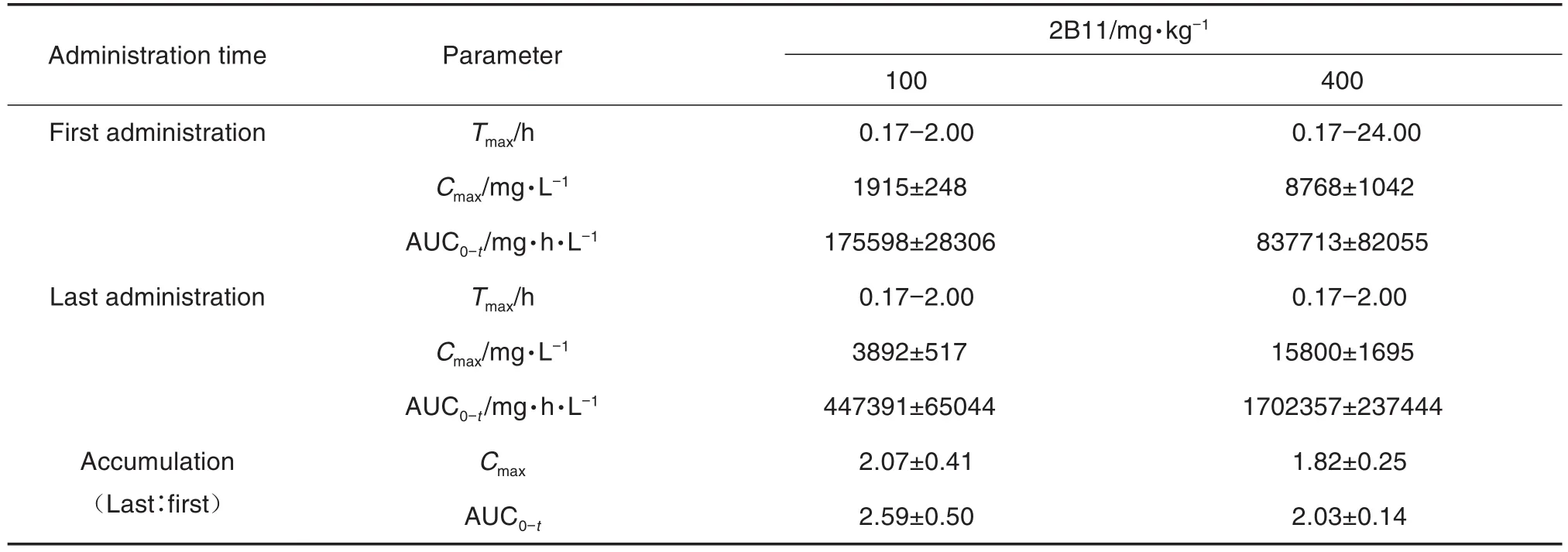
Tab.4 Mean toxicokinetic parameters of 2B11 injection in rhesus monkeys after 2-week repeated administration toxicity test
3 讨论
非临床安全性评价的主要目的包括确定人体安全起始剂量和后续剂量递增方案;确定潜在毒性靶器官,并研究该毒性是否可逆;确定临床监测的安全性指标,可用于解释人体研究启动前至整个临床开发过程中的药理学和毒理学作用[11]。重复给药毒性实验是临床前安全性评价的重要内容,可以确定未观察到临床不良反应的剂量水平(no observed adverse effect level,NOAEL),并推测第一次临床试验的起始剂量,为后续临床试验提供安全剂量范围[12]。
本实验给药期结束和恢复期结束,2B11 2个剂量组恒河猴一般症状观察、体重、摄食量、体温、眼科、血压、心电图、血常规、止凝血、血液生化及电解质、尿液、脏器系数、组织病理学和免疫学检测等指标均未见与受试物有关的明显改变。
剂量选择应能提供反映剂量-反应关系的信息,包括毒性剂量和NOAEL。本实验室前期对COVID-19易感的Ad5-hACE2小鼠模型体内进行药效学实验,评价了2B11对小鼠感染SARS-CoV-2的预防和治疗效果[8]。结果显示,与PBS对照组相比,给予2B11 75 mg·kg-1实验组,第6天预防组小鼠体重基本无下降,肺部病毒载量降低100倍以上;治疗组小鼠体重下降幅度较小,肺部病毒载量降低10倍以上。以上结果表明,2B11 75 mg·kg-1在Ad5-hACE2非转基因小鼠模型中能较大程度预防和治疗SARS-CoV-2感染。根据已进入临床阶段的抗SARS-CoV-2抗体药物实验方案[14-15],初步确定2B11临床最大拟用剂量为50 mg·kg-1,再结合恒河猴单次静脉给药初步的药动学和毒性预实验,以及2周重复静脉给药毒性预试验结果,最终确定本研究2B11注射液剂量分别为100(临床最大拟用剂量的2倍)和400 mg·kg-1(临床最大拟用剂量的8倍)。
ADA检测的主要干扰物质为药物本身,当ADA和药物以复合物的形式存在时,使测定信号值比实际偏低,通过酸解离可将ADA从复合物中解离,以降低复合物对结果的干扰[16-17]。本实验醋酸对样本的酸化处理可使样品的pH值处于可使ADA和药物复合物解离的状态,但又不影响ADA的检测[18],然后采用桥联ELISA对恒河猴体内ADA浓度进行检测。本实验2B11 2个剂量组恒河猴ADA均为阴性,考虑是动物给药剂量过大导致药物和ADA形成复合物使测定信号值偏低[19]。重复给药2周后,2B11注射液100和400 mg·kg-1组血浆药物浓度变化基本一致,峰浓度之比、暴露量之比与给药剂量呈正比,2B11注射液在恒河猴体内基本呈线性动力学特征。
综上认为,在本实验设定条件下,恒河猴2周重复iv给予2B11注射液是安全的。再结合2B11注射液对恒河猴的其他非临床安全性评价结果,如安全药理实验中,单次iv给予2B11 100和400 mg·kg-1,对恒河猴心血管及呼吸系统无明显影响;组织交叉反应实验中,生物素标记的2B11单抗1和10 mg·L-1与人和恒河猴的34种冰冻组织均未观察到特异性着色,与人和恒河猴均无组织交叉反应;免疫毒性试验中,恒河猴免疫指标的变化与注射2B11注射液100和400 mg·kg-1无关;局部刺激性试验中,2B11注射液100和400 mg·kg-1连续给药3周,恒河猴给药局部血管、肌肉及皮肤未见与受试物相关的刺激性反应等(结果未发表),表明2B11注射液的安全性,2B11注射液非临床安全性评价的NOAEL为400 mg·kg-1,相当于临床最大拟用剂量的8倍以上。目前,2B11注射液已通过国家药品监督管理局药品审评中心的技术审评,正在开展临床试验,以评估2B11注射液在人体中使用的安全性和有效性。
