几种海洋生物毒素生源分布、结构特点、毒理作用及检测方法研究进展
2022-06-13张黎明王蓓蕾王倩倩
王 钒,张黎明,王蓓蕾,王倩倩
(海军军医大学海军特色医学中心海洋生物医药与极地医学研究室,上海 200433)
海洋是地球生命的发源地,约有50余万种动物和13 000余种植物栖息于海洋环境[1]。海洋生物的多样性孕育了大量结构新颖的活性物质。作为新药开发的重要来源,海洋生物毒素的发现、分离、鉴定与合成等是天然产物研究的引领性领域之一[1]。目前,海洋生物毒素中研究进展最为迅速的是生物碱(alkaloid)类、多肽类和聚醚类毒素(表1)。本文从生源分布、结构特点、毒理作用和应用前景等方面对这3大类中的代表性毒素进行概述,并介绍海洋生物毒素检测方法的研究进展,为海洋生物毒素的开发利用提供参考。
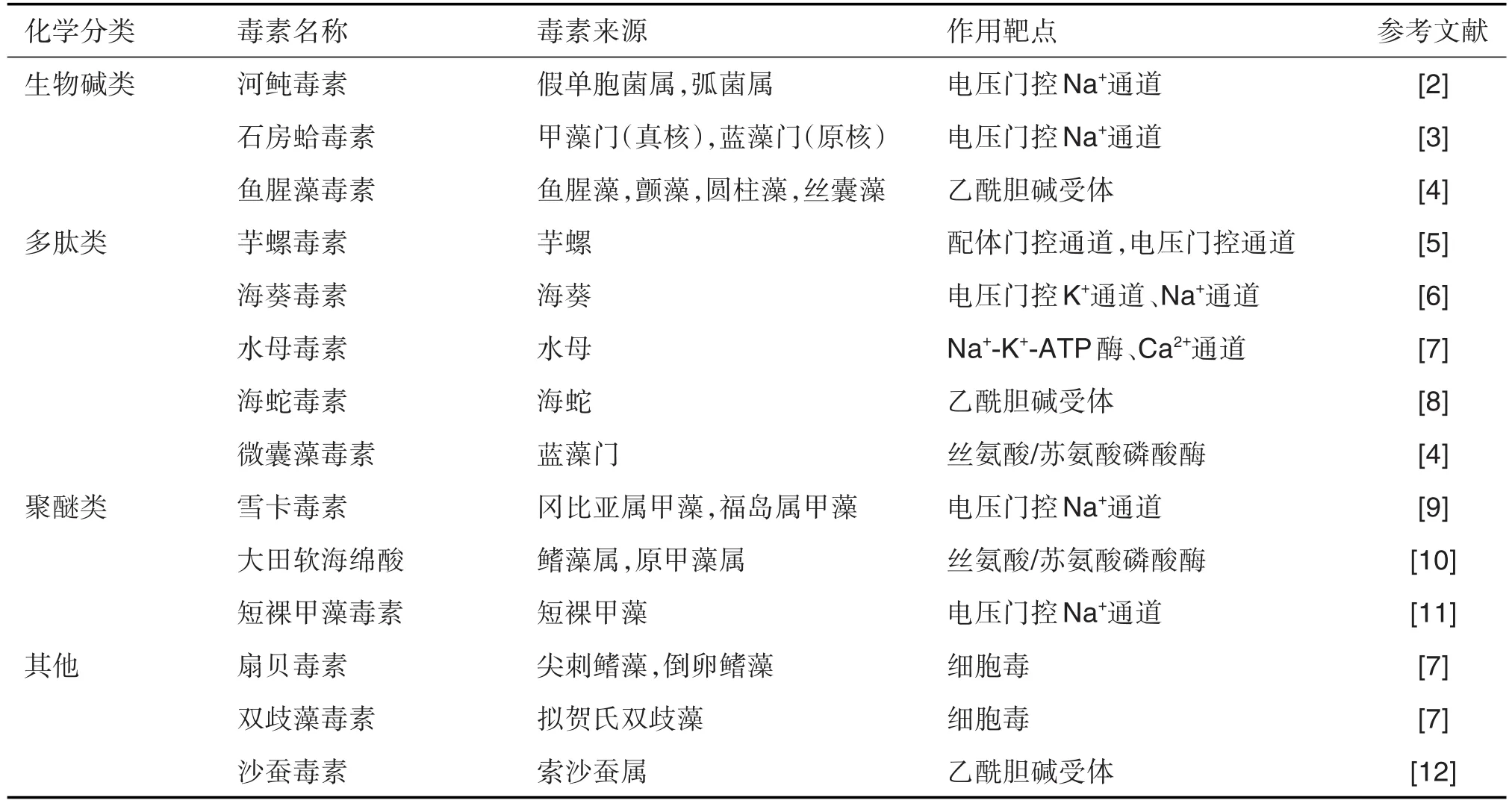
表1 主要海洋生物毒素的分类、来源和作用靶点
1 生物碱类毒素
生物碱是一类含氮的碱性有机化合物,能与酸结合形成盐。常见的海洋生物碱类毒素有河鲀毒素(tetrodotoxin,TTX)、石房蛤毒素(saxitoxin,STX)、膝沟藻毒素(gonyautoxin)、柱孢藻毒素(cylindrospermopsin)等[7],前两者研究最多,毒性尤为剧烈,2010-2015年因TTX食物中毒个案>500例[2];STX在20世纪90年代就被列入《禁止化学武器公约》附表一中[13]。
1.1 河鲀毒素
TTX存在于鲀科鱼类(俗称河豚鱼,图1A)、涡虫纲(turbellaria)、甲壳纲(crustacea)、腹足纲(gastropoda)和头足纲(cephalopoda)等生物体内[7,14],可特异性阻断神经细胞膜Na+通道,曾被认为是自然界毒性最强的非蛋白类毒素。
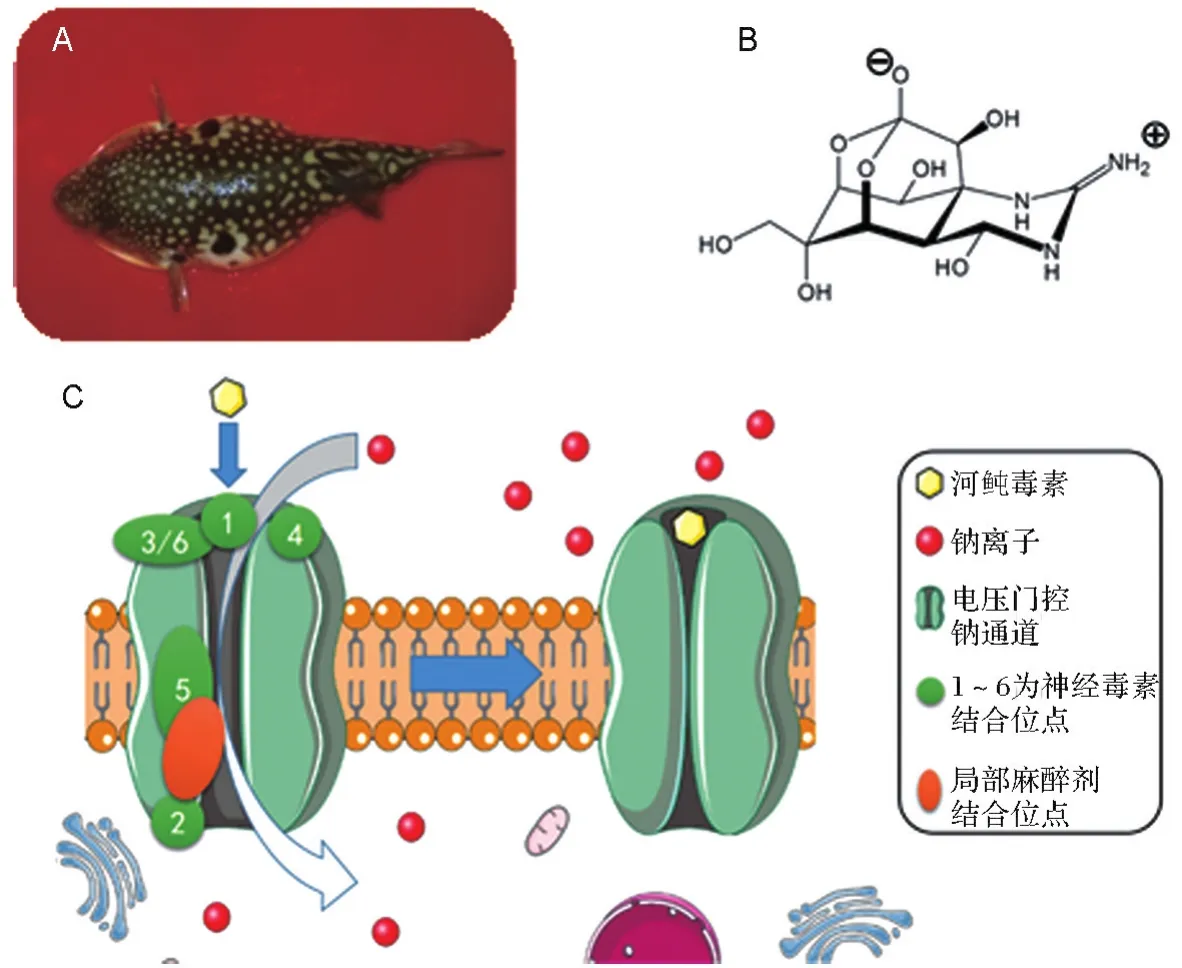
图1 河鲀鱼、河鲀毒素结构及作用机制.A:菊黄东方鲀(硬骨鱼纲,鲀形目,鲀科);B:化学结构[14];C:作用机制.
1.1.1 生源分布
亚洲、美洲、欧洲均报道过TTX食物中毒事件,其中日本最多,2000-2009年报道了300多起[2]。TTX真正的生源可能来自于海洋生物的共生菌,通过食物链传递在特定海洋生物体内富集。目前已发现产TTX的菌株有150多种,涉及假单胞菌属、弧菌属和微球菌属在内的31个菌属[15]。
1.1.2 结构特点和毒理作用
TTX的结构见图1B,分子式为C11H17N3O8,相对分子质量319.27。纯品为无色、无味的针状结晶,难溶于水及有机溶剂,可溶于弱酸或醇溶液[7]。TTX是高度特异的Na+通道阻滞剂,通过与电压门控Na+通道位点1结合(图1C),抑制Na+内流,降低细胞兴奋性[16]。TTX中毒后可出现头痛、出汗、身体麻木、恶心、呕吐、腹痛等症状,严重时可出现低血压、心律失常、肌肉瘫痪和中枢神经功能障碍,危重病例可在30 min内因呼吸循环衰竭而死亡[17]。
1.1.3 应用前景
TTX通过特异性阻断神经系统电压门控Na+通道产生镇痛活性,避免与产生成瘾效应的中枢奖赏回路相互作用[18],具有开发为非成瘾性镇痛药的潜力。此外,与局部麻醉剂(如布比卡因,bupivacaine)不同,TTX在阻断电压门控Na+通道时不会影响细胞内Ca2+稳态,可避免局麻药常见的肌肉毒性作用[19]。
近年来,不少研究者开发了以TTX为主要原料的缓释镇痛药。如Zhao等[20]曾报道一种新型TTX聚合物镇痛体系,通过酯键水解和调节主链亲水性方式实现TTX缓慢释放,其镇痛时间最长可持续3 d,无明显不良反应。Hong等[21]研发了一种TTX肠溶缓释微丸,口服使用安全高效。溶出实验显示,TTX可持续释放12 h;药动学实验结果显示,大鼠ig给药5 h可达最大TTX血药浓度;醋酸诱导疼痛测试显示,镇痛效果最高可维持9 h,半数有效剂量约为30 ng·g-1,治疗指数约为25。它们为疼痛治疗提供了新的选择,有望应用于临床。
由于结合位点不同,TTX与局麻剂联用还会产生协同效应。如利多卡因和TTX可分别结合电压门控Na+通道内氨基酸残基(结构域4中的跨膜片段6)和位点1(图1C),因此两药联用可明显提高电压门控Na+通道阻滞效果[22],减少药物用量。此外,肾上腺素通过收缩血管亦能减少TTX吸收,延长作用时间。因此,两药联用亦可减少用量,降低不良反应[23]。
1.2 石房蛤毒素
STX是一种剧毒生物碱类神经毒素,最初从巨石房蛤(Saxidomus giganteus)分离得到。全世界每年约有2000例STX食物中毒事件,死亡率约15%[24]。STX作为潜在化学生物战剂,长期以来受到国际社会高度关注。
1.2.1 生源分布
STX分布广泛,除南极洲外其他各大洲均有分布[25],节肢动物门(如甲壳纲)、软体动物门(如双壳纲、腹足纲)、棘皮动物门(如海星纲)等动物均可携带[26]。与TTX类似,STX也可通过食物链传递在海洋生物体内蓄积(图2),其真正来源可能是真核生物界的亚历山大属甲藻(Alexandrium)、梨甲藻属甲藻(Pyrodinium)以及细菌界的蓝藻(cyanobacteria)[3]。其中,亚历山大属甲藻STX蓄积量最丰富、分布最广[3]。目前,导致STX生物合成跨界分布原因仍不清楚。现有3种进化理论:①共培养细菌理论,由甲藻细胞内细菌合成STX;②趋同进化理论,蓝藻和甲藻各自进化出类似STX的产物;③水平基因转移理论,蓝藻携带的STX基因发生一次水平基因转移后,在甲藻中进化出STX基因[3]。
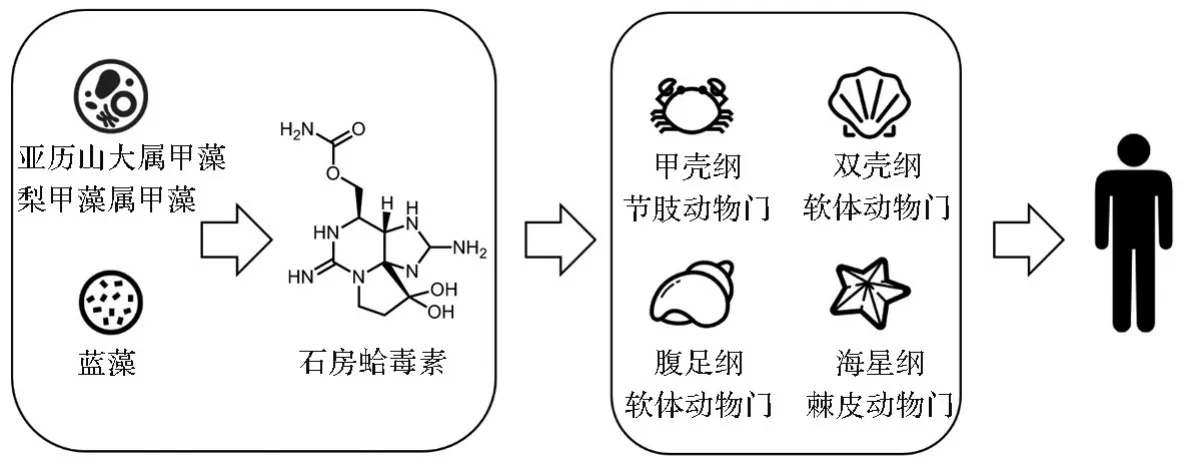
图2 石房蛤毒素的产生和食物链富集[26-27].
1.2.2 结构特点和毒理作用
STX的结构见图2,分子式为C10H17N7O4,相对分子质量299.29,结构稳定且溶于水[28]。与TTX类似,STX亦为Na+通道阻滞剂,其活性基团7,8,9-胍基与电压门控Na+通道上的位点1结合(图1C),抑制Na+内流,从而降低细胞兴奋性[28]。因此,STX中毒可导致恶心呕吐、腹泻、低血压、气短、瘫痪等消化系统和神经系统症状,严重时可因呼吸抑制而死亡。此外,STX还能激动心肌细胞膜上的K+通道,部分阻断心肌细胞膜电压门控Ca2+通道[29],导致心律失常,抑制心肌收缩。
1.2.3 应用前景
STX因其独特的化学结构和强烈的生物学活性,在神经生物学和药理学领域具有重要研究价值。Nav1.7在痛觉信号传递中起重要作用,Beckley等[30]报道了一种模拟STX的合成镇痛药ST-2530,其对Nav1.7具有超高选择性,高于其他Na+通道亚型500倍以上。在小鼠模型中,sc给予ST-2530对热、机械和化学刺激引起的疼痛刺激均有超强镇痛活性,且对嗅觉、平衡和运动功能无明显影响。小鼠水烫尾实验显示,sc给药20~60 min即可出现最大镇痛效应,镇痛效果可维持150 min。此外,目前眼部局麻药均为短效药物,长时间使用可能会延缓角膜愈合。McAlvin等[31]发现,STX与右美托咪啶联用可延长角膜麻醉时间,且不影响伤口愈合。
2 多肽类毒素
海洋多肽类毒素是毒性最强的海洋生物毒素之一,能特异地作用于多种离子通道或受体亚型,是新药开发的重要资源和神经科学研究的强大工具。典型代表包括芋螺毒素(conotoxin)、海葵毒素(sea anemone toxin)、海蛇毒素(sea snake toxin)和水母毒素(jellyfish toxin)等[7]。
2.1 芋螺毒素
芋螺毒素是芋螺毒液中一组富含二硫键的多肽类毒素,结构稳定、特异性强,广泛作用于离子通道、G蛋白偶联受体和转运体等靶点,是理想的分子探针和肽类药物的丰富来源[5]。
2.1.1 生源分布
全世界约有800多种芋螺(Conus)[32],主要生活在热带和亚热带海域,非洲沿岸、澳大利亚、新西兰、菲律宾及日本等沿海均有分布。我国芋螺约有100余种,多见于西沙群岛及海南岛南部,福建、广东沿岸以及台湾沿海[7]。根据猎物不同,芋螺可分为食虫芋螺、食螺芋螺和食鱼芋螺(图3A),其中食鱼芋螺种类最少,但毒性最强。
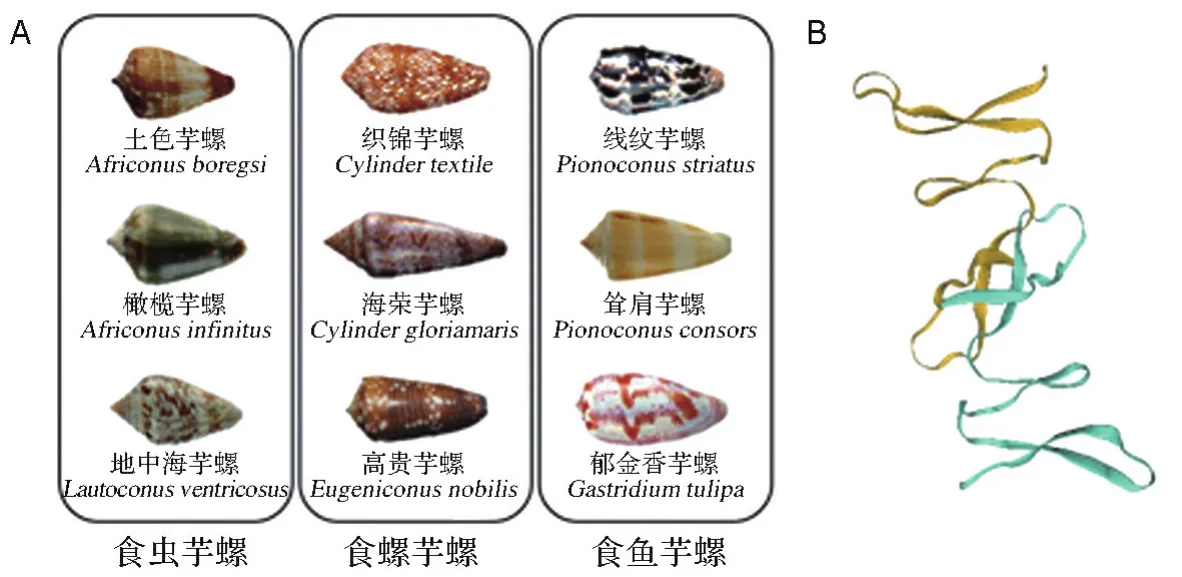
图3 芋螺的分类及α-芋螺毒素GeⅩⅩA三维结构.A:芋螺的分类[33];B:来源于将军芋螺(Conus generalis)模拟的α-芋螺毒素GeⅩⅩA三维结构(PDB:4X9Z_B)[34].
2.1.2 结构特点和毒理作用
芋螺毒素一般由7~46个氨基酸残基组成,富含半胱氨酸和二硫键(大部分含3个)(图3B),是迄今发现的最小核酸编码的动物神经毒素肽,也是二硫键密度最高的小肽[7]。依据不同作用位点,芋螺毒素可以分为ω,α和δ等11类,可作用于不同离子通道、受体和转运蛋白(表2),发挥特异的毒理作用。如ω-芋螺毒素通过阻断Ca2+通道抑制初级传入神经末梢的神经递质释放,产生麻痹镇痛作用。
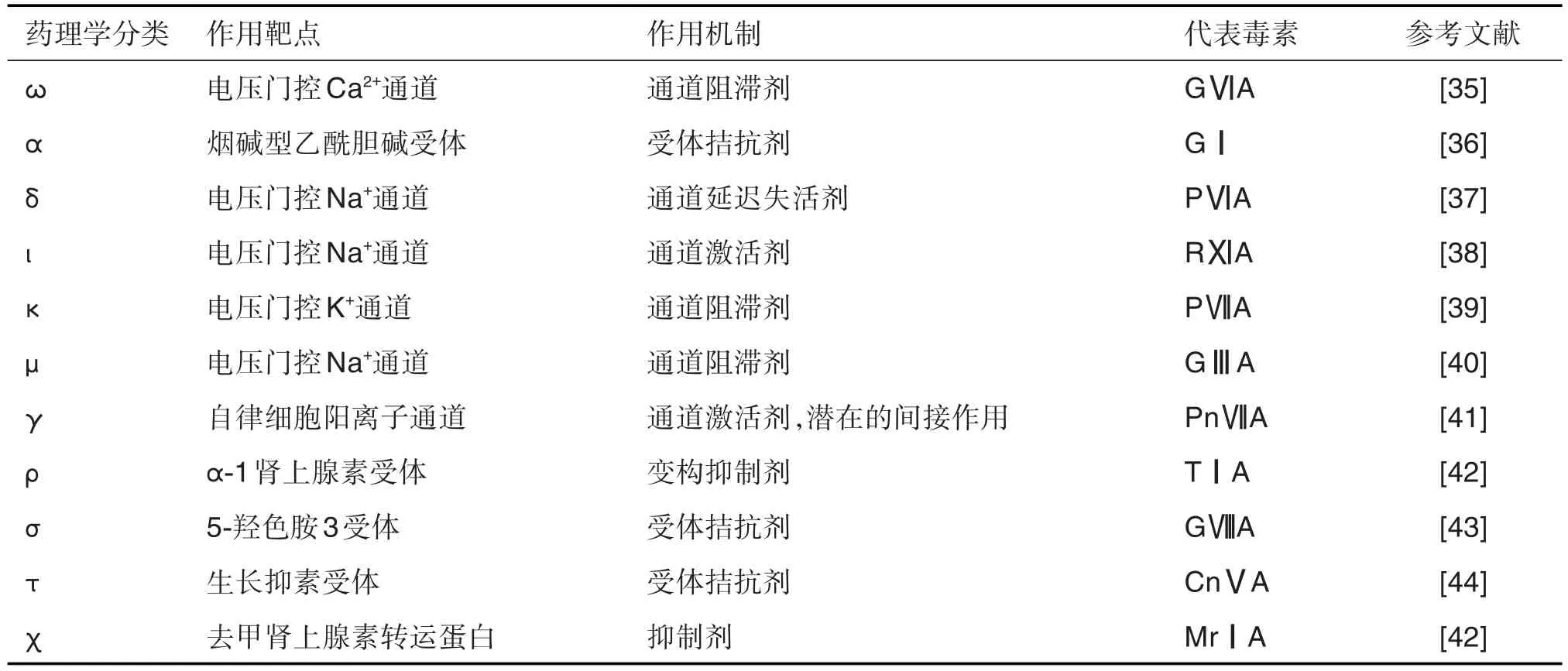
表2 芋螺毒素的药理学分类、作用靶点和机制
2.1.3 应用前景
芋螺毒素是目前研究最为活跃的生物毒素之一[45]。ω-芋螺毒素MⅦA,商品名齐考诺肽(Ziconotide),是美国FDA批准的首个海洋药物,因其具有非成瘾镇痛作用,作为吗啡的主要替代品进入市场[1]。但由于用药成本较高(需植入鞘内泵),且具有神经性不良反应,临床应用受限[46]。最近,Romero等[47]报道一种新型α-芋螺毒素RgⅠA4,作为α9α10烟碱型乙酰胆碱受体特异性阻滞剂,通过sc给药即可预防化疗引起的神经病理性疼痛;更重要的是,连续给药21 d,对大鼠的行为和神经功能无明显影响。在此基础上,Zheng等[48]研发了一种侧链环化的α-芋螺毒素RgⅠA4类似物,在维持镇痛活性的同时,显著延长了药物作用时间。血清稳定性实验显示,给药24 h后RgⅠA4类似物仍有80%未降解,稳定性较RgⅠA4显著提高,具有成为新一代非成瘾性镇痛药的潜力。
2.2 海葵毒素
海葵毒素是从海葵(图4A)中分离出的一组富含半胱氨酸的多肽,能作用于Na+通道和K+通道,具有神经毒性以及心脏毒性等多种生物活性[6]。

图4 代表性海葵及毒素ShK的三维结构.A:螅形美丽海葵(珊瑚纲,海葵目,链索海葵科)[51];B:K+通道海葵毒素ShK的三维结构(PDB:1ROO_A[52]).
2.2.1 生源分布
全球约有1200种海葵,广泛分布于温带、亚热带及热带海域[7]。我国海域共有81个海葵目物种,其中黄海和渤海有29种,东海23种,南海55种[49],有毒海葵主要有玫瑰海葵(Actinia cari)、疣海葵(Adamsiasp.)以及蛇卷海葵(Anemonia sulcata)等[7]。
2.2.2 结构特点和毒理作用
目前已知的海葵毒素约320种[6],一般为由27~49个氨基酸残基组成的单链多肽,可分为Na+和K+通道毒素(表3、图4B)。前者主要与Na+通道神经毒素结合位点3结合(图1C),抑制Na+通道失活,延长动作电位,引起肌肉疼痛、感觉异常、心律失常等症状[50];后者主要通过阻断K+通道,增强神经肌肉接头处乙酰胆碱的释放,引起肌肉痉挛[50]。
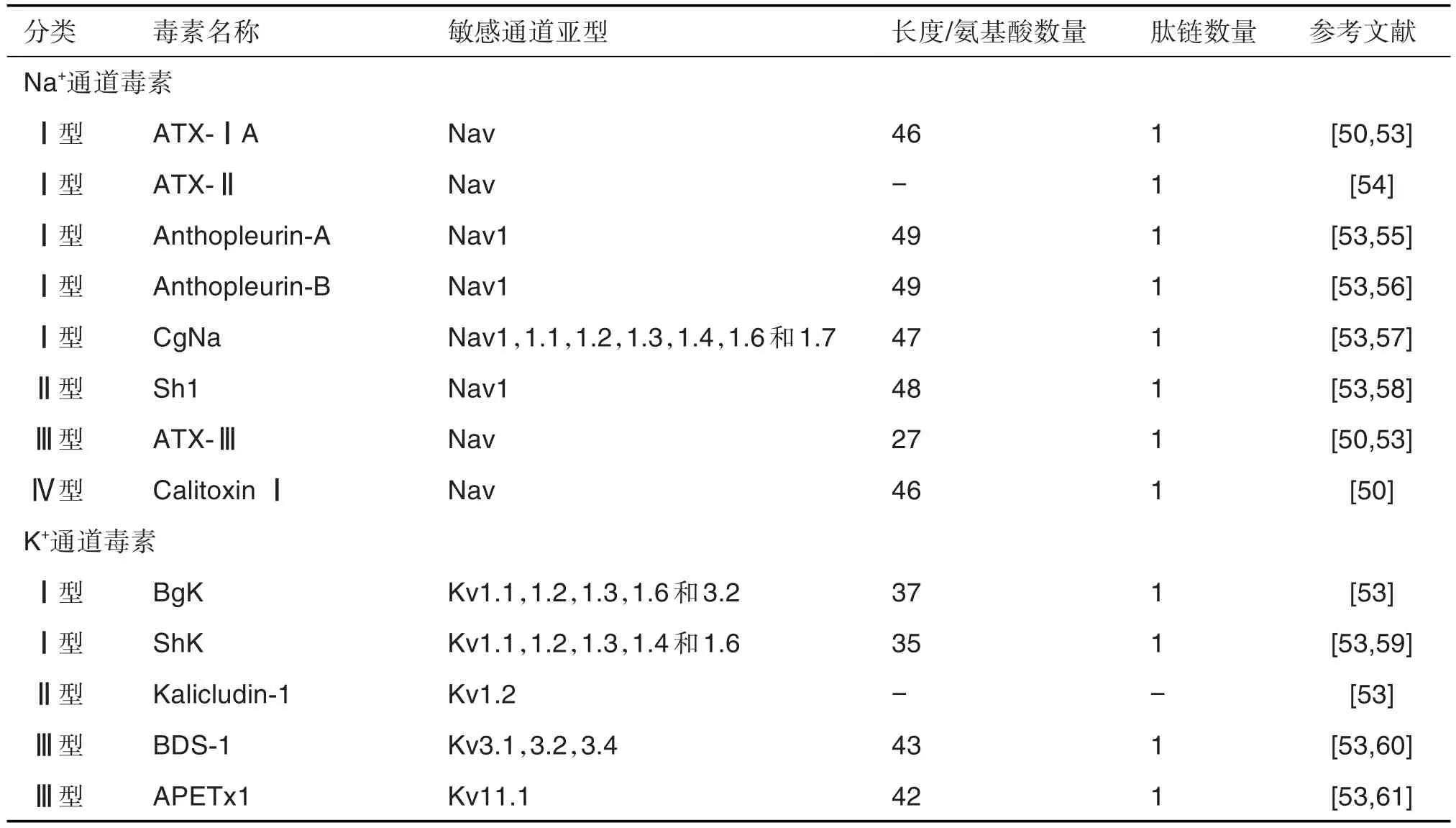
表3 代表性海葵毒素的性质
2.2.3 应用前景
T细胞增殖对许多自身免疫性疾病的调控至关重要。研究表明,Kv1.3通过调节T淋巴细胞增殖,为类风湿性关节炎、牛皮癣和多发性硬化症等疾病提供新治疗策略[62]。海葵毒素ShK作为K+通道强效阻滞剂,是潜在的治疗药物。Beeton等[63]首次报道了ShK(L5)用于治疗多发性硬化症。Pennington等[64]报道了 ShK-186,即达拉扎肽(dalazatide),对Kv1.3的选择性较Kv1.1高100倍,能有效治疗斑块型银屑病,无明显毒副作用[65],目前已完成Ⅰa/Ⅰb期临床试验[66]。Murray 等[67]报道了一种ShK聚合物(ShK-PEG),对Kv1.3的选择性比Kv1.1高出1000倍,具有更强的靶向性和更低的不良反应,有望开发成为治疗自身免疫性疾病的新型靶向药物。
3 聚醚类毒素
海洋聚醚类毒素是一类由多个醚环组成的天然毒素,毒性强烈。常见的有雪卡毒素(ciguatoxin,CTX)、大田软海绵酸(okadaic acid,OA)、短裸甲藻毒素(brevetoxin)、扇贝毒素(pectenotoxin)以及刺尾鱼毒素(maitotoxin)等。前两者在热带和亚热带地区广泛分布,中毒发生率很高,受到了广泛关注[68-69]。
3.1 大田软海绵酸
1981年,Tachibana等[7]首次从大田软海绵中分离到一种聚醚类毒素,命名为OA。OA能引起严重腹泻,长期低剂量暴露会造成不可逆多器官损伤,严重威胁着患者健康。
3.1.1 生源分布
OA来源于甲藻门(鳍藻属、原甲藻属),常见于凹形原甲藻(Prorocentrum concavum)、利马原甲藻(Prorocentrum lima)以及倒卵形鳍藻(Dinophysis fortii)等[70]。与大多数藻类毒素一样,OA 可经食物链蓄积于软体动物门双壳纲动物和部分鱼类。比利时、意大利、法国、加拿大以及中国都报道过OA相关的食物中毒事件[71]。
3.1.2 结构特点和毒理作用
OA的结构见图5,分子式为C44H68O18,相对分子质量885,是细胞丝氨酸/苏氨酸磷酸酶(serine/threonine phosphatases,Ser/Thr PP)的强抑制剂[71]。Ser/Thr PP参与了细胞骨架结构的维持以及细胞功能的调节,包括细胞生长、分裂和死亡。因此,OA通过抑制Ser/Thr PP1和Ser/Thr PP2A,可诱导细胞凋亡和损伤[72]。食用被OA污染的食物0.5~4 h内会出现严重的胃肠道症状,包括腹泻、恶心、呕吐、腹痛和寒战等;经肠道吸收进入血液,可在体内脏器蓄积[69],诱导产生神经毒性、免疫毒性、胚胎毒性和遗传毒性[72]。
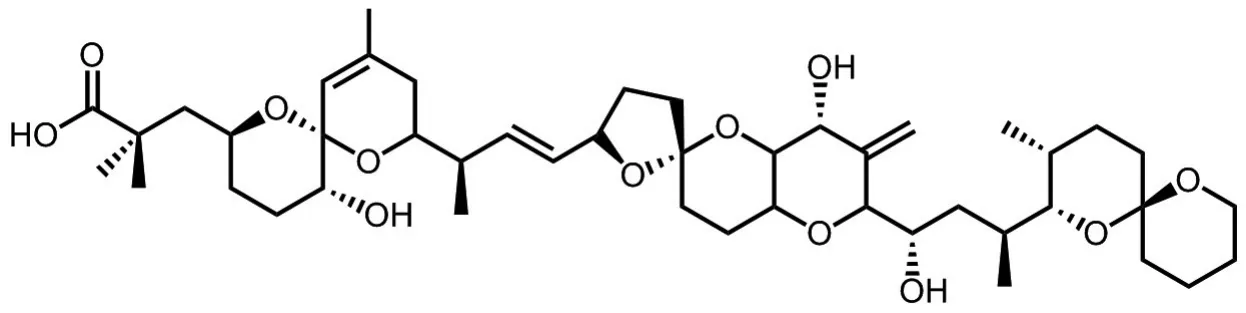
图5 大田软海绵酸的化学结构[10].
3.1.3 应用前景
OA作为Ser/Thr PP的强抑制剂,近期被应用于阿尔茨海默病(Alzheimer′s disease,AD)的发病机制研究[73-74]。AD的病理特征包括过度磷酸化的微管相关蛋白tau组成的神经纤维结节和β淀粉样蛋白42(Aβ)聚集体组成的淀粉样斑块[75]。OA可能通过抑制Ser/Thr PP,抑制tau去磷酸化,降低tau对微管亲和力,使tau形成结节,因此被用于模拟AD发病过程。
Boban等[73]利用OA建立了一个模拟AD的细胞模型,发现经OA处理的神经母细胞瘤SH-SY5Y细胞出现了一种高相对分子质量tau活性蛋白,在免疫原性、对碱性磷酸酶的稳定性等方面与AD发病过程中的磷酸化tau类似,这对解释AD发病机制具有重要意义。Kaushal等[74]同样建立了一个基于OA的AD大鼠模型,将OA注射到大鼠海马并暴露于低氧条件3 d,发现该模型表现出AD相关的系列特征以及神经递质系统功能障碍和认知缺陷,说明OA能在体诱导AD的病理生理变化,作为工具药在AD发病和治疗研究中具有潜在应用价值。
4 海洋生物毒素检测技术
尽管海洋生物毒素具有成为创新药和工具药的巨大潜力,但毒素本身存在现实威胁。雪卡毒素(ciguatoxin,CTX)、OA、TTX和STX等每年在世界各地引发大量食物中毒事件[2,7,68],对沿海地区渔业及居民健康构成极大的威胁。因此,检测和监管海洋生物毒素极为重要。
从动物饲喂、生物检测到细胞分析和放射性(荧光性)配体测试,检测技术不断发展,但仍然存在准确性差、昂贵、耗时以及操作复杂等弊端[7,9]。液相色谱串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)是目前用于检测海洋生物毒素最具优势的一种分析方法,检测限极低,灵敏度高,不依赖毒素标准品和衍生试剂。但传统的LC-MS/MS存在设备昂贵、操作繁琐等问题,限制了该技术的推广。近年来,该技术不断优化,逐步被研究者所接受。Long等[76]报道了一种应用于亲水作用色谱串联质谱检测的脉冲扩散聚焦进样技术。该技术简化了对样品前处理方式,可直接加载毫升体积的检测样品,对TTX的检出限可达0.65 μg·L-1,有效地解决了液相萃取和固相萃取等传统样品处理方法引起的被检测物损耗、操作繁琐等问题,且提高了检测灵敏度,有望应用于各种微量亲水性毒素的测定。免疫测定方法通常简单快捷、易于使用,但由于抗体制备高度依赖生物体内含量极低、不易分离的毒素,该检测方法的应用一度受到限制[9]。2001年,Hirama等[77]首次报道了人工合成的天然雪卡毒素CTX3C;Hamajima等[78]随后实现了CTX1B的人工合成,这为CTX免疫检测中特异性抗体的制备提供了丰富资源,并推动了CTX免疫检测方法的发展。此外,Tsumuraya等[79]利用CTX单抗建立了一种高灵敏度的荧光夹心ELISA,可在一次操作中检测、鉴别和定量CTX 4种主要同系物,检测限<1 ng·L-1,极大地提高了CTX监测质量和效率。最近,Leonardo等[80]构建了一个用于CTX检测的电化学免疫传感器,通过使CTX、检测抗体与传感器上的磁性免疫复合物相继结合,可检测到0.01 ng·g-1水平的P-CTX1,成本低廉且便于携带,具备集成到紧凑型分析设备中的可能,能拓展到实验室以外的应用场合。类似检测技术的进步必将进一步降低海洋生物毒素监测的实施成本,推动各种微量生物毒素的高效监测,提高对中毒事件的分析预警能力,做到早发现、早报告,及时采取有效干预措施。
5 结语
海洋生物毒素具有重要的理论研究价值和应用前景,一方面可为神经生理学研究提供丰富的工具药,另一方面具有成为创新药物重点发展领域的巨大潜力[1]。除齐考诺肽外,还有许多海洋生物毒素衍生药正在研制过程中,如用于治疗1型糖尿病的类胰岛素芋螺毒素Mini-Ins[81],治疗耐药菌感染的海蛇毒素抗菌肽HC1-D2[82]以及治疗假体周围骨溶解的OA[83]等。随着技术的进步,未来将有越来越多海洋生物毒素作为新药进入临床,为攻克重大疑难疾病提供更多可能。
海洋生物毒素的开发利用虽越来越受到国际社会的重视,但总体而言尚处于起步阶段,仍面临许多挑战。首先,海洋生物毒素的活性筛选需进一步加强。近年来,毒素组学的发展虽提升了活性筛选效率[5],但目前已完成基因组测序的物种数量有限,仍有海量测序工作要完成。此外,由于当前活性筛选方法(如离子通道、G蛋白偶联受体等)效率低下,有大量海洋生物毒素未明确结构和药理作用[5]。未来应继续推进基因测序工作,建立更高效筛选方法,探索基因测序与活性筛选协同的药物研发模式。其次,含量少、分离纯化和合成困难等制约海洋生物毒素开发应用的瓶颈需要突破[1]。含有生物毒素的原生海洋生物往往数量较少且多数难以培育,所含毒素多为微量乃至痕量,从海洋生物中大量提取毒素作为直接药物资源十分困难。另外,许多重要毒素化学结构复杂,因而化学合成也非常繁杂。近年来,以高通量毒素表达技术为代表的生物合成技术实现了对许多微量毒素的大量合成,有望突破海洋药物资源化的限制[84]。最后,为维护食品安全和人类健康,必须强化对海洋生物毒素的有效监测,积极研发灵敏、高效、价廉的检测技术,建立健全常态化海洋生物毒素监测机制。
