橘红素预处理对过氧化氢诱导成骨细胞损伤的保护作用及机制
2022-06-13李汁涵陈艳莉路鸿瑜黄宏靓
李汁涵,陈艳莉,田 欣,路鸿瑜,殷 航,邬 钰,2,黄宏靓,2,陈 珺,2
(广东药科大学1.生命科学与生物制药学院,2.生物资源与创新药物研究中心,广东 广州 510006)
随着社会人口老龄化趋势加剧,增龄性疾病所引发的健康问题愈发受到重视,骨质疏松症(osteoporosis,Op)即是其中的典型代表。Op以骨量减少、骨微结构破坏为主要特征。近年来,随着对细胞衰老认识的深入,靶向细胞衰老机制筛选新的防治药物已成为应对Op的重要思路和方法[1]。活性氧(reactive oxygen species,ROS)诱导的氧化应激是导致细胞损伤并衰老的重要原因[2],氧化应激调节细胞因子分泌、酶活性变化以及信号通路传导,干预核内基因的转录和表达,导致成骨细胞增殖、分化、凋亡和细胞功能的异常,进而打破骨重建过程中的骨形成和骨吸收平衡,最终引起Op[3]。补充外源性抗氧化物可以明显改善氧化应激对骨的氧化损伤,且无明显不良反应,如茶多酚、白藜芦醇和柚皮素等天然抗氧化物均已被证实具有抗骨质疏松活性[4]。橘红素(5,6,7,8,4′-五甲氧基黄酮,tangeretin)是提取自柑橘属植物果皮中的一种天然多甲氧基类黄酮类化合物[5],具有较好的抗氧化活性[6-8],亦具有抑制破骨细胞分化和功能的作用[9],但目前尚未见研究将橘红素的抗氧化特性与Op联系,论证橘红素对成骨细胞氧化损伤的保护作用。本研究旨在探究橘红素预处理是否具有保护成骨细胞免受过氧化氢(H2O2)诱导的氧化损伤的作用,拟为从抵御成骨细胞氧化损伤、保护成骨细胞功能角度筛选Op防治药物提供实验数据。
1 材料与方法
1.1 药物、试剂和主要仪器
橘红素美国MCE公司。高糖DMEM、胎牛血清和0.25%胰酶-EDTA美国Gibco公司;Ⅰ型胶原酶、β-甘油磷酸钠、L-维生素C、地塞米松,均美国Sigma公司;H2O2,成都金山公司;CCK-8试剂盒,日本Dojindo公司;碱性磷酸酶(alkaline phosphatase,AKP)染色试剂盒,上海贝博公司;AKP活性检测试剂盒,南京建成公司;茜素红粉末,北京索莱宝公司;ROS检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒和BCA蛋白质定量试剂盒,上海碧云天公司;兔抗大鼠成骨细胞特异性转录因子(osterix,OSX)单克隆抗体、兔抗人骨保护素(osteoprotegerin,OPG)多克隆抗体、兔抗大鼠β肌动蛋白多克隆抗体(一抗)和辣根过氧化物酶标记的山羊抗兔IgG抗体(二抗),均Abcam公司。Galaxy S+二氧化碳培养箱,美国Biotech公司;SW-CT超净工作台,苏州安泰空气技术有限公司;Observer5荧光倒置显微镜,德国Zessis公司;BX51荧光正置显微镜,日本Olympus公司;酶标仪,美国Thermo Labsystems公司;CytoFlEX流式细胞仪,美国Beckman Coulter公司;5200凝胶成像仪,上海天能科技有限公司;PowerPac HC凝胶电泳仪和转膜仪,美国Bio-Rad公司。
1.2 动物和成骨细胞培养
SPF级SD乳大鼠(出生≤24 h)购自珠海百事通生物科技有限公司(SYXK(粤)2020-0051)。实验经广东药科大学实验动物伦理委员会审查并批准(GDPULAC2021054)。酶消化法分离培养成骨细胞:脊椎脱臼法处死SD乳大鼠、置于75%乙醇中消毒,在超净台内分离颅骨并刮除结缔组织和骨膜,剪碎骨片后加入0.25%胰酶-EDTA溶液37℃消化15 min,弃去消化液,再加入0.15%Ⅰ型胶原酶溶液消化2次,每次37℃孵育1 h;离心5 min(400×g)弃消化液,以含10%胎牛血清的DMEM高糖培养基重悬细胞并转移至培养皿中,置于37℃,5% CO2培养箱中培养。每2~3 d换液1次,待细胞生长至90%融合时胰酶消化传代,从P2代细胞开始使用成骨诱导培养基(含10%胎牛血清的DMEM高糖培养基中加入β-甘油磷酸钠10 mmol·L-1、地塞米松10 nmol·L-1和维生素C 50 mg·L-1)培养。
1.3 AKP染色和茜素红染色鉴定成骨细胞
AKP染色:成骨细胞以2×107L-1密度接种于24孔培养板,经10%胎牛血清条件培养基培养7 d后,按AKP染色试剂盒说明进行AKP染色,在显微镜下观察并拍照。
茜素红染色:成骨细胞以2×107L-1密度接种于24孔培养板,经10%胎牛血清条件培养基培养21 d后,以茜素红染液进行染色,在显微镜下观察并拍照。
1.4 CCK-8法检测成骨细胞存活率
成骨细胞以2×104L-1密度每孔100 μL接种于96孔细胞培养板,分为细胞对照组、模型组(H2O2300 μmol·L-1处理1 h)和模型+橘红素组(橘红素5,10,15,20,30 和 40 μmol·L-1预处理 48 h,加H2O2300 μmol·L-1处理 1 h),每组 6复孔。去除药液后,10%胎牛血清条件培养基培养48 h,加入CCK-8 100 μL 37℃孵育2 h后,设空白溶液(10%胎牛血清条件培养基100 μL+CCK-8溶液10 μL)对照,在酶标仪450 nm波长处测定吸光度值(A450nm)并计算细胞存活率。细胞存活率(%)=(药物组A450nm-空白对照组A450nm)(/细胞对照组A450nm-空白对照组A450nm)×100%。
1.5 AKP测定试剂盒检测AKP活性
成骨细胞按1.4方法接种、分组处理后,再经10% FBS条件培养基培养48 h,吸取适量上清液,按碱性磷酸酶(AKP)试剂盒说明书操作,设空白溶液(缓冲液+基质液)对照,在酶标仪520 nm波长处测A520nm值。AKP活性(U·L-1)=(药物组A450nm-空白对照组A450nm)/(标准品A450nm-空白对照组A450nm)×标准品浓度(0.1 g·L-1)×1000。
1.6 茜素红染色检测成骨细胞钙化结节数量
成骨细胞以2×107L-1密度每孔100 μL接种于24孔培养板,细胞分正常对照组、模型组(以H2O2300 μmol·L-1处理1 h)和模型+橘红素组(橘红素10 μmol·L-1预处理 48 h,H2O2300 μmol·L-1处理1 h),每组3复孔,细胞再经10%胎牛血清条件培养基培养21 d后,按1.3方法进行茜素红染色,并以BIOQUANT OSTEO分析软件计数各组细胞20倍镜下3个视野的钙化结节数量。
1.7 ROS检测试剂盒检测成骨细胞ROS水平
成骨细胞以1×108L-1密度每孔800 μL接种于6 cm×6 cm培养皿中,按1.6分组处理细胞,细胞再经10%胎牛血清条件培养基培养24 h后,按ROS检测试剂盒步骤要求装载探针,PBS洗净细胞后消化收集。通过流式细胞仪检测各组细胞的DCFH-DA荧光,以荧光强度表示ROS水平。
1.8 WST-8法检测成骨细胞SOD活性
成骨细胞按1.7接种、按1.6分组处理后,再经10%胎牛血清条件培养基培养24 h后,PBS洗净细胞后加入SOD样品制备液,按SOD活性检测试剂盒步骤,设置空白溶液1(SOD检测缓冲液20 μL+WST-8/酶工作液 160 μL+反应启动工作液 20 μL)和空白溶液 2(SOD 检测缓冲液 40 μL+WST-8/酶工作液160 μL),在酶标仪450 nm波长处测A450nm。按照试剂盒方法计算SOD活性。抑制百分率(%)=(空白对照1A450nm-药物组A450nm)/(空白对照1A450nm-空白对照2A450nm)×100%。SOD活性(U·g-1蛋白)=抑制百分率/(1-抑制百分率)/样品蛋白含量(g)。
1.9 Western印迹法测定成骨细胞OSX和OPG蛋白表达
成骨细胞以5×108L-1密度接种于10 cm×10 cm培养皿中,分组处理同1.6。再经10%胎牛血清条件培养基培养24 h后,RIPA蛋白抽提试剂提取总蛋白,按BCA蛋白质定量试剂盒方法测定各组蛋白质浓度。各组取等量蛋白经12% SDS-PAGE电泳后转膜1 h,经TBST洗膜5 min×3次后用含5%脱脂奶粉的TBST溶液摇床轻摇封闭2 h,再用TBST洗膜5 min×3次后加入一抗(1∶2000),β肌动蛋白(1∶5000)4℃摇床孵育过夜,次日室温孵育1 h,TBST洗膜5 min×3次后加二抗(1∶1000),4℃摇床孵育1 h,TBST 洗膜5 min×3次,经曝光、显影、定影后获得蛋白胶片,凝胶成像系统拍照后以Image J软件测定目标蛋白积分吸光度值,以目标蛋白与内参蛋白积分吸光度值比值表示待测蛋白表达水平。
1.10 统计学分析
采用GraphPad prism 8软件对实验数据进行统计分析,实验结果数据以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 成骨细胞鉴定
原代成骨细胞经成骨诱导条件培养基培养后,细胞呈饱满多角形、长梭形(图1A),连续培养7 d后细胞经AKP染色细胞质呈蓝色(图1B);连续培养21 d后可见成骨基质钙化产物堆集成灶、形成大小不一的类圆形结节,经茜素红染色结节呈深红色(图1C)。
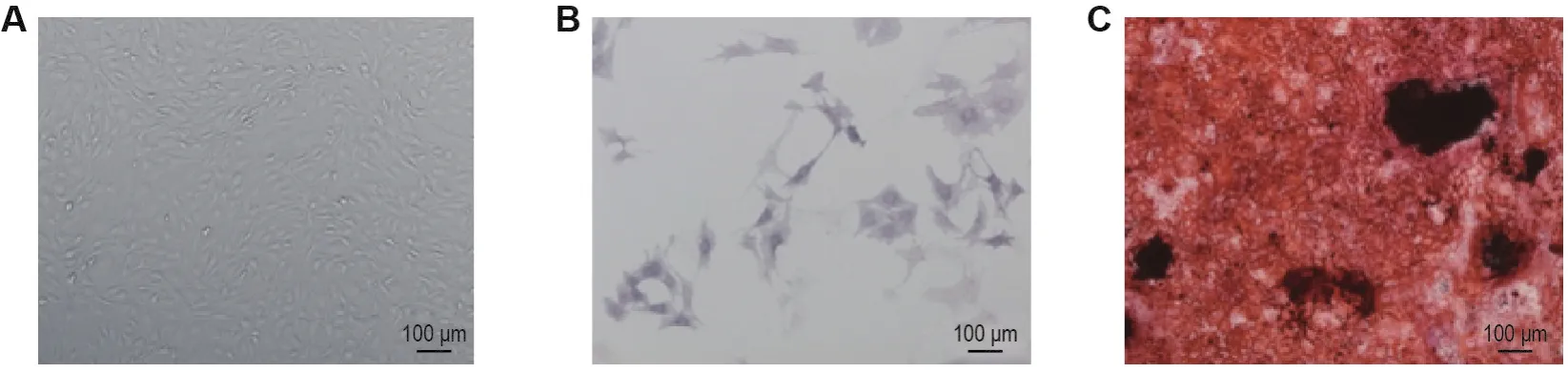
Fig.1 ldentification of osteoblasts.A:osteoblasts isolated from rat calvaria by enzyme digestion;B:alkaline phosphatase(AKP)staining results of osteoblasts;C:alizalin red staining results of osteoblasts.
2.2 橘红素预处理对H2O2损伤的成骨细胞存活率的影响
CCK-8实验结果表明(表1),与细胞对照组相比,模型组成骨细胞存活率明显降低(P<0.01);与模型组相比,模型+橘红素10,15,20和30 μmol·L-1预处理组细胞存活率明显提高(P<0.01)。
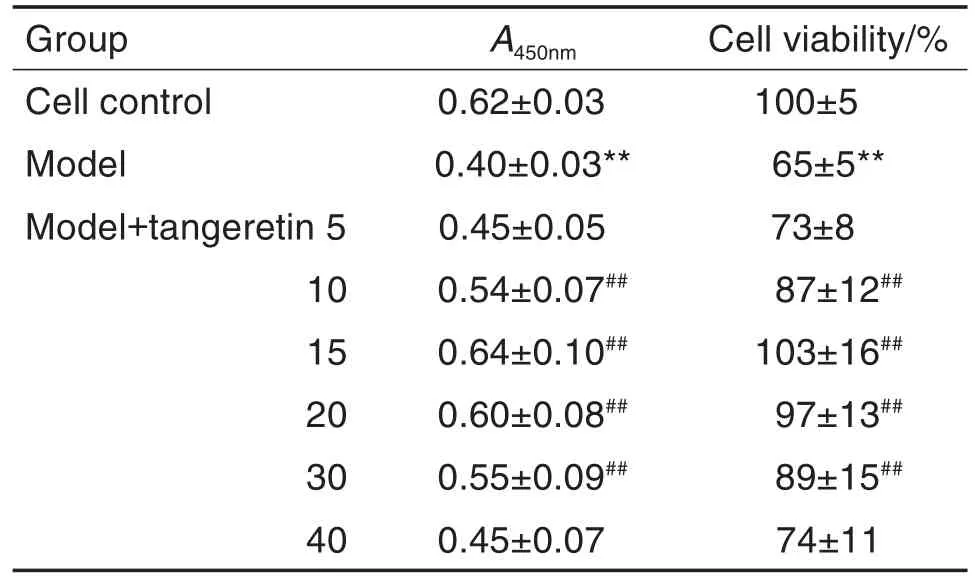
Tab.1 Effect of tangeretin pretreatment on cell viability of osteoblasts injured by H2O2
2.3 橘红素预处理对H2O2损伤的成骨细胞AKP活性的影响
AKP活性测定结果(表2)表明,与细胞对照组相比,模型组成骨细胞AKP活性显著降低(P<0.01);与模型组相比,模型+橘红素10,15和20 μmol·L-1预处理组细胞AKP活性明显增加(P<0.05)。综合上述结果,后续实验选择橘红素预处理给药浓度为10 μmol·L-1。
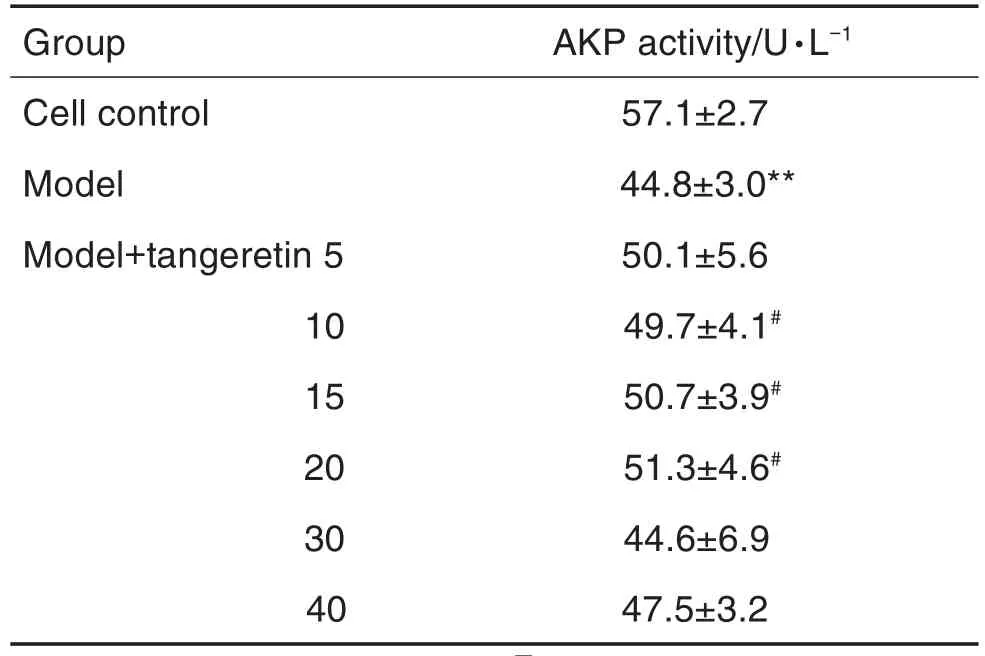
Tab.2 Effect of tangeretin pretreatment on alkaline phosphatase(AKP)activity of osteoblasts injured by H2O2
2.4 橘红素预处理对H2O2损伤的成骨细胞形成矿化结节数量的影响
茜素红染色结果如图2和表3所示,与细胞对照组相比,模型组细胞钙化结节数量明显减少(P<0.05);与模型组相比,模型+橘红素10 μmol·L-1预处理组钙化结节数量明显增加(P<0.05)。
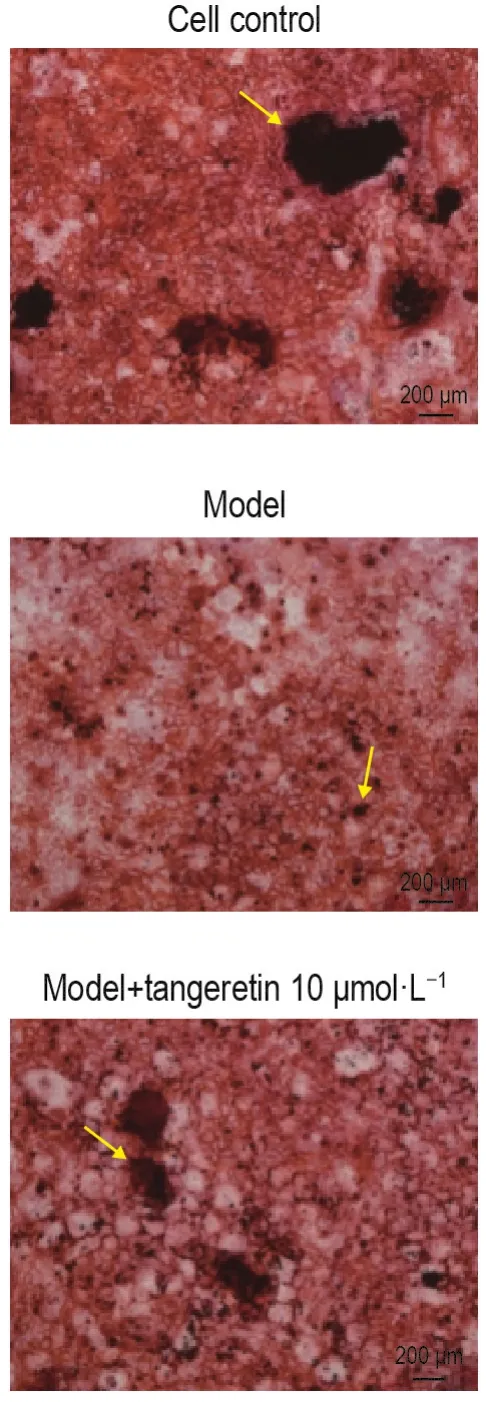
Fig.2 Effect of tangeretin pretreatment on numbers of mineralized nodules of osteoblasts injured by H2O2(alizalin red staining).Osteoblasts were pretreated with tangeretin 10 μmol· L-1for 48 h,and then exposed to H2O2 300 μmol· L-1for 1 h.Then,H2O2was replaced with regular medium and cells were placed back into an incubator at 37℃and 5% CO2for 21 d.Calcified nodules ware indicated by arrows.

Tab.3 Effect of tangeretin pretreatment on numbers of mineralized nodules of osteoblasts injured by H2O2
2.5 橘红素预处理对H2O2损伤的成骨细胞ROS水平的影响
流式细胞术检测结果显示(表4),与细胞对照组相比,模型组细胞ROS水平显著升高(P<0.01);与模型组相比,模型+橘红素10 μmol·L-1预处理组细胞ROS水平明显降低(P<0.01)。
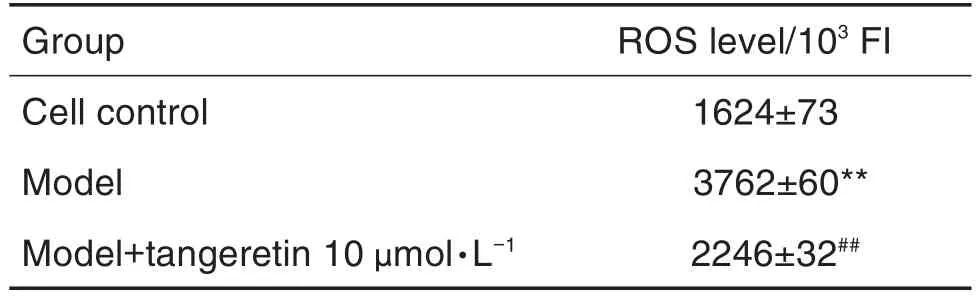
Tab.4 Effect of tangeretin pretreatment on intercellular ROS level of osteoblasts injured by H2O2
2.6 橘红素预处理对H2O2损伤的成骨细胞SOD活性的影响
WST-8法检测成骨细胞中SOD活性结果(表5)显示,与细胞对照组相比,模型组SOD活性显著降低(P<0.05);与模型组相比,模型+橘红素10 μmol·L-1预处理组SOD活性显著升高(P<0.01)。
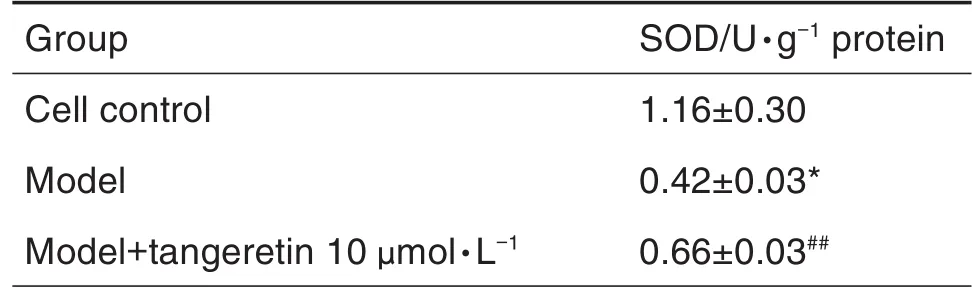
Tab.5 Effect of tangeretin pretreatment on activity of superoxide dismutase(SOD)of osteoblasts injured by H2O2
2.7 橘红素预处理对H2O2损伤的成骨细胞OSX和OPG蛋白表达水平的影响
Western印迹结果(图3)显示,与细胞对照组相比,模型组细胞OSX和OPG的蛋白表达均明显降低(P<0.05);与模型组相比,模型+橘红素10 μmol·L-1预处理组细胞OPG和OSX的蛋白表达显著升高(P<0.05)。
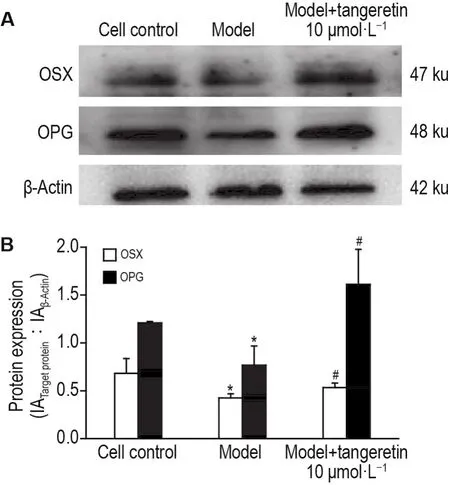
Fig.3 Effect of tangeretin on protein expressions of osterix(OSX) and osteoprotegerin(OPG) of osteoblasts injured by H2O2by Western blotting.See Tab.4 for the cell treatment.B was the semiquantitative result of A.IA:integrated absorbance.±s,n=3.*P<0.05,compared with cell control group;#P<0.05,compared with model group.
3 讨论
本研究结果显示,橘红素预处理不仅能提高氧化应激诱导的损伤的成骨细胞的存活率和成骨细胞AKP活性,亦能使成骨细胞钙化结节数量增加,说明橘红素可改善氧化应激状态下成骨细胞的分化和矿化能力、恢复了成骨功能。此外,橘红素预处理能明显提高氧化应激状态下成骨细胞OSX和OPG表达。OSX是成骨细胞分化和矿化中的重要转录因子,能诱导一系列成骨功能关键蛋白(如骨钙素等)的表达[10-12],且能显著提高成骨细胞的碱性磷酸酶水平[13],这与本研究中橘红素预处理能增加成骨细胞分泌的AKP活性的结果一致。OPG是维持骨代谢稳态的重要因子,其表达增加可抑制破骨细胞分化和骨吸收功能,有利于维持骨量[14];橘红素可能通过提高OPG的表达抑制破骨细胞功能,这与文献报道中橘红素对破骨细胞的影响结论一致[9,15]。
氧化应激诱导的细胞损伤是Op等增龄性疾病的共同致病因子[16]。随着机体衰老,细胞抗氧化防御功能下降,氧化应激增加并引起细胞膜、细胞浆及线粒体DNA的破坏,抑制成骨细胞增殖分化,导致骨代谢异常,出现骨量下降和骨质破坏[17-18]。本研究结果显示,橘红素预处理可有效减少H2O2诱导的细胞内ROS累积,并使成骨细胞在氧化应激状态下具有更高的SOD水平,说明橘红素能保护成骨细胞抵御H2O2诱导的氧化损伤。
综上所述,橘红素预处理能够提高氧化损伤的成骨细胞的存活率和成骨矿化能力,此抗氧化保护作用与橘红素激活成骨细胞SOD活性、减少ROS累积、减轻氧化应激对细胞的损伤有关,但其具体分子机制还有待进一步研究。橘红素具有防治Op的潜力,在相关药物和功能食品开发中具有一定的应用前景。
