中脑腹侧被盖区多巴胺能神经元短暂激活未能诱发小鼠自身给糖行为的重建
2022-06-13李佩云景漫毅
李佩云,景漫毅,吴 宁,李 锦,宋 睿
(1.南京中医药大学,江苏 南京 210023;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,神经精神药理学北京市重点实验室,北京 100850;3.解放军总医院药剂科,北京 100850)
肥胖可引发多种慢性、非传染性疾病,目前已被世界卫生组织列为威胁人类健康的十大疾病之一[1]。伴随我国经济的快速发展和居民生活方式的改变,肥胖发生率持续迅速升高,给我国公共卫生、社会和经济造成严重危害。过量饮食是引发肥胖的重要因素之一。高糖、高脂和高蛋白等食物不仅在客观上为机体提供充分能量,有利于保持健康和种族繁衍,并且能够诱发机体主观的愉悦感,而后者则是驱动机体过量饮食的原动力,类似于药物成瘾性行为[2-3]。研究发现,高复吸率是成瘾治疗的难点,而伴随成瘾行为的相关线索是诱发复吸的危险因素之一[4]。因此,研究线索诱发觅食重建的神经生物学机制将是探索预防和治疗肥胖的有效策略。
中脑边缘皮质多巴胺(dopamine,DA)系统作为脑内边缘系统参与调控奖赏、学习及动机等基本生理功能,是人类趋利避害、种族繁衍的重要神经生物学基础[5]。中脑边缘DA系统起始于中脑腹侧被盖区(ventral tegmental area,VTA),其DA能神经纤维经内侧前脑束投射至伏隔核(nucleus accumbens,NAc)、内侧前额叶皮质、纹状体和杏仁核等脑区[6-7]。该系统奖赏效应的产生主要是通过提高NAc内DA的含量,作用于NAc内的γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元,从而调节基底神经节,驱动机体做出行为反应[8]。研究发现,美食作为初级强化物主要通过激活VTA的DA能神经元,促进NAc中DA神经递质的释放,产生奖赏效应,驱动机体形成主动性的饮食行为[9-11]。造成过量饮食的核心特征是强迫性的觅食行为,即在主动性饮食行为消退后,当与食物相关的线索等因素出现后,机体出现强烈觅食动机,最终发生不可控的觅食行为,形成过量饮食的恶性循环[12-14]。然而VTA的DA能神经元是否同时参与调控觅食行为的重建过程,目前尚无文献报道。在药物成瘾复吸的研究中发现,在海洛因诱导大鼠建立的条件性位置偏爱模型中,相关环境线索在诱发条件位置偏爱行为重建时可记录到VTA脑区内DA能神经元集群的电生理信号显著增强[15],提示VTA的DA能神经元参与了条件位置偏爱行为的重建。此外,在线索诱发小鼠可卡因成瘾复吸时,采用光纤记录系统可检测到VTA脑区DA能神经元的特异性激活[16]。以上结果表明,在线索诱发药物成瘾复吸行为时,VTA脑区的DA能神经元可能发挥重要调节作用。
目前我国高糖饮食非常普遍,被认为是导致当前肥胖流行的原因之一。蔗糖是一种天然的能量来源和奖赏性物质,通过行为学检测其激励奖赏价值,甚至比可卡因等成瘾性物质更高[17]。因此,口服蔗糖自身给糖行为已成为过量饮食障碍研究的经典动物模型。与此同时,随着神经科学研究工具的跨越式发展,光遗传学技术使得人类以往对神经元之间作用的理解由仅停留在相关性上,精确到探究特定神经回路和大脑功能之间的因果关系。据此,本研究结合小鼠自身给糖模型和光遗传学技术,以期探讨VTA脑区的DA能神经元对小鼠觅糖行为重建的调控作用。
1 材料与方法
1.1 动物
转基因DAT-Cre小鼠〔品系:strainB6.SJL-Slc6-a3tm1.1(cre)Bkmn/J〕,8周龄,体重25~30 g,雌雄随机,北京生命科学研究所罗敏敏教授实验室惠赠,由本课题组繁育。小鼠在SPF级动物实验室饲养,实验室温度21~23℃,湿度50%~60%,每天明暗交替各12 h(8∶00-20∶00灯光照明);训练期间动物自由饮水,每天限食3.0 g小鼠维持饲料,实验操作在8∶00-18∶00之间完成。所有的动物处理均符合军事医学研究院伦理审查委员会的要求。
1.2 试剂和主要仪器
重组腺相关病毒rAAV-EF1α-DIO-hChR2-mCherry-WPRE-pA(5.18×109g·L-1)由枢密脑科学技术有限公司提供;蛋白酶K抑制剂和2×Taq PCR MasterMix,博迈德生物公司;O.C.T.冷冻切片组织包埋剂,美国SAKURA公司;兔抗酪氨酸羟化酶(tyrosine hydroxylase,TH)多克隆抗体(批号:ab6211),美国Abcam公司;Alexa Fluor 488山羊抗兔IgG抗体和PBS缓冲液粉末,北京中杉金桥生物技术有限公司;蔗糖和多聚甲醛,国药集团化学试剂有限公司;1454瞬干胶,北京天山新材料技术有限公司。
梯度PCR仪,德国Analytik Jena AG公司;DYY-7C琼脂糖凝胶电泳仪,北京六一仪器厂;Fluorchem FC2凝胶成像分析系统,美国Alpha Innotech公司;小鼠脑立体定位仪和颅内导管系统(0.48 mm×0.34 mm,外径×内径),瑞沃德生命科学有限公司;缝合线,上海浦东金环医疗用品股份有限公司;缝合针,上海元洪医疗器械有限公司;光纤,北京首量科技有限公司;VA-I-N-473激光发射器,北京榜首科技有限公司;VLP-2000型激光功率检测器,美国Coherent公司;CM1900型冰冻切片机和DM18型数字切片扫描与分析系统,德国Leica公司;微量注射泵,世界精密仪器商贸(上海)有限公司。
小鼠自身给糖系统(型号:Anilab SuperState Version 4.0),安来软件仪器有限公司。该系统包括:操作性行为实验箱(200 mm×150 mm×180 mm),箱内距底板4.5 cm的位置有左右2个鼻触孔(直径2 cm)。设置左鼻触为有效鼻触(active poke),触发后伴随5 s线索灯亮,同时中间孔泵出糖水;右鼻触为无效鼻触(inactive poke),触发后不产生任何响应。实验程序运行和数据采集由软件控制完成。
1.3 脑立体定位注射和导管埋置
DAT-Cre转基因小鼠ip给予戊巴比妥钠70 mg·kg-1麻醉后固定在脑立体定位仪上,充分暴露颅骨顶部。用生理盐水清洗颅骨顶部创口后,调节小鼠头部使其保持水平。按照坐标在颅骨上打孔(前囟后侧3.2 mm,中缝左侧0.5 mm)。用微量注射泵吸取病毒液400 nL,垂直脑膜平面向下插入4.2 mm,以流速20 nL·min-1注入,注射后留针10 min以便病毒充分扩散和吸收。在同一位置脑膜平面向下3.7 mm处埋置导管,随后用1454瞬干胶和牙科水泥固定导管。手术结束后,将小鼠放在电热毯上至苏醒,然后放回饲养间单笼饲养。
1.4 小鼠自身给糖行为实验
自身给糖行为形成期训练:为促进小鼠蔗糖自身给糖行为的形成,实验前3 d小鼠开始限食(每天食物限量为3.0 g,约为正常摄食量的80%),直至训练结束。采用固定比率1程序训练,即当小鼠有效鼻触1次,即可得到1次糖水泵出(10 μL,10%蔗糖)并伴随5 s线索灯亮,然后进入5 s不应期。每天训练2 h,小鼠鼻触次数无上限。每天记录小鼠体重、有效鼻触次数、无效鼻触次数、泵出糖水次数以及小鼠触糖水孔的次数,训练至连续3 d有效鼻触次数变化百分率<10%,即达到形成期稳定操作阶段(约2周),可进行消退期训练。
消退期训练:将获得稳定自身给糖的小鼠放入同样的训练箱中,每天训练2 h,该过程中小鼠触有效鼻触孔无糖水泵出和无线索灯亮。训练至连续3 d小鼠有效鼻触次数<10%形成期稳定操作值,即达到首次消退期稳定阶段(约16 d),可进行线索点燃测试[18],其中首次消退期稳定阶段的有效(或无效)鼻触次数分别为首次消退期最后3 d的有效(或无效)鼻触次数的平均值。
线索点燃测试[19]:将经过消退训练的小鼠放入训练箱中,当小鼠触有效鼻触孔后,鼻触孔内会出现5 s灯光提示,但无糖水泵出;而小鼠触无效鼻触无任何响应。测试时间2 h,电脑自动记录有效鼻触和无效鼻触次数。其中有效(或无效)鼻触次数变化百分率(%)=线索点燃测试期有效(或无效)鼻触次数/首次消退期稳定阶段的有效(或无效)鼻触次数×100%。
光刺激点燃:线索点燃测试结束后,小鼠进行第2次消退,训练至连续3 d小鼠有效鼻触次数<10%形成期稳定操作值,即达到第2次消退期稳定阶段。采用频率20 Hz、脉冲时长15 ms的激光连续给予100次激光刺激VTA的DA能神经元,立即将小鼠放入训练箱中2 h,然后电脑自动记录2 h内小鼠有效鼻触和无效鼻触次数。随后进行第3次消退,训练至连续3 d小鼠有效鼻触次数<10%形成期稳定操作值,即达到第3次消退期稳定阶段,采用频率80 Hz、脉冲时长15 ms的激光连续给予100次激光刺激VTA的DA能神经元,立即将小鼠放入训练箱中2 h,然后电脑自动记录2 h内小鼠有效鼻触和无效鼻触次数。其中第2次消退期稳定阶段有效(或无效)鼻触次数为第2次消退期最后3 d的有效(或无效)鼻触次数平均值。
1.5 免疫荧光法验证光敏感通道蛋白表达特异性
行为实验结束后,将小鼠麻醉,依次用生理盐水和4%多聚甲醛溶液灌流后取脑,并进行冰冻切片,切片厚度30 μm,取包含VTA区域的冠状脑片进行免疫荧光染色。首先用PBS配制10%的山羊血清,加入Triton X-100(终浓度0.3%)混匀作封闭液。用PBS洗去脑片上的包埋剂,用封闭液室温封闭2~3 h。弃去封闭液,加入用封闭液稀释的抗TH抗体(1∶300),4℃孵育24 h。用PBST漂洗3次,每次5 min,再加入用封闭液稀释的Alexa Fluor 488山羊抗兔IgG抗体(1∶200),室温避光孵育2 h,最后用含DAPI的封片剂封片固定。数字切片扫描与分析系统下观察光敏感通道蛋白表达(红色荧光)、抗TH抗体标记的DA能神经元表达(绿色荧光)和光敏感通道蛋白与DA能神经元共表达(橙色荧光)的情况。
1.6 统计学分析
实验结果数据以±s表示,采用GraphPad Prism 6.0软件作图,并对数据进行统计分析。同一动物同一指标前后结果对比采用配对样本t检验,同一动物线索点燃时有效鼻触变化百分率与无效鼻触变化百分率的比较采用t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 光敏感通道蛋白在DAT-Cre小鼠VTA DA能神经元的表达
在VTA脑区病毒注射部位可观察到携带红色荧光的光敏感通道蛋白(图1A)和DA能神经元的特异性标志物TH蛋白(图1B)表达,且光敏感通道蛋白与TH存在良好的共表达(图1C)。提示光敏感通道蛋白在VTA的DA能神经元特异性地表达。
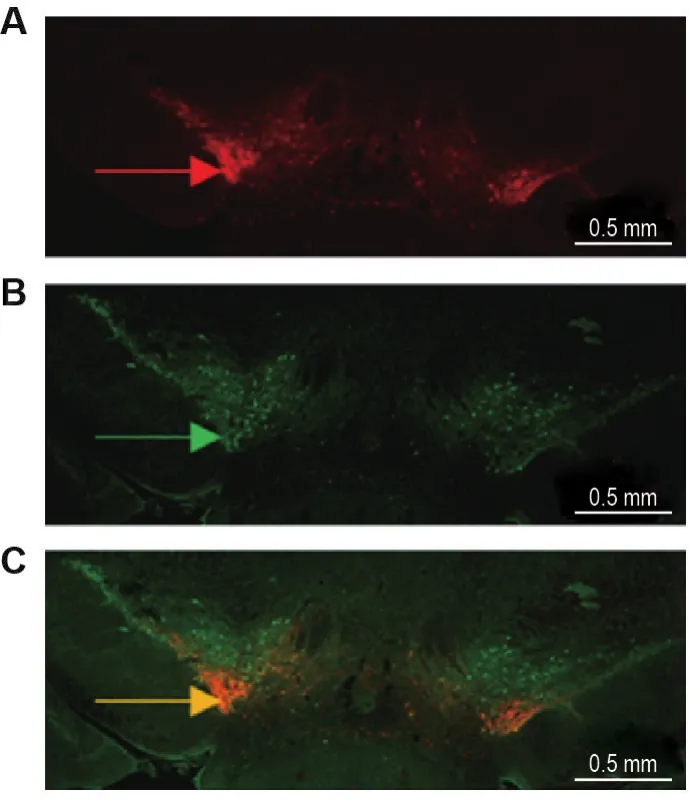
Fig.1 lmmunofluorescence expression of light sensitive channel protein in ventral tegmental area(VTA)dopaminergic neurons of DAT-Cre mice.A:the expression of channelrhodopsin 2 (ChR2).The red arrow indicates virusinfected dopaminergic neurons.B:the expression of tyrosine hydroxylase(TH).The green arrow indicates the anti-TH antibody labeled dopaminergic neurons.C:co-expression of ChR2 and TH.The orange arrow indicates the neurons in which the virus and TH antibody were co-expressed.
2.2 10%蔗糖可诱导小鼠形成自身觅糖行为
小鼠自身给糖的形成和戒断行为检测结果见图2A,其中第1~14天为自身给糖形成期,第15~30天为自身给糖首次消退期,分别记录了小鼠的有效鼻触次数、无效鼻触次数、泵出糖水次数(pump)和小鼠触糖水孔次数(sucrose)。线索点燃阶段检测结果(图2B)表明,小鼠有效鼻触次数较首次消退期稳定阶段的有效鼻触次数显著升高(P<0.01),无效鼻触次数较首次消退期稳定阶段的无效鼻触次数显著升高(P<0.01),提示灯光线索可显著诱发小鼠觅糖复吸行为的重建,线索诱发小鼠觅糖行为重建造模成功。此外,有效鼻触次数的变化百分率显著高于无效鼻触次数的变化百分率(P<0.01,图2C),提示小鼠有意识地趋向有效鼻触,进一步证实线索诱发小鼠觅糖行为重建造模成功。
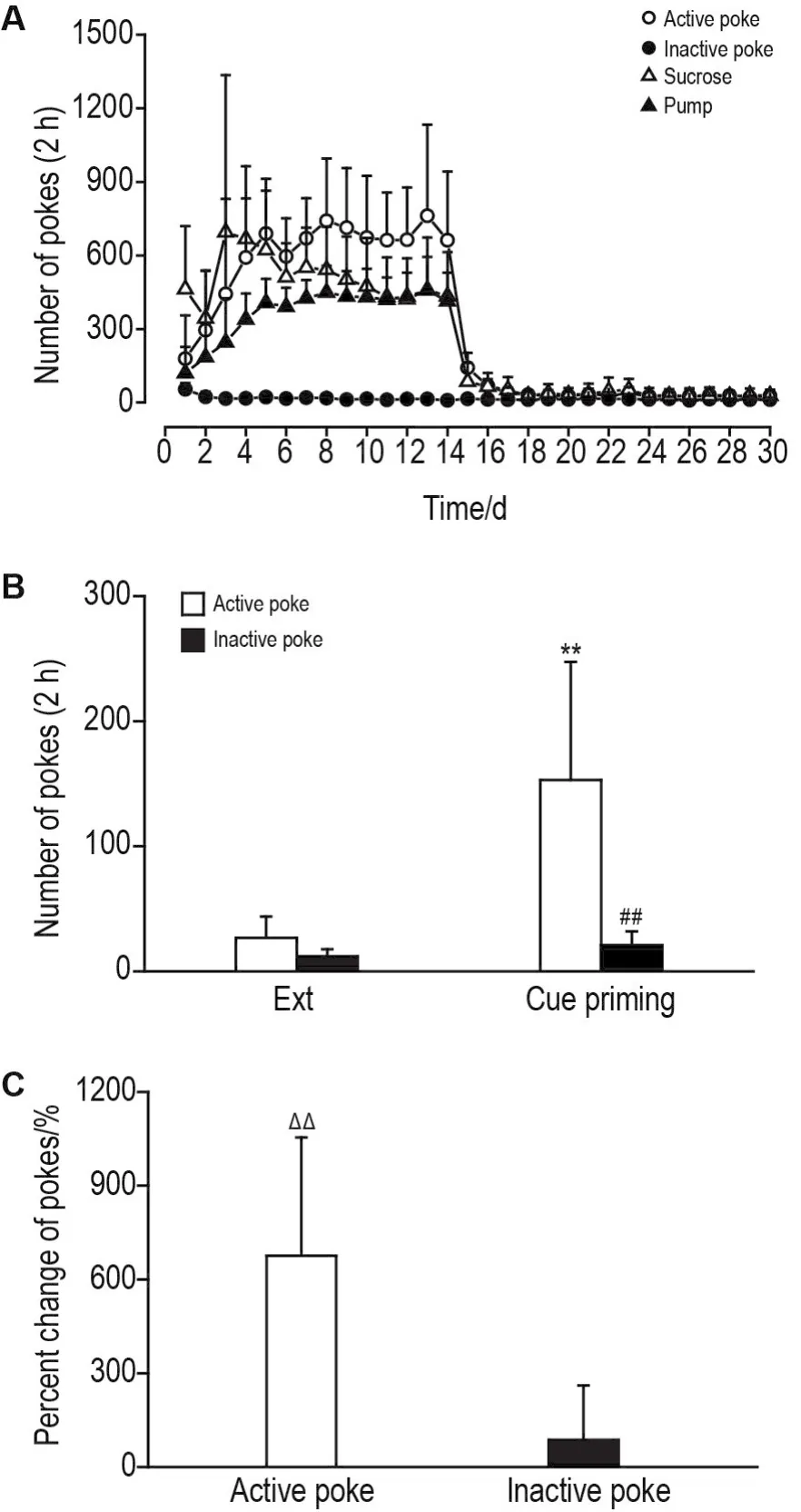
Fig.2 10% sucrose-induced sucrose self-administration behavior in DAT-Cre mice.Mice were uniformly trained in the formation and extinction of sucrose self-administration behavior.The 1st-14thday of the training was the formation period and the 15th-30thday of the training was the first extinction period,then followed by the cue priming period.A:formation and extinction of sucrose self-administration;B:the pokes of Ext and cue priming.C:the percentage change of pokes.±s,n=13.**P<0.01,compared with the active poke during Ext;##P<0.01,compared with the inactive poke during Ext;△△P<0.01,compared with the percentage change of inactive poke.Ext means the stable stage of the first extinction period.The number of active(or inactive)pokes is the average number of active(or inactive)pokes in the last 3 days of the first extinction period.The percentage change of active(or inactive)poke(%)=active(or inactive)poke of cue priming/active(or inactive)poke of Ext×100%.
2.3 激光特异性激活VTA DA能神经元对小鼠觅糖行为重建的影响
如图3所示,连续100次20 Hz 15 ms的激光刺激诱发的小鼠有效鼻触次数与第2次消退期稳定阶段有效鼻触次数无显著性差异,无效鼻触次数也无显著性差异。连续100次80 Hz 15 ms激光刺激诱发的小鼠有效鼻触次数与第3次消退期稳定阶段有效鼻触次数无显著性差异,无效鼻触次数也无显著性差异。提示短暂集中激活VTA单一类型的DA能神经元不能显著诱发觅糖行为重建。
3 讨论
本研究采用了小鼠蔗糖自身给糖模型,行为检测结果显示,与蔗糖摄入行为相关联的灯光线索可显著诱发小鼠的觅糖行为,提示在本实验系统下,经过训练的小鼠可对蔗糖产生强烈渴求。该行为特征是成瘾行为的核心症状,因此该模型可用于小鼠自身给糖行为重建的评价。
光遗传学技术可特异性操控特定核团特定神经元。有研究发现,将光敏感通道蛋白特异性地表达在VTA的DA能神经元中,连续给予100次20 Hz或80 Hz激光刺激后,可显著诱发DA能神经元激活,并介导奖赏体验[19-21],主要表现为小鼠自发活动性的升高、小鼠自身给光行为的诱导及自身给光行为随着刺激频率增加和刺激时间的延长而升高[19],提示正性强化作用驱动了自身给光行为的产生,而VTA释放的DA与正性强化作用正相关。因此推测VTA DA能神经元刺激强度的增加可能与其投射靶脑区NAc内DA含量的升高呈正相关,但目前尚无文献报道。不同频率的光刺激VTA的DA能神经元后是否会改变NAc脑区DA的含量及其变化规律仍需深入研究。在本研究中,连续给予100次20 Hz或80 Hz的激光刺激并不能诱发小鼠觅糖行为的重建,该结果初步提示,在本实验条件下,在自身给糖小鼠模型中,VTA单一类型DA能神经元的短暂激活不足以诱发小鼠觅糖行为的重建。
高糖、高脂和高蛋白等食物诱发机体产生的主观愉悦感是驱动其发展为强迫性饮食及不可控觅食行为的重要基础[3]。中脑边缘皮质DA能神经系统是机体的奖赏中枢,调控了奖赏、动机和学习等重要生理功能,是机体趋利避害的神经结构和物质基础。长时间大量的研究发现,蔗糖等食物诱发的奖赏也是通过上调VTA对NAc神经递质DA的释放而实现的[10-11],是其成为初级正性强化物的神经生物学基础。因此,该DA能神经系统在自然奖赏过程中发挥了关键作用,但对于不可控的觅糖行为,该系统的作用尚不明确。本研究发现,小鼠在主动觅糖行为消退后,特异性地激活VTA中单一的DA能神经元并未能诱发觅糖行为的出现,这与本课题组前期在线索诱发毒品成瘾复吸实验的研究结果相一致[16],但与Mahler等[22]报道的采用化学遗传学持续激活VTA的DA能神经元可诱发可卡因成瘾小鼠的觅药复吸行为结果不尽相同。二者区别之一在于,本研究所采用光遗传学技术是在激光作用下短暂激活需要干预的特异性神经元,而Mahler等所用的化学遗传学技术是在药物的作用下对特异性神经元进行较长时间(氯氮平氮氧化物的作用时间可维持2 h左右)的持续干预,虽然对于神经元细胞而言仅是激活时间和强度的不同,但在其生物学效应上却会产生很大差别。2项研究另一重要区别在于突触间隙DA含量不同,相较于短暂的DA能神经元激活,长时间的DA能神经元激活可在突触间隙释放和蓄积更高浓度的DA,从而产生更为显著的生物学变化。因此,VTA DA能神经元的持续激活诱发觅糖行为的出现值得进一步深入研究。另一方面,饮食所带来的奖赏行为大致可分为“想要”(wanting,对奖赏的动机)和“喜欢”〔liking,奖赏的享乐价值(hedonic value)〕2类。“想要”可诱导奖赏行为,“喜欢”一般不直接诱导奖赏行为,但可增强奖赏行为。最新研究发现,小鼠脑内VTA DA能神经投射所支配的NAc核部主导了“喜欢”样行为,干预NAc壳部的活性可延长小鼠的饮食时间,但不能增强小鼠的饮食动机,说明该核团亚区的活性改变仅能增加奖赏效应、促进奖赏行为,而不能诱发奖赏动机[23];而大量药物成瘾研究发现,作为VTA DA能神经投射支配的该核团另一亚区——NAc壳部,在奖赏动机的诱发中发挥了关键性作用[24-25]。而本研究在VTA脑区进行群体的DA能神经元的干预,可能会存在对不同投射脑区的DA能神经元感染效率的不同,因而造成对不同神经投射通路的刺激效率的不同,而整体表现为激活DA神经元后对小鼠的觅糖行为的重建无显著影响。
综上所述,同一脑区同一神经元可能介导不同的功能,包括投射到不同的脑区、投射到同一脑区支配不同的神经元和投射到同一脑区支配同一神经元的不同亚群。结合本研究结果和已有文献报道进一步提示,对觅糖行为重建的调控,不仅关系到脑区神经元的调控作用,更需要细化到精准的神经投射通路研究,才能更为准确地揭示自身给糖行为重建的神经生物学机制。
