乳酸菌表层蛋白对其耐消化应激及肠道黏附能力的影响
2022-06-07陈大卫程月范佳明申菲菲任晨瑜陈春萌张瑞张臣臣关成冉郑英明顾瑞霞
陈大卫,程月,范佳明,申菲菲,任晨瑜,陈春萌,张瑞,张臣臣,关成冉,郑英明,顾瑞霞
(1.扬州大学 江苏省乳品生物技术与安全控制重点实验室 食品科学与工程学院,江苏 扬州 225127;2.江苏宇航食品科技有限公司,江苏 东台224000;3.扬州市中医院,江苏 扬州 225000)
0 引言
乳酸菌作为机体肠道中的重要益生菌,具有改善肠道微生态平衡、增强机体免疫等重要的生理功能[1-2]。而乳酸菌在经过机体消化道时,只有耐受住唾液、胃液(pH 3.0)、肠液(0.1%~0.3%胆盐)和胰液(0.1%胰酶)等不良环境的应激,以较高的存活率到达并定植在肠道内,才能更好的发挥其益生作用[3-5]。乳酸菌在肠上皮细胞上的黏附有助于加强其与肠上皮细胞间的信息交流,进而通过调节肠道菌群、代谢产物以及排斥、竞争和替代等方式来抑制肠道病原菌的黏附等来改善机体免疫低下、过氧化、腹泻等不良症状[6]。因此,耐消化应激并能够较好的黏附于肠道是益生乳酸菌筛选的重要指标之一。
表层蛋白是存在于乳酸菌菌株细胞壁外层的一种蛋白,由单分子蛋白质亚单位组成,在不良环境中能够较好的保护菌体,提高其存活率,特别是在人体消化过程中面临的低pH 和高浓度胆盐等各种各样的应激[7-8];同时,表层蛋白也是乳酸菌重要的黏附素之一,能够提高菌株在肠道的停留时间,有助于其更好的黏附在肠道上。越来越多的研究也发现,表层蛋白在乳酸菌抑制大肠杆菌、金黄色葡萄球菌等肠道病原菌黏附于肠道的过程中发挥着重要作用[9-11];此外,表层蛋白还可以与免疫系统中的特异性抗原DC-SIGN 相结合,通过调控细胞因子的分泌来调节机体的免疫反应[12]。然而,目前关于耐消化应激的乳酸菌在依次经过模拟唾液-胃液-肠液应激后其表层蛋白的保护作用研究较少;对菌株抑制大肠杆菌黏附肠道的方式的影响尚不清楚。因此,本文研究了实验室保藏的来源于广西巴马长寿人群肠道和传统发酵食品的12 株乳酸菌在模拟唾液-肠液-胃液中的应激能力及其表层蛋白的携带情况,然后探讨了消化应激能力较强的乳酸菌表层蛋白对其消化应激、肠上皮Caco-2 细胞的黏附以及抑制大肠杆菌黏附肠道的影响;为益生乳酸菌的筛选及其益生作用的机制研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验菌株
植物乳杆菌(Lactobacillus plantarum)W198、S7,嗜热链球菌(Streptococcus thermophilus)W191、W165、W193、W173、W172、W169, 副干酪乳杆菌(Lactobacillusparacasei)m111,发酵乳杆菌(Lactobacillus fermentum)148,鼠李糖乳杆菌(Lactobacillus rhamnosus)108、W116,扬州大学江苏省乳品生物技术与安全控制重点实验室;大肠杆菌(Escherichia coli)CICC10899,中国工业微生物菌种保藏中心。
1.1.2 主要试剂
溶菌酶、胃蛋白酶(1∶10000)、胰蛋白酶(1∶250),生工生物工程(上海)股份有限公司;MRS(De Man Rogosa Sharpe)培养基、LB(Luria-Bertani)培养基,青岛海博生物技术有限公司;牛胆盐,北京索莱宝科技有限公司;葡萄糖,国药集团化学试剂有限公司;MEM(Minimum Essential Medium)培养液、丙酮酸钠溶液、氨基酸溶液、谷氨酰胺添加剂,美国Gibco 公司;血清,美国Clark Bioscience 公司;磷酸缓冲盐溶液(Phosphate buffer saline,PBS,pH 7.2)、0.25%胰酶细胞消化液,上海碧云天生物技术有限公司。
1.1.3 仪器与设备
全自动灭菌锅JF-SX-500,日本TOMY 公司;恒温培养箱DNP-9272,上海精宏实验设备有限公司;高速冷冻离心机Legend mach1.6 R,美国塞默飞世尔科技有限公司;超净工作台SW-CJ-1F,苏州净化设各有限公司;细胞计数仪IC1000,美国Count star 公司;荧光倒置显微镜IX2-ILL100,日本OLYMPUS 公司;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis,SDS-PAGE)电泳仪HX-2000,美国Bio-Rad 公司。
1.2 方法
1.2.1 模拟唾液、胃液、肠液及培养基的制备
模拟唾液:用去离子水配置含0.75 mmol/L CaCl2、3.70 mmol/L KH2PO4、0.15 mmol/L MgCl2(H2O)6、15.10 mmol/L KCl、0.06 mmol/L(NH4)2CO3、13.60 mmol/L NaHCO3、47.2 mmol/L NaCl 的储备液,取一定量的储备液加入溶菌酶至终浓度为100 mg/L,调节pH 至7.0,0.22 μm 滤膜除菌,现配现用。
模拟胃液:用去离子水配置含0.075 mmol/L CaCl2、0.90 mmol/L KH2PO4、0.10 mmol/L MgCl2(H2O)6、6.90 mmol/L KCl、0.50 mmol/L (NH4)2CO3、25 mmol/L NaHCO3、47.20 mmol/L NaCl 的储备液,取一定量的储备液加入胃蛋白酶至终浓度为3.00 g/L,调节pH 至3.0,0.22 μm 滤膜除菌,现配现用。
模拟肠液:用去离子水配置含0.30 mmol/L CaCl2、0.80 mmol/L KH2PO4、0.33 mmol/L MgCl2(H2O)6、6.90 mmol/L KCl、0.50 mmol/L (NH4)2CO3、85 mmol/L NaHCO3、38.40 mmol/L NaCl 的储备液,取一定量的储备液加入胰蛋白酶和胆盐至终浓度分别位0.1%和0.3%,调节pH 至8.0,0.22 μm 滤膜除菌,现配现用。
MEM 完全消化培养液:77% MEM 培养液、20%Clark 胎牛血清、1%MEM 非必需氨基酸溶液、1%丙酮酸钠溶液、1%GlutaMAX 谷氨酰胺添加剂,4 ℃贮藏备用。
1.2.2 乳酸菌的消化应激能力
将活化后的乳酸菌按3%的接种量接种于MRS 液体培养基中,37 ℃培养至对数期,收集菌株后重悬于模拟唾液中,37 ℃孵育5 min 后,8000g,4 ℃离心10 min;然后将菌体沉淀重悬于模拟胃液中,37 ℃孵育3 h 后,8000g,4 ℃离心10 min;再将菌体沉淀重悬于模拟肠液中,37 ℃孵育2 h。每一次应激后均选取合适的稀释梯度,利用平板菌落计数法计算乳酸菌的活菌数[13]。
1.2.3 乳酸菌表层蛋白的提取
将活化后的乳酸菌按3%的接种量接种于MRS 液体培养基中,37 ℃条件下培养至对数期,加入1/20 MRS 培养基体积的5 mol/L 的LiCl 溶液,于37 ℃振荡(200 rpm/min)培养30 min,4 ℃、8000g离心10 min 收集上清液,得到表层蛋白粗提液[14]。将粗提液过0.22 μm 的无菌亲水性微孔滤膜后,再装入2000 u 透析袋中于4 ℃透析,期间多次更换透析液,48 h 后离心悬浊液并收集沉淀,冷冻干燥后得到表层蛋白粗提物,采用5%的浓缩胶与12%的分离胶进行SDS-PAGE 电泳试验,保藏于-20 ℃冰箱中备用[15]。
1.2.4 表层蛋白对乳酸菌消化应激能力的影响
LiCl 处理前后的乳酸菌用无菌PBS 洗涤2 次,收集菌体沉淀,按1.3.2 章节测定乳酸菌的消化应激能力。
1.2.5 表层蛋白对乳酸菌黏附Caco-2 细胞能力的影响
将培养好的Caco-2 细胞以2×105cells/mL 接种于24 孔细胞培养板中,37 ℃,5% CO2培养至单层,用无菌PBS 洗涤2 次后,分别接种LiCl 处理前后的0.5 mL 108CFU/mL 乳酸菌菌悬液于细胞培养板中培养2 h,PBS 洗涤3 次去除未黏附的乳酸菌;每孔中加入0.15 mL 0.25%胰蛋白酶消化至细胞完全脱落后,加入0.35 mL MEM 完全培养液终止消化,采用平板菌落计数法检测乳酸菌活菌数,并根据公式(1)分别计算LiCl 处理前后乳酸菌的黏附率。

1.2.6 表层蛋白对乳酸菌抑制病原菌黏附能力的影响
按3%的接种量接种大肠杆菌于LB 液体培养基中,37 ℃恒温摇床培养12 h,离心菌体后用无菌PBS调整菌悬液浓度至1×108CFU/mL 备用;离心收集消化应激前后的乳酸菌菌体,用无菌PBS 调整菌悬液浓度至1×108CFU/mL 备用;将细胞培养板中培养至单层的Caco-2 细胞用无菌PBS 洗涤2 次,分别进行排斥、取代及竞争试验。
1.2.6.1 排斥黏附实验
分别接种0.5 mL LiCl 处理前后的乳酸菌菌悬液和0.5 mL PBS 至细胞培养板中,37 ℃,5%CO2培养1 h;PBS 洗涤2 次,除去未黏附的乳酸菌;分别加入0.5 mL 1×108CFU/mL 大肠杆菌菌悬液和0.5 mL PBS,37 ℃,5%CO2培养1 h,PBS 洗涤3 次,除去未黏附的细菌后加入0.15 mL 胰酶消化液,待细胞完全脱落后加入0.35 mL MEM 完全培养液终止消化,收集菌悬液,采用倾注平板计数法于LB 培养基中检测大肠杆菌的活菌数,并根据公式(2)计算乳酸菌对大肠杆菌的黏附抑制率。

式中:A0为未接种乳酸菌时,黏附在Caco-2 细胞上的大肠杆菌活菌数;A1为接种乳酸菌后,黏附在Caco-2 细胞上的乳酸菌活菌数。
1.2.6.2 竞争黏附实验
分别接种0.5 mL LiCl 处理前后的1×108CFU/mL乳酸菌菌悬液和0.5 mL1×108CFU/mL 大肠杆菌菌悬液至细胞培养板中,37 ℃,5% CO2培养2 h,PBS 洗涤3 次后,除去未黏附的细菌。加入0.15 mL 胰酶消化液,待细胞完全脱落后加入0.35 mL MEM 完全培养液终止消化,收集菌悬液,采用倾注平板计数法于LB 培养基中检测大肠杆菌的活菌数,根据公式(2)计算乳酸菌对大肠杆菌的黏附抑制率。
1.2.6.3 替代黏附实验
接种0.5 mL1×108CFU/mL 大肠杆菌菌悬液和0.5 mL PBS 至细胞培养板中,37 ℃,5% CO2培养1 h后,PBS 洗涤2 次除去未黏附的大肠杆菌;接种0.5 mL LiCl 处理前后的108CFU/mL 乳酸菌菌悬液和0.5 mL PBS,37 ℃,5% CO2培养1 h,用无菌PBS 洗涤3 次除去未黏附的细菌;加入0.15 mL 胰酶消化液,待细胞完全脱落后加入0.35 mL MEM 完全培养液终止消化,收集菌悬液,采用倾注平板计数法于LB 培养基中检测大肠杆菌的活菌数,根据公式(2)计算乳酸菌对大肠杆菌的黏附抑制率。
1.3 数据处理与分析
利用SPSS 20.0 软件及SigmaPlot 10.0 等软件对试验的数据进行统计和分析,数据采用均值±标准差(Mean±SD)表示,以单因素方差分析进行显著性检验,p<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 乳酸菌的消化应激能力
将12 株乳酸菌菌体依次重悬于模拟唾液、胃液及肠液中,研究其耐消化应激能力,结果如表1 所示。

表1 乳酸菌的耐消化应激能力
由表1 可知,在经过唾液应激之后,菌株148、S7及W172 的活菌数显著低于未应激的初始活菌数(p<0.05),而菌株108、W116、W165、W169、W191、W193 及W198 等则显著高于未应激的初始活菌数(p<0.05);经过模拟唾液-胃液应激后,菌株m111、W116 及W198 的活菌数显著高于未应激的(p<0.05),菌株m111 和W116 的活菌数较唾液应激后显著上升(p<0.05),W198 则无显著性变化(p>0.05),而菌株148、S7、W165、W169、W172、W173、W191 及W193 的活菌数显著降低(p<0.05);经过模拟唾液-胃液-肠液应激后,试验的12 株乳酸菌活菌数均显著降低(p<0.05),但菌株W198、S7 及m111 的存活率均大于3.53%,显著高于其他菌株(p<0.05)。
2.2 乳酸菌的表层蛋白
利用SDS-PAGE 研究菌株S7、W198 及m111 携带表层蛋白的情况,结果如图1 所示。
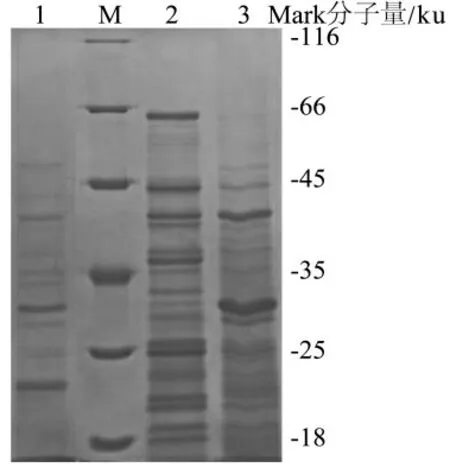
图1 乳酸菌表层LiCl 提取物的SDS-PAGE 图谱
由图1 可知,菌株S7、W198 和m111 的LiCl 提取物在25~71 ku 之间均有明显的蛋白条带,表明3 株乳酸菌均携带表层蛋白。
2.3 表层蛋白对乳酸菌耐受消化应激能力的影响
表层蛋白是菌体的生理屏障,能够维持细胞结构完整性;因此,研究了LiCl 去除乳酸菌表层蛋白前后,其对消化道的应激情况,结果见图2。

图2 表层蛋白对乳酸菌耐消化应激的影响
由图2 可知,LiCl 未处理前,菌株W198 在经过模拟唾液-胃液-肠液的应激后的存活率显著高于其余两株乳酸菌(p<0.05);而LiCl 处理后,菌株S7、W198和m111 的存活率均显著下降(p<0.05),存活率分别下降了12.08%、38.32%和2.35%;且菌株W198 的存活率依旧显著高于其余两株乳酸菌(p<0.05);表明表层蛋白在3 株乳酸菌的耐消化应激过程中对菌体具有重要的保护作用。
2.4 表层蛋白对乳酸菌黏附Caco-2 细胞能力的影响
利用LiCl 处理乳酸菌表层蛋白,研究表层蛋白对乳酸菌黏附人肠上皮Caco-2 细胞的影响,结果如图3 所示。

图3 表层蛋白对乳酸菌黏附Caco-2 细胞的影响
由图3 可知,菌株m111 对Caco-2 细胞的黏附能力显著高于其余两株菌(p<0.05);而去除表层蛋白后,菌株S7、W198 和m111 黏附率均显著下降(p<0.05),分别下降了6.64%、5.10%和14.43%,但菌株间的黏附能力无显著性差异(p<0.05);表明表层蛋白是3 株乳酸菌黏附Caco-2 细胞的主要黏附素。
2.5 表层蛋白对乳酸菌抑制病原菌黏附能力的影响
分别将3 株LiCl 处理前后的乳酸菌与大肠杆菌进行排斥、竞争和取代试验,研究表层蛋白对乳酸菌抑制大肠杆菌黏附能力的影响,结果见图4。
由图4 可知,3 株乳酸菌均可以通过抑制、竞争和取代的方式来抑制大肠杆菌对Caco-2 细胞的黏附。未经LiCl 处理的菌株S7 和W198 通过替代的方式来抑制大肠杆菌黏附Caco-2 细胞的能力显著高于其他方式(p<0.05),抑制率分别达到86.61%和71.01%;而未经LiCl 处理的菌株m111 通过竞争和替代的方式来抑制大肠杆菌黏附Caco-2 细胞的能力显著高于排斥的方式(p<0.05)。

图4 表层蛋白对乳酸菌抑制大肠杆菌黏附Caco-2 细胞的影响
经LiCl 处理即去除表层蛋白后,菌株S7 通过排斥、竞争和替代的方式来抑制大肠杆菌的黏附能力分别显著下降了4.22%、18.70%和12.06%(p<0.05);菌株W198 和m111 通过排斥和替代的方式来抑制大肠杆菌黏附的能力均显著下降(p<0.05),其中菌株W198 分别下降了41.56%和22.20%,菌株m111 分别下降了21.25%和30.40%;而菌株W198 和m111 通过竞争的方式来抑制大肠杆菌黏附的能力没有发生显著性变化(p>0.05)。
3 讨 论
由于乳酸菌肽聚糖层中N-乙酰胞壁酸和N-乙酰葡糖胺之间的β-1, 4 糖苷键很容易被溶菌酶水解[16],因此在经过模拟唾液应激后,发酵乳杆菌148、植物乳杆菌S7 及嗜热链球菌W172 的活菌数显著低于初始活菌数(p<0.05);而有些菌株的活菌数反而显著升高(p<0.05),可能是由于口腔应激上调了菌株hsp1 基因的表达[17],而hsp1 基因在菌株适应不良环境的应激过程中发挥着重要作用[18]。到目前为止,还未发现嗜热链球菌携带表层蛋白,而乳杆菌中则含有1 种甚至2-3 种表层蛋白,其在菌株面对胃液中胃蛋白酶、低pH 等不良环境的应激时具有较好的保护作用[19];因此,在经过模拟唾液-胃液应激后,实验的嗜热链球菌活菌数下降显著(p<0.05),而乳杆菌活菌数下降幅度相对较低。
在依次经过模拟唾液-胃液-肠液应激后,菌株S7、植物乳杆菌W198 和副干酪乳杆菌m111 仍具有较高的存活率,可能是由于菌株的表层蛋白及不良环境刺激菌体分泌的胆盐水解酶、胞外多糖等防御机制来保护菌体免受伤害[20];而在去除表层蛋白后,菌株的存活率及对Caco-2 细胞的黏附率均显著下降(p<0.05),表明表层蛋白是3 株乳杆菌在面对消化道不良环境应激时的主要防御屏障,也是菌株黏附肠道的主要黏附素。实验结果还发现,菌株S7、W198 和m111 均可以通过排斥、竞争和替代的方式来抑制大肠杆菌对肠细胞的黏附,表明3 株乳杆菌抑制大肠杆菌黏附肠道可能与空间位阻的作用密切相关,而这种作用可能与菌株本身对Caco-2 细胞具有高度亲和力有关[21],菌株通过占据大肠杆菌与Caco-2 细胞的结合位点来发挥其屏障作用,进而改善大肠杆菌定殖引发的肠道菌群紊乱,维护肠道微生态的平衡与功能完整性[22-23]。
去除表层蛋白后,菌株S7、W198 及m111 抑制大肠杆菌黏附肠细胞的能力显著下降(p<0.05),表明表层蛋白在菌株抑制大肠杆菌黏附肠细胞的过程中发挥重要作用;而表层蛋白的去除容易导致菌株与大肠杆菌竞争肠细胞表面黏附位点的能力减弱[21],也降低了菌株表面物质水解大肠杆菌细胞壁肽聚糖的能力[24]。去除表层蛋白前后,3 株乳杆菌抑制大肠杆菌黏附的主要方式没有发生变化,菌株S7 和W198 的主要抑制方式是替代,而m111 为竞争;表明即使在大肠杆菌事先占据黏附位点的情况下,菌株S7 和W198 到达肠道后仍具有较强的替代大肠杆菌黏附肠细胞的能力;而当菌株m111 和大肠杆菌同时进入肠道时,菌株m111 表面的黏附分子也具有较强的竞争肠细胞表面黏附位点的能力;而这种抑制大肠杆菌黏附肠道的主要方式的差异可能与菌株表层蛋白的种类有关[25]。
4 结论
植物乳杆S7、W198 和副干酪乳杆菌m111 在依次经过模拟唾液-胃液-肠液后,具有较强的耐消化应激的能力;其表层蛋白在3 株乳酸菌耐消化应激和黏附肠上皮细胞的过程中发挥重要作用,且可以通过排斥、竞争和替代的方式来抑制大肠杆菌黏附于肠上皮细胞。本文的研究为高耐受消化应激和高肠道黏附的益生乳酸菌的筛选提供参考依据。
