决明二仁方对不同便秘模型小鼠排便及血清VIP、SP的影响
2022-06-01王旭周旭晴吴笛陈姿霖蔺晓源夏旭婷郭纯
王旭 周旭晴 吴笛 陈姿霖 蔺晓源 夏旭婷 郭纯



〔摘要〕 目的 觀察决明二仁方对3种便秘模型小鼠的排便及血清血管活性肠肽(vasoactive intestinal polypeptide, VIP)、P物质(substance P,SP)的影响。方法 复制燥结失水、脾虚、复方地芬诺酯3种便秘小鼠模型,每一模型设空白组、模型组、麻仁软胶囊组和决明二仁方低、中、高剂量组,每组6只。造模成功后,模型组给予纯净水,治疗组分别给予麻仁软胶囊(0.312 g/mL)和决明二仁方低(0.208 g/mL)、中(0.416 g/mL)、高(0.832 g/mL)剂量药液。给药14 d后,观察各组小鼠的首粒黑便排出时间及4 h内排便粒数,ELISA检测小鼠血清中VIP、SP含量。结果 与同一模型的空白组比较,3种模型的模型组小鼠体质量、4 h排便粒数、血清VIP和SP浓度明显降低,首粒黑便时间明显增加(P<0.05或P<0.01)。与同一模型的模型组比较,各给药组的小鼠首粒黑便时间均明显降低(P<0.05或P<0.01);与燥结失水便秘模型组比较,各用药组的小鼠体质量、血清SP浓度均升高,决明二仁方高剂量组的4 h排便粒数和决明二仁方中、高剂量组血清VIP浓度也明显升高(P<0.05或P<0.01);与脾虚便秘模型组比较,各用药组小鼠的4 h排便粒数、血清VIP和SP浓度升高,决明二仁方中、高剂量组小鼠体质量也明显升高(P<0.05或P<0.01);与复方地芬诺酯便秘模型组比较,各用药组小鼠体质量、血清VIP和SP浓度升高,决明二仁方中、高剂量组的4 h排便粒数也明显升高(P<0.05或P<0.01)。结论 决明二仁方对3种便秘模型小鼠均具有良好的促排便作用,其作用可能与升高血清VIP、SP水平有关。
〔关键词〕 决明二仁方;便秘;燥结失水;脾虚;复方地芬诺酯;血管活性肠肽;P物质
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.05.007
Effect of Jueming Erren Formula on defecation and serum VIP and SP in
mice with different constipation models
WANG Xu ZHOU Xuqing WU Di CHEN Zilin LIN Xiaoyuan XIA Xuting GUO Chun
(1. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China;
2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To observe the effect of the Jueming Erren Formula on defecation and serum vasoactive intestinal polypeptide (VIP), substance P (SP) of mice with different constipation models. Methods Three constipation models with dry stagnation and water loss, spleen deficiency and compound diphenoxylate were established. In each model, a blank group, a model group, a Maren soft capsule group, a Jueming Erren Formula low-dose group, a Jueming Erren Formula medium-dose group and a Jueming Erren Formula high-dose group were further established, with 6 mice in each group. After successful modeling, the model group was given pure water, and the treatment groups were given Maren soft capsule and Jueming Erren Formula low-dose (0.208 g/mL), medium-dose (0.416 g/mL), high-dose (0.832 g/mL) liquid medicine, respectively. After 14 days of drug administration, the excretion time of the first black stool and the defecation grain number within 4 h were observed, and the serum content levels of VIP and SP were detected by ELISA. Results Compared with the blank group of the same model, the body weight, 4 h defecation grain number, serum VIP and SP concentrations of the mice in the model groups were significantly reduced, and the first black stool time was significantly increased (P<0.05 or P<0.01). Compared with the model group of the same model, the first black stool time in each administration group was significantly decreased (P<0.05 or P<0.01). Compared with the dry stagnation and water loss constipation model group, the body weight and serum SP concentration of mice in each administration group were increased, and the 4 h defecation grain number in Jueming Erren Formula high-dose group and serum VIP concentration in Jueming Erren Formula medium-dose and high-dose groups were also significantly increased (P<0.05 or P<0.01). Compared with the spleen deficiency constipation model group, the 4 h defecation grain number, serum VIP and SP concentrations of mice in each administration group were increased, and the body weight of mice in the Jueming Erren Formula medium-dose and high-dose groups were also significantly increased (P<0.05 or P<0.01). Compared with the compound diphenoxylate model group, the body weight, serum VIP and SP concentrations of mice in each administration group were increased, and the 4 h defecation grain numbers in the Jueming Erren Formula medium-dose and high-dose groups were also significantly increased (P<0.05 or P<0.01). Conclusion Jueming Erren Formula has good function of promoting defecation on mice with the three kinds of constipation models, which may be related to the increase of serum VIP and SP levels.
〔Keywords〕 Jueming Erren Formula; constipation; dry stagnation and water loss; spleen deficiency; compound diphenoxylate; vasoactive intestinal peptide; substance P
功能性便秘(functional constipation, FC)是非器质性原因引起的临床常见疾病,且不符合便秘型肠易激综合征,其主要表现为排便困难、排便次数减少或排便不尽感[1]。随着社会老龄化的加剧,生活节奏的加快,饮食及作息的不规律以及精神等因素的影响,我国FC患者数量迅速上升[2],治疗便秘药物的市场需求也在不断扩大。西医治疗主要以口服西药为主,但患者对现有最常用便秘制剂的疗效满意度较低。中医辨证论治可很好应对FC临床上的复杂变化,但是很难推广为改善便秘的日常保健品,而改善便秘产品如某些茶类保健品一般含有番泻叶、大黄等“猛药”,泻下作用过于剧烈,对肠道刺激大,常引起患者不适[3-4],不能长期大量服用,年老体弱者、久病体弱者、血虚气弱者、脾胃虚寒者以及妇女经期、孕期、哺乳期均不宜服用。因此,以药食两用物质开发安全、有效的改善便秘的功能食品,已成为改善便秘产品的一个重要的发展趋势和方向。
决明二仁方是湖南中医药大学第一附属医院治疗FC的临床经验方,临床应用多年,疗效显著。此验方药味不含强刺激性的泻药,作用温和,安全性高,不易形成依赖性,临床未见不良反应,对临床上的急性、慢性、习惯性便秘均有良效,具有广阔的应用前景。本实验通过观察决明二仁方对3种不同便秘模型小鼠的排便及血清中血管活性肠肽(vasoactive intestinal polypeptide, VIP)和P物质(substance P, SP)含量的影响,进一步验证决明二仁方的疗效,为今后的临床研究奠定基础,也为决明二仁方作为改善便秘的功能食品的开发提供依据。
1 材料
1.1 实验动物
SPF級雄性昆明小鼠102只,体质量(20±2) g, 由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2019-0004。本实验由湖南中医药大学第一附属医院实验动物伦理委员会批准,编号:ZYFY20210715。
1.2 药品及试剂
决明子、杭白菊、火麻仁、炙甘草、桃仁、玉竹,购自湖南中医药大学第一附属医院;麻仁软胶囊,生物含药量0.6 g/粒,由佛山手心制药有限公司提供,批号为2011367;复方地芬诺酯片,生物含药量2.5 mg/片,由常州康普药业有限公司提供,批号为2004017;印度墨汁,由上海源叶生物科技有限公司提供;小鼠SP、血管活性VIP ELISA试剂盒(上海江莱生物科技有限公司),货号分别为JL11110、JL11350。
1.3 实验仪器
TP-2200B型电子天平(湘仪天平仪器设备有限公司);H1850高速离心机(湖南湘仪实验室仪器开发有限公司);Enspir多功能酶标仪(美国Perkin Elmer公司)。
2 方法
2.1 药液制备
决明二仁方煎剂:决明子250 g、杭白菊125 g、火麻仁125 g、炙甘草125 g、桃仁62.5 g、玉竹62.5 g。决明子、杭白菊、火麻仁、甘草、桃仁、玉竹净制,备用;将决明子、火麻仁、桃仁捣碎(或粉碎成粗颗粒),与杭白菊、甘草、玉竹合并,加水煎煮2次,第1次加8倍量水,浸泡0.5 h,煎煮1 h(保持微沸1 h),第2次加6倍量水,煎煮1 h(保持微沸1 h),合并煎液,滤过,滤液备用,滤渣弃去;将滤液混匀,按1∶2∶4分为3份,根据小鼠与人的用药剂量换算公式,将药液分别浓缩至生药含量为0.208、0.416、0.832 g/mL,备用。麻仁胶囊溶液:麻仁软胶囊去包衣,加水溶解,按照小鼠与人的用药剂量换算公式,配制成生药含量为0.312 g/mL的溶液,备用。复方地芬诺酯片,研钵研磨成极细粉末,纯水配制为0.5 mg/mL的混悬液,备用。
2.2 造模方法
燥结失水便秘模型小鼠饲喂大米,禁水(包括蔬菜等一切水分),连续3 d[5];脾虚便秘模型造模用番泻叶按20 g/(kg·d)灌胃给药7 d,正常饮食饮水,造成脾虚模型;第8~14天停用番泻叶,采用饥饱失常方法延续脾虚状态,隔天喂低纤维饲料生大米4~8 g,自由饮水1次,每次30 min[6];复方地芬诺酯便秘模型小鼠按体质量以10 mg/kg灌胃复方地芬诺酯混悬液,1次/d,按0.2 mL/10 g体质量灌胃,连续灌胃14 d[7]。造模成功小鼠表现为外形干瘦,毛发粗糙,皮肤松弛,小便发黄,大便干结质硬、数量减少、颗粒细小。
2.3 动物分组及给药
3种模型分别设置空白组、模型组、麻仁软胶囊组、决明二仁方低剂量组、决明二仁方中剂量组、决明二仁方高剂量组,其中脾虚便秘模型与复方地芬诺酯便秘模型共用同一个空白组。所有小鼠适应性饲养3 d后,随机分组,每组6只。造模成功后,空白组和模型组给予纯水,麻仁软胶囊组予麻仁软胶囊溶解剂,决明二仁方低、中、高剂量组分别予生药含量为0.208、0.416、0.832 g/mL浓度的决明二仁方煎剂,按0.125 mL/10g体质量给药,2次/d,早晚各1次,连续14 d。
2.4 排便实验
所有小鼠在末次给药30 min后以0.1 mL/10 g的印度墨汁灌胃,从给墨汁开始记录各组小鼠的首粒黑便的排出时间及4 h内的排便粒数。
2.5 小鼠血清中SP、VIP含量检测
完成排便实验后,各组小鼠摘眼球采血0.8 mL置于离心管,室温下静置2 h,3500 r·min-1低温离心10 min,离心半径10 cm,分离血清备用,严格按照ELISA试剂盒操作步骤进行检测。
2.6 统计学方法
采用SPSS 21.0软件对实验数据进行分析,所有实验数据均以“x±s”表示,多组间比较满足正态性检验和方差齐性后,采用单因素方差分析方法对数据进行分析,LSD法进行两两比较,P<0.05为差异具有统计学意义。
3 结果
3.1 决明二仁方对3种便秘模型小鼠体质量的影响
造模后,与空白组比较,3种便秘模型小鼠的体质量均明显降低(P<0.01),且组间差异无统计学意义(P>0.05)。药物治疗后,各便秘模型的模型组小鼠体质量仍低于空白组(P<0.01);与模型组比较,除脾虚便秘模型决明二仁方低剂量组小鼠外,其余各便秘模型用药组小鼠的体质量均明显增加(P<0.01);其中,脾虚便秘模型的麻仁软胶囊组及决明二仁方中、高剂量组高于其低剂量组(P<0.05或P<0.01);复方地芬诺酯便秘模型小鼠的麻仁软胶囊组及决明二仁方中、高剂量组高于决明二仁方低剂量组(P<0.05或P<0.01),且决明二仁方高剂量组高于麻仁软胶囊组(P<0.05)。详见表1。
3.2 决明二仁方对3种便秘模型小鼠首粒黑便时间的影响
与空白组比较,3种模型的模型组小鼠的首粒黑便时间明显升高(P<0.05)。与模型组比较,3种模型各给药组的首粒黑便时间均明显降低(P<0.05或P<0.01);其中,燥结失水便秘模型的麻仁软胶囊组和决明二仁方高剂量组的首粒黑便时间低于决明二仁方低剂量组(P<0.05或P<0.01);脾虚便秘模型的决明二仁方高剂量组的首粒黑便时间低于麻仁软胶囊组及其低剂量组(P<0.05或P<0.01);复方地芬诺酯便秘模型的麻仁软胶囊组及决明二仁方中、高剂量组的首粒黑便时间低于决明二仁方低剂量组(P<0.05或P<0.01)。详见表2。
3.3 决明二仁方对3种便秘模型小鼠4 h排便粒数的影响
与空白组比较,3种便秘模型的模型组小鼠的4 h排便粒数明显减少(P<0.01)。与模型组比较,燥结失水便秘模型的麻仁软胶囊组和决明二仁方高剂量组的4 h排便粒数增多(P<0.05或P<0.01);脾虚便秘模型的各给药组的4 h排便粒数增多(P<0.05或P<0.01);复方地芬诺酯便秘模型的麻仁软胶囊组及决明二仁方中、高剂量组的4 h排便粒数增多(P<0.01);其中,脾虚便秘模型的决明二仁方高剂量组的4 h排便粒数高于决明二仁方低剂量组(P<0.05);复方地芬诺酯便秘模型小鼠的麻仁软胶囊组和决明二仁方高剂量组的4 h排便粒数高于决明二仁方低剂量组(P<0.05)。详见表3。
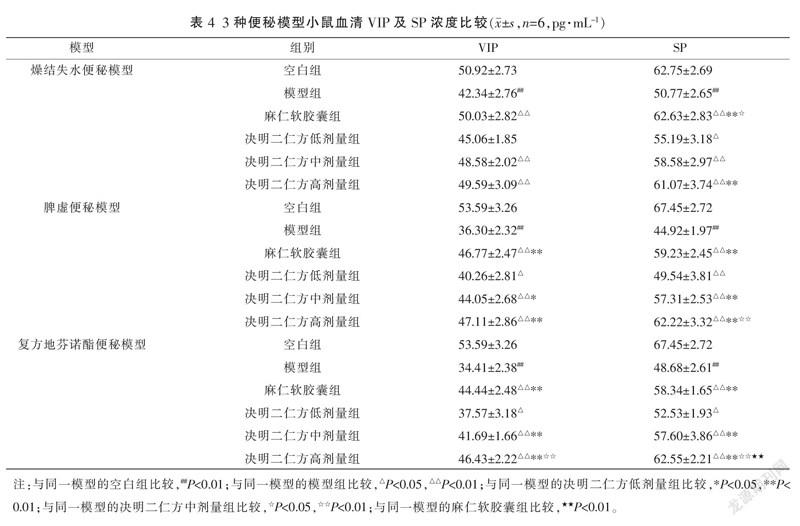
3.4 决明二仁方对3种便秘模型小鼠血清VIP及SP浓度的影响
与空白组比较,3种便秘模型的模型组小鼠血清VIP、SP浓度均明显降低(P<0.01)。与模型组比较,燥结失水便秘模型的麻仁软胶囊及决明二仁方中、高剂量组血清VIP浓度以及各用药组的血清SP浓度明显升高(P<0.01);脾虚及复方地芬诺酯便秘模型的各用药组的血清VIP、SP均明显升高(P<0.05或 P<0.01);其中,燥结失水便秘模型的麻仁软胶囊组和决明二仁方高剂量组的SP浓度高于决明二仁方低剂量组(P<0.01),且麻仁软胶囊组高于决明二仁方中剂量组(P<0.05);脾虚便秘模型的麻仁软胶囊组及决明二仁方中、高剂量组的VIP、SP浓度高于决明二仁方低剂量组(P<0.05或P<0.01),且决明二仁方高剂量组的SP浓度高于决明二仁方中剂量组(P<0.01);复方地芬诺酯便秘模型的麻仁软胶囊组及决明二仁方中、高剂量组的血清VIP、SP浓度高于决明二仁方低剂量组(P<0.01),且决明二仁方高剂量组血清VIP浓度高于其中剂量组(P<0.01),决明二仁方高剂量组血清SP浓度高于麻仁软胶囊组及其中剂量组(P<0.01)。详见表4。
4 讨论
FC病因复杂多样,其发病机制还未完全明确,现代研究发现脑肠肽变化是引起便秘的机制之一。VIP和SP是广泛参与机体胃肠活动的脑肠肽,有研究表明,FC患者的血清VIP和SP浓度较正常人会发生变化[8-9]。VIP最初于1970年报告为血管扩张剂,对发育、生长以及神经元、上皮和内分泌细胞功能的控制具有多种生理和病理作用,进而调节离子分泌、营养吸收、肠能动性、血糖控制、致癌作用、免疫反应和昼夜节律[10]。VIP可以调节肠道内水液和电解质的代謝、增加Cl-、HCO3-和水的分泌[11-12];SP是一种兴奋性神经递质,能够收缩胃肠道平滑肌,促进肠蠕动和胃排空[13]。本研究选用VIP和SP两个血清指标,旨在从肠道分泌和肠蠕动两个方面观察决明二仁方的药效。实验中,便秘模型小鼠的血清VIP和SP较空白组明显降低,给药之后,小鼠的排便情况明显改善,血清VIP和SP也有所升高,这与其他学者的相关研究报道相一致[14-15]。
中医认为FC病位在大肠,基本病机为大肠传导失常,并且与五脏关系密切。若气机壅滞,情志不舒,则大肠传导失司,糟粕内停;若气血不足,则肠道传导无力,失于润泽,大便艰难;若肾阴亏虚,则肠道失润;若肾阳不足,则阴寒内结,大便秘结[16]。决明二仁方以决明子为君药,火麻仁、桃仁为臣药,玉竹、菊花、甘草为佐使药。决明子、火麻仁、桃仁均具有润肠通便作用,作用机制各不相同,玉竹养阴润燥,菊花清热解毒,甘草清热解毒、调和诸药,6药合用可达到“相须”“相使”的协同作用,对多种原因引起的功能性便秘均有良效。决明子清肝明目、润肠通便,其主要成分是蒽醌类物质,有研究表明,蒽醌类物质是调节肠道功能的主要活性物质[17],此外,张加雄等[18]采用燥结失水便秘模型小鼠发现决明子的石油醚提取物及正丁醇提取物具有良好的泻下作用;火麻仁可治疗由于津枯血少所致的肠燥便秘,桃仁既能润肠通便,又能活血祛瘀,火麻仁和桃仁均可治疗老年性习惯性便秘[19-20]。决明二仁方所用药味均为药食两用物质,不含大黄等峻下之品,其口味也更为人们所接受,无需医生开具处方,可以在日常生活中自行服用,安全性高。
FC患者中医病因病机不尽相同,因此,本研究进行了决明二仁方对燥结失水、脾虚、复方地芬诺酯便秘模型小鼠的药效实验,以探讨其对FC患者的疗效,实验结果显示:3种模型的模型组小鼠体质量、4 h排便粒数、血清VIP和SP浓度明显降低,首粒黑便时间明显增加,与同一模型空白组比较具有显著的差异性,表明这3种不同的造模方法,均可导致小鼠便秘。3种模型小鼠在给予药物治疗后,便秘的症状均得到了不同程度的好转,血清VIP和SP浓度也有所回升,且決明二仁方中剂量的疗效与适用于老年性便秘的临床常用药麻仁软胶囊疗效接近,差异无统计学意义,表明决明二仁方对不同类型便秘的小鼠都有良好的疗效。这为决明二仁方开发成为有效改善便秘症状的功能食品提供依据,有望替代部分具有强刺激性、易形成依赖性、易发生不良反应的泻药及含有泻药成分的功能食品,市场潜力巨大。
参考文献
[1] 李军祥,陈 誩,梁 健.胆石症中西医结合诊疗共识意见(2017年)[J].中国中西医结合消化杂志,2018,26(2):132-138.
[2] 杨 直,吴晨曦,高 静,等.中国成年人慢性便秘患病率的Meta分析[J].中国全科医学,2021,24(16):2092-2097.
[3] 李东冰,谢振年,李友峰,等.麻仁软胶囊对便秘的疗效及其安全性考察[J].中草药,2013,44(12):1645-1647.
[4] 周 洲,黄为群.通便何须久用大黄[J].中国中医药信息杂志,2008,15(10):79.
[5] 曾 群,赵果毅.舒通胶囊对燥结型便秘通便功能的研究[J].中国实验方剂学杂志,2010,16(18):139-141.
[6] 夏旭婷,樊俊阳,王碧玉,等.脾虚证慢传输型便秘小鼠模型构建方法的比较研究[J].湖南中医药大学学报,2014,34(12):4-7,81.
[7] 马黎倩,李成荫,汪 悦.增液汤对慢传输型便秘模型小鼠结肠VIP及AQP3表达的影响[J].北京中医药大学学报,2015,38(8):532-534,578.
[8] 麦伟政,黄燕灵,黄海坤.伊托必利联合乳果糖对便秘型肠易激综合征患者5-HT、MOT及VIP表达水平的影响[J].国际消化病杂志,2019,39(3):228-231.
[9] 周爱岩,袁 波,刘善军,等.首荟通便胶囊联合莫沙必利对功能性便秘患者血清SP、MTL、NO水平及生活质量的影响[J].现代生物医学进展,2021,21(18):3448-3451,3457.
[10] IWASAKI M, AKIBA Y, KAUNITZ J D. Recent advances in vasoactive intestinal peptide physiology and pathophysiology: Focus on the gastrointestinal system[J]. F1000Research, 2019, 8: 1629.
[11] KUWAHARA A, KUWAHARA Y, KATO I, et al. Xenin-25 induces anion secretion by activating noncholinergic secretomotor neurons in the rat ileum[J]. American Journal of Physiology Gastrointestinal and Liver Physiology, 2019, 316(6): G785-G796.
[12] IKARASHI N, MOCHIDUKI T, TAKASAKI A, et al. A mechanism by which the osmotic laxative magnesium sulphate increases the intestinal aquaporin 3 expression in HT-29 cells[J]. Life Sciences, 2011, 88(3/4): 194-200.
[13] BARTHÓ L, HOLZER P. Search for a physiological role of substance P in gastrointestinal motility[J]. Neuroscience, 1985, 16(1): 1-32.
[14] 周永学,王郁金,张 红,等.血管活性肠肽对便秘大鼠排便及结肠组织中VIP-cAMP-PKA-AQP3信号通路的影响[J].中南大学学报(医学版),2016,41(11):1175-1180.
[15] 朱建东,冯文哲,徐漠雨,等.加味增液汤对慢传输型便秘大鼠血清SP、MTL、GAS的影响研究[J].世界最新医学信息文摘,2019,19(26):19-20.
[16] 陈 静,吕文良.中医药防治功能性便秘研究进展[J].辽宁中医药大学学报,2021,23(6):134-140.
[17] 纪晓萍,张炯丰,方东生.大黄提取物中游离蒽醌对实验性便秘小鼠的泻下作用[J].黑龙江中医药,2019,48(6):336-337.
[18] 张加雄,万 丽,胡轶娟,等.决明子提取物泻下作用研究[J].时珍国医国药,2005,16(6):467-468.
[19] KOH I, SHIN T. Hemp seed pill may improve chronic constipation of the elderly and reduce the burden of helpers[J]. Journal of Family Medicine and Primary Care, 2019, 8(6): 2150.
[20] 俞宜年.桃仁治疗习惯性便秘[J].辽宁中医杂志,2003,30(4):317.
(本文编辑 苏 维)
