基于“肾生髓,髓养骨”理论的补肾药膳方对成骨细胞Runx2、Col-Ⅰ、MGP的影响研究
2022-06-01梁百慧谭小宁成金林林静陈燕
梁百慧 谭小宁 成金林 林静 陈燕


〔摘要〕 目的 探討补肾药膳方对成骨细胞Runx2、Col-Ⅰ、MGP的影响。方法 30只大鼠随机分为两组,每组15只。一组予以生理盐水灌胃干预7 d,另一组予以同剂量补肾药膳方灌胃干预7 d;分别提取两组大鼠血清,将血清分别与骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)共同培养,生理盐水大鼠血清培养为对照组,补肾药膳方大鼠血清培养为实验组,分别提取外泌体,并加入成骨细胞中。采用Western blot法检测两组成骨相关蛋白表达量,利用RT-qPCR法检测成骨相关基因的表达。结果 与对照组比较,实验组BMSCs分泌外泌体增加(P<0.01),miR-26a-3p、miR-218-3p、miR-199b-3p表达量升高(P<0.05),Runx2、Col-Ⅰ、MGP蛋白及mRNA表达量均增多(P<0.01)。结论 补肾药膳方可能通过促进BMSCs分泌成骨相关miRNA及更多成骨转化相关因子,促进成骨细胞成骨分化。
〔关键词〕 补肾药膳方;成骨细胞;骨髓间充质干细胞;绝经后骨质疏松症;外泌体
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.05.015
Study on the effect of reinforcing kidney medicinal diet on osteoblast Runx2, Col-Ⅰ, MGP based on the theory of "kidney producing marrow, marrow nourishing bone"
LIANG Baihui TAN Xiaoning CHENG Jinlin LIN Jing CHEN Yan
(1. Hunan Academy of Traditional Chinese Medicine Affiliated Hospital, Changsha, Hunan 410006, China; 2. Hunan
University of Chinese Medicine, Changsha, Hunan 410208, China; 3. Hunan Academy of Traditional Chinese Medicine, Changsha, Hunan 410006, China)
〔Abstract〕 Objective To investigate the effect of reinforcing kidney medicinal diet on Runx2, Col-Ⅰ, MGP of osteoblasts. Methods Thirty rats were randomly divided into two groups, 15 rats in each group. One group was given normal saline gavage for 7 days, and the other group was given the same dose of reinforcing kidney medicinal diet for 7 days; serum was extracted from the two groups of rats, and the serum was co-cultured with bone marrow mesenchymal stem cells (BMSCs). The normal saline rat serum culture group was the control group, and the reinforcing kidney medicinal diet rat serum culture group was the experimental group, and exosomes were extracted respectively, and added to osteoblasts. Western blot was used to detect the expression of osteogenic-related proteins of the two groups, and RT-qPCR was used to detect the expression of osteogenic-related genes. Results Compared with the control group, the secretion of exosome of BMSCs in the experimental group was increased (P<0.01); the expression levels of miR-26a-3p, miR-218-3p and miR-199b-3p in the experimental group were higher (P<0.05); the protein expression levels of Runx2, Col-Ⅰ, and MGP and the mRNA expression levels of Runx2, Col-Ⅰ and MGP were higher (P<0.01). Conclusion Reinforcing kidney medicinal diet can promote the osteogenic differentiation of osteoblasts by promoting BMSCs to secrete osteogenic-related miRNA and more osteogenic transformation-related factors.879B4C35-4350-4A26-B58A-A13EDCB72EF8
〔Keywords〕 reinforcing kidney medicinal diet; osteoblasts; bone marrow mesenchymal stem cells; postmenopausal osteo-porosis; exosome
绝经后骨质疏松症(postmenopausal osteoporosis, PMOP)又称“Ⅰ型骨质疏松症”,以绝经后全身性骨量减少及骨组织显微结构破坏为特征,是危及中老年妇女健康的常见疾病。资料显示,在我国50岁以上人群中,女性骨质疏松症发病率达20.7%,男性达14.4%[1]。骨质疏松症一旦发生,受到轻微外力即可引发骨折,从而严重影响老年人生活质量,难以逆转,加强预防则能更有效地降低骨折的发生率。近年来,研究[2-3]认为骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是骨再生的种子细胞,在骨稳态维持中发挥重要作用。BMSCs的分泌因子并不能定向输送到病灶,只有BMSCs分泌的外泌体具有定向输送功能,并能够促进成骨细胞的增殖与分化。Liu等[4]在进行BMSCs移植研究中发现,抑制Rab27a/b表达后(外泌体释放减少),可抑制体外BMSCs的成骨分化作用,而在培养体系中补充BMSCs来源的外泌体则可以促进细胞的成骨分化作用。表明BMSCs源性的外泌体能够促进骨代谢和骨形成[5-6]。
基于中医药食同源理论,药膳以其“寓医于食”的优势,在老年疾病防治、养生康复领域上有着一定的优势,已成为防控老年人常见病的应用热点,如老年糖尿病[7]、老年功能性消化不良[8]、老年高血压和高血脂[9],其中包括PMOP。而药膳的作用机制研究极少,探索其作用机制,可为PMOP的防治提供理论依据[10]。本文对课题组前期防治PMOP的补肾药膳方[11](狗肉200 g,羊肾150 g,山药30 g,枸杞子30 g)进行研究,其中狗肉为君药,有温肾壮阳的功效,羊肾为臣药,有补肾益精的功效,山药、枸杞子为使药,有养肝益肾的功效,全方可补肾强骨生髓。前期研究证明,补肾药膳方能促进BMSCs外泌体的分泌,改善PMOP模型大鼠骨代谢水平、骨结构,促进骨形成[12],本文旨在通过观察补肾药膳方干预下BMSCs释放的外泌体对成骨细胞的成骨分化作用,深入了解补肾药膳方干预成骨过程的潜在机制。
1 材料与方法
1.1 实验材料与细胞培养
大鼠BMSCs(货号:CP-R131)、大鼠成骨细胞(货号:CP-R091)均购于武汉普诺赛生命科技有限公司;MSC完全培养基(美国ATCC公司,货号:PCS-500-030);ES级FBS(美国GIBCO公司,货号:12664025C);FGF2(货号:233-FB-025)、rhIGF-1(货号:291-G1-200)均购自美国R&D公司;CD63(货号:Ab134045)、TSG101(货号:Ab125011)、ALIX(货号:Ab275377)、Calnexin(货号:Ab92573)、Runx2(货号:Ab192256)、Col-Ⅰ(货号:Ab299450)、MGP(货号:Ab224367)均购于英国Abcam公司。
BMSCs培养条件为:含10% FBS的MSC基础培养基添加FGF2和rhIGF-1,于37 ℃、5% CO2培養箱中培养。汇合率达80%左右,0.25%胰酶消化细胞成单个细胞悬液,1∶2进行传代培养。
成骨细胞培养于含10% FBS的DMEM/F-12完全培养基中,37 ℃、5% CO2饱和湿度培养箱中培养。汇合率达80%左右,0.25%胰酶消化细胞成单个细胞悬液,1∶2进行传代培养。
1.2 实验动物
从湖南斯莱克景达实验动物有限公司(许可证号:SCXK(湘)2019-0004购买SPF级SD大鼠30只(4~5月龄),体质量为200~220 g,大鼠质量由湖南斯莱克景达实验动物有限公司检测。大鼠由湖南省中医药研究院[许可证号:SYXK(湘):2020-0008]专业人员统一管理饲养,其环境符合卫生建议标准。大鼠平均分6笼,保证室温22~25 ℃,湿度50%~70%,光照周期12 h/12 h,饲以标准大鼠颗粒饲料,常规自由摄食及饮水,定期清洗笼舍并更换垫料。
1.3 试验药物及给药方案
补肾药膳方是课题组前期确定的防治PMOP的药膳方,由狗肉200 g、羊肾150 g、山药30 g、枸杞子30 g组成,由湖南省中医药研究院附属医院提供。将补肾药膳方中的食材清洗干净后放入砂锅,加水2 L,先用武火煮沸,再改文火煎煮1 h,取汤汁,加水再煮一次,两次煎煮汤汁需浓缩至100 mL,汤汁药膳含量为4.1 g/mL,将汤汁冷却后,放置于冰箱冷冻备用。用药剂量为人体给药剂量的6倍,大鼠的给药剂量为41 g/(kg·d),折算标准体质量大鼠的给药剂量为8.2 g/d。
30只大鼠适应性饲养1周进入实验状态,随机分为两组,一组在饲料饲养的基础上用生理盐水灌胃,另一组用补肾药膳方灌胃。给药方法均为每日上午灌胃一次,每次2 mL,连续7 d。各组大鼠均自由饮食、水。动物实验获得湖南省中医药研究院附属医院伦理委员会的同意。
1.4 主要仪器
透射电镜(型号:H-7650,日立高新技术有限公司);颗粒电位滴定及粒度分析仪(型号:ZETAVIEW,德国PMX公司);电泳仪电源(型号:DYY-7C)、双垂直电泳仪(型号:DYCZ-24DN)均购自北京六一生物科技有限公司;酶标仪(型号:ELX800,美国博腾仪器有限公司);PCR仪[型号:ABI7500,赛默飞世尔(苏州)仪器有限公司]。
1.5 含药血清的制备879B4C35-4350-4A26-B58A-A13EDCB72EF8
实验大鼠在最后一次灌胃后,禁食24 h,处死后立即取材。腹主动脉取血,将每只大鼠的血液分别移入无菌离心管,并于4 ℃保鲜冰箱内静置2 h,3000 r/min,离心半径10 cm,离心20 min,吸取上层血清,同组含药血清合并。含药血清经56 ℃水浴30 min灭活,用0.22 μm微孔滤膜过滤除菌,放置于-20 ℃冰箱保存备用。
1.6 實验分组
分为实验组和对照组。实验组采用补肾药膳方灌胃大鼠血清,对照组采用生理盐水灌胃大鼠血清,超速离心去除外泌体后分别培养BMSCs,收集BMSCs的外泌体后处理成骨细胞。
1.7 外泌体的鉴定
(1)电镜检测。取10 μL外泌体溶液在透射电镜下观察,并与80 kV成像。(2)粒径检测。使用粒子矩阵ZetaView PMX 11计算外泌体浓度,用PBS稀释外泌体并对其大小及质量进行测定,并分析粒子运动轨迹。(3)BCA检测。通过测量外泌体吸光值,计算出蛋白浓度。(4)Western blot法检测外泌体膜表面标志性蛋白CD63、TSG101、ALIX、Calnexin,稀释比例均为1∶1000。
1.8 外泌体miR-26a-3p、miR-218-3p、miR-199b-3p相对表达量检测
取上述经过提取的BMSCs外泌体,采用TRNzol总RNA提取试剂进行样本RNA提取,后行RNA质量检测,采用Reverse Transcriptase M-MLV进行cDNA反转录后,进行RT-qPCR反应分析miR-26a-3p、miR-218-3p、miR-199b-3p的表达情况。目的基因引物序列见表1。
1.9 成骨细胞Runx2、Col-Ⅰ、MGP蛋白表达量及mRNA表达量检测
取上述经过提取的BMSCs外泌体,并分别将其与成骨细胞共培养12 d。取处理后的两组成骨细胞,一部分用于提取蛋白,对两组行Western blot检测。用RIPA细胞裂解液裂解细胞,获得细胞内总蛋白,通过免疫电泳检测成骨细胞中Runx2、Col-Ⅰ、MGP蛋白含量。另一部分细胞用于提取RNA,行RT-qPCR检测。采用TRNzol总RNA提取试剂提取细胞内的总RNA,通过RT-qPCR定量检测Runx2、Col-Ⅰ、MGP mRNA表达量。目的基因引物序列见表2。
1.10 统计学分析
采用SPSS 20.0统计软件进行数据分析,所有实验数据以“x±s”表示,满足正态性、方差齐性的采用独立样本t检验;对于不服从正态分布的计量资料,两组比较采用Mann-Whitney检验。P<0.05 表明差异有统计学意义。
2 结果
2.1 外泌体鉴定
所提取的外泌体粒径大小约为100 nm(图1),电镜下可见,外泌体形态均匀,标准形态清晰,为杯状脂质双分子层膜微小囊泡(图2)。所提取的外泌体中可见阳性蛋白标志物ALIX、TSG101、CD63的表达,Calnexin无表达(图3)。外泌体蛋白浓度为45.85 ng/μL(表3)。
2.2 补肾药膳方对BMSCs细胞分泌外泌体量的影响
实验组BMSCs细胞外泌体的释放启动因子Rab27a/b、ISG15蛋白表达量高于对照组(P<0.01)(图4),说明补肾药膳方能促进BMSCs细胞分泌外泌体。
2.3 补肾药膳方对BMSCs细胞分泌外泌体中成骨分化相关miRNA的影响
外泌体样本中miR-26a-3p、miR-218-3p、miR-199b-3p均有表达,实验组中的miR-26a-3p、miR-218-3p、miR-199b-3p表达量高于对照组(P<0.05)。详见表4。
2.4 补肾药膳方对成骨细胞成骨分化的影响
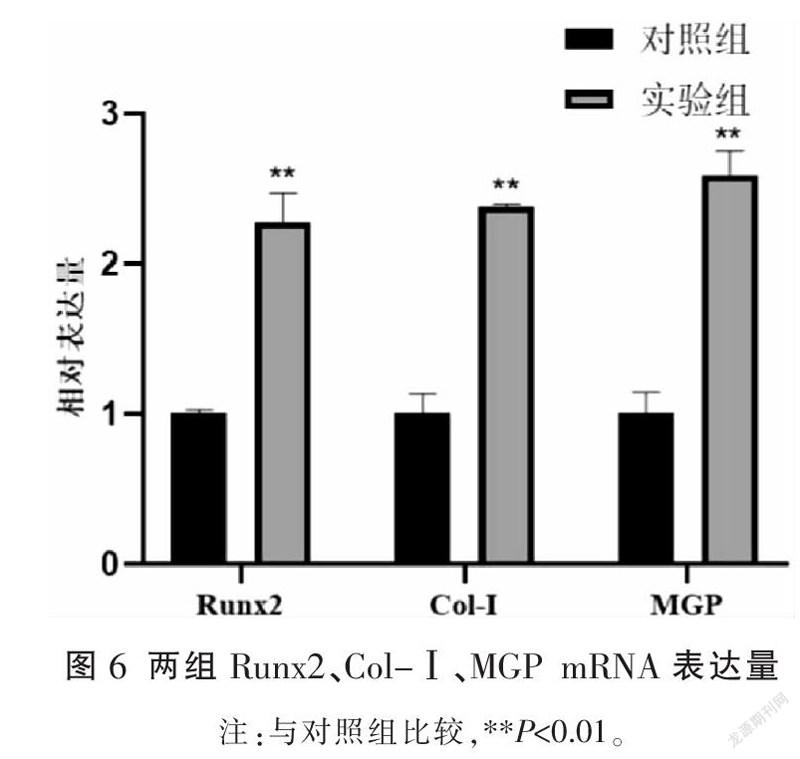
与对照组相比,实验组Runx2、Col-Ⅰ、MGP蛋白表达量及Runx2、Col-Ⅰ、MGP mRNA表达量均增多(P<0.01)。详见图5-6。
3 讨论
中医将PMOP归属于“骨痿”“骨痹”范畴,《中西汇通医经精义·五脏所主》云:“肾藏精,精生髓,髓养骨”,认为PMOP以肾虚型多见,肾精渐衰,骨髓生化无源,不能充养骨骼而致骨髓空虚,导致骨质疏松症的发生,提示肾与骨髓和骨质疏松症有着极其密切的关系。
肾为先天之本,肾藏精。《灵枢·决气》曰:“两神相搏,合而成形,常先身生,是谓精。”由此可知,“先天”是指禀受于父母的“两神相搏”之精,即胚胎,胚胎为肾所藏的先天之精。胚胎分化出人体各组织器官的干细胞(包括BMSCs),BMSCs主要来自于骨髓,在特定环境下向成骨细胞转化,即实现髓养骨,与中医理论“肾精生髓养骨”高度吻合,故认为中医理论的“髓”与BMSCs二者同源同功[13]。前期有许多研究证明,补肾药物对BMSCs的增殖和成骨分化都有促进作用,也验证了肾、髓、骨之间的关联[14-16]。药膳是中医学术与饮食文化相结合的产物,流传悠久,“寓医于食”,接受程度高,因此,将补肾药膳与BMSCs外泌体相结合,研究其对成骨细胞成骨分化的机制,对于骨质疏松症患者的治疗意义重大。
BMSCs具有很强的更新能力,可刺激相关组织再生,是可向成骨细胞转化的干细胞,有临床研究证明,BMSCs可加速改善骨质疏松症患者临床症状,推动骨再生[17]。外泌体是直径30~100 nm的由内涵体与质膜融合后分泌到细胞外环境的囊泡,内部包裹着丰富的蛋白质、RNA等生物活性分子,可以激活下游的、远程的信号分子,被认为是细胞与周围靶细胞间信息交流的重要“内分泌”物质[18]。Rab家族是一种小GTP酶蛋白,控制着细胞内囊泡的移动、定位等,Rab27a/b是外泌体释放的启动因子,控制外泌体分泌、移动[19]。879B4C35-4350-4A26-B58A-A13EDCB72EF8
本研究中,通过补肾药膳方灌胃大鼠血清、生理盐水灌胃大鼠血清对BMSCs进行干预,跟踪观察两组产生的外泌体,发现实验组释放的启动因子Rab27a/b、ISG15蛋白表达量比对照组多(P<0.01),提示补肾药膳方可促使BMSCs分泌外泌体增加。
miRNA是基因表达的关键转录调节因子,在骨形成中发挥重要作用,可加快人体骨重建进程[12]。郝静等[20]研究证明外泌体miRNA对骨代谢具有积极作用。成骨关键转录因子Runx2的活化是成骨细胞开始分化的标志,高表达Runx2能促进新生成骨细胞的分泌和成熟,并能调节多种成骨细胞增殖分化特异性标志物的表达。目前,已发现多个miRNAs调控Runx2在成骨细胞分化过程中发挥重要作用,外泌体携带并转送miRNAs至成骨细胞,有miR-124-3p、miR-590、miR-122-5p,参与成骨分化的调节,促进骨形成[21-23]。因此,探究如何促进BMSCs分泌更多含有成骨相关miRNAs的外泌体,促进成骨细胞的成骨分化,可为促进骨再生、修复骨缺损的骨质疏松症治疗提供参考。
本研究中,实验组miR-26a-3p、miR-218-3p、miR-199b-3p表达量高于对照组;实验组与对照组相比,Runx2、Col-Ⅰ、MGP蛋白与mRNA表达量增多(P<0.01)。这提示了补肾药膳方可促进BMSCs外泌體中成骨相关miRNA的产生,并在成骨转化相关因子的产生中发挥着积极作用。补肾药膳方可通过促进BMSCs分泌成骨相关miRNA及更多成骨转化相关因子,促进成骨细胞成骨分化。
间充质干细胞被认为是骨再生的种子细胞,可促进成骨再生。本实验研究补肾药膳方对成骨细胞成骨分化的影响及其机制,实验结果表明,补肾药膳方可增加ISG 15、Rab27a/b蛋白表达量,促进BMSCs外泌体的分泌,外泌体可能携带miR-26a-3p、miR-218-3p、miR-199b-3p等miRNAs增加成骨细胞中Runx2、Col-Ⅰ、MGP表达,调控成骨信号、促进成骨分化。可见未来可将外泌体作为切入点,更全面地研究中医药膳治疗PMOP的机制。
参考文献
[1] 夏维波,章振林,林 华,等.原发性骨质疏松症诊疗指南(2017)[J].中国骨质疏松杂志,2019,25(3):281-309.
[2] 陈 燕,姜胜军,彭友俭.骨髓间充质干细胞来源的外泌体对成骨细胞增殖和分化的影响[J].口腔医学研究,2019,35(4):401-404.
[3] 申恩谱,黄 霸,刘丹平等.褪黑素预处理的骨髓间充质干细胞外泌体促进骨髓间充质干细胞成骨[J].中国组织工程研究,2022,26(30):4800-4805.
[4] LIU S, LIU D, C HEN C, et al. M SC Transplantation improves osteopenia via epigenetic regulationof Notch signaling in lupus[J]. Cell Metabolism, 2015, 22(4): 606-618.
[5] 何 伟,陈荣春,曾芳俊,等.骨髓间充质干细胞来源的外泌体对骨再生机制研究[J].中国骨质疏松杂志,2019,25(4):477-483.
[6] 綦 惠,黄 霸,杰永生,等.干细胞外泌体对骨质疏松大鼠骨生成的影响[J].中国矫形外科杂志,2021,29(8):726-730.
[7] 卫 利,贾 敏.辨证食疗方在老年气阴两虚型糖尿病的应用[J].光明中医,2019,34(11):1750-1752.
[8] 俞晓青,包晓萍,王青平,等.不同中医证型药膳干预在老年功能性消化不良患者中的应用价值[J].中华全科医学,2019,17(3):483-486.
[9] 麻 静.药膳粥辅助治疗老年高血压和高血脂[J].中西医结合心血管病电子杂志,2018,6(15):75-76.
[10] 张 洁,林 静,陈 燕.补肾药膳方影响卵巢去势骨质疏松模型大鼠骨形成机制探讨[J].中国骨质疏松杂志,2020,26(3):353-356.
[11] 林 静,张 洁,梁百慧,等.基于德尔菲法选取防治肾虚型骨质疏松症药膳方的研究[J].中医药导报,2018,24(7):4.
[12] 林 静,张 洁,陈 燕.补肾药膳方对绝经后骨质疏松症模型大鼠CTX-Ⅰ指标及骨组织形态的影响[J].湖南中医药大学学报,2018,38(4):389-392.
[13] 王晓宁,许云腾,韩一旦,等.从肾藏精主骨探析绝经后骨质疏松症骨髓间充质干细胞成骨-成脂分化失衡的机制[J].中华中医药杂志,2021,36(6):4.
[14] 梁学振,杨 曦,李嘉程,等.补肾活血胶囊介导Hedgehog信号通路调控大鼠骨髓间充质干细胞成骨成脂分化[J].中国组织工程研究,2022,26(7):1020-1026.
[15] 陈锦成,朱国涛,秦晓飞,等.龟鹿二仙胶含药血清介导大鼠骨髓间充质干细胞的成骨分化[J].中国组织工程研究,2022,26(13):2020-2026.
[16] 张锦明,田滢舟,赵 玲,等.淫羊藿苷促进骨髓间充质干细胞成骨分化缓解小鼠骨质疏松的机制[J].中国组织工程研究,2022,26(19):2991-2996.
[17] 王 剑,李 想,张 宇,等.异补骨脂素干预后BMSCs源性外泌体调控MC3T3-E1成骨分化的研究[J].内蒙古医学杂志,2021,
53(4): 397-399.
[18] ZHANG L, YU D. Exosomes in cancer development, metastasis, and immunity[J]. Biochimica Et Biophysica Acta-Reviews on Cancer, 2019, 1871(2): 455-468.
[19] LI W, HU Y, JIANG T, et al. Rab27A regulates exosome secretion from lung adenocarcinom a cells A 549: involvem ent of EPI64[J]. Acta Pathologica Microbiologica Et Immunologica Scandinavica, 2014, 122(11):1080-1087.
[20] 郝 静,邓润智.骨源性外泌体微小RNA对骨代谢的影响研究进展[J].转化医学杂志,2020,9(4):246-248.
[21] 史宏利,姜 鑫,徐翠娣,等.miR-124-3p抑制骨髓间充质干细胞向成骨分化降低骨质量在老年骨质疏松中的作用[J].中华内分泌代谢杂志,2019,35(3):233-239.
[22] 周 翔.miR-590调控老年骨质疏松患者BMSCs成骨分化的研究[J].中国老年保健医学,2019,17(3):35-38.
[23] 陈思圆,魏劲松,林 翰,等.姜黄素通过微小RNA-122-5p/成纤维细胞生长因子18通路促进骨髓间充质干细胞骨向分化的研究[J].中华实验外科杂志,2020,37(6):1066-1069.
(本文编辑 周 旦)879B4C35-4350-4A26-B58A-A13EDCB72EF8
