基于黑质-纹状体多巴胺通路研究多发性抽动症“肝风”发生发展机制及泻青丸干预作用
2022-06-01周姗谢静姚冰陈佳刘思佳梁旋
周姗 谢静 姚冰 陈佳 刘思佳 梁旋

〔摘要〕 目的 探讨泻青丸对多发性抽动症(Tourette syndrome, TS)模型大鼠行为学及黑质-纹状体多巴胺(dopamine, DA)通路的干预作用及TS“肝风”可能的微观实质。方法 从50只大鼠中随机抽取40只,均采用亚氨基二丙腈造模。造模成功后,将模型大鼠随机分为模型组、硫必利组、泻青丸高剂量组、泻青丸低剂量组,未造模处理的大鼠作为空白组,每组10只。硫必利组予以盐酸硫必利片混悬液30 mg/kg灌胃,空白组、模型组予以蒸馏水灌胃。泻青丸低、高剂量组分别予以0.45、0.90 g/mL泻青丸煎剂灌胃。各组均连续灌胃14 d。于造模7 d和灌胃7、14 d,记录大鼠体质量、行为(包括刻板行为及运动行为)评分。灌胃14 d后,脱颈处死,断头取脑,采用ELISA法检测纹状体中DA、高香草酸(homovanillic acid, HVA)含量。结果 造模7 d和灌胃7、14 d,模型组运动和刻板行为评分均明显高于空白组(P<0.05)。灌胃14 d,泻青丸低、高剂量组运动和刻板行为评分均明显低于模型组(P<0.01),且泻青丸低、高剂量组运动和刻板行为评分均明显低于硫必利组(P<0.05)。造模7 d、灌胃14 d,模型组体质量均明显小于空白组(P<0.05)。灌胃14 d,泻青丸低、高剂量组体质量均明显大于模型组及硫必利组(P<0.05,P<0.01)。模型组DA、HVA含量均明显高于空白组(P<0.05,P<0.01)。硫必利组、泻青丸低剂量组、泻青丸高剂量组DA、HVA含量均明显低于模型组(P<0.01)。结论 泻青丸能够明显改善TS模型大鼠刻板行为及异常运动行为,调节大鼠黑质-纹状体DA通路中DA、HVA的代谢。DA的代谢紊乱可能是TS肝风失衡的内在微观实质。
〔关键词〕 多发性抽动症;泻青丸;亚氨基二丙腈;单胺类神经递质;肝风
〔中图分类号〕R272.3 〔文献标志码〕A 〔文章编號〕doi:10.3969/j.issn.1674-070X.2022.05.012
Study on the occurrence and development mechanism of "liver wind" in multiple tic syndrome and the intervention effect of Xieqing Pill based on substantia-nigra striatum dopamine pathway
ZHOU Shan XIE Jing YAO Bing CHEN Jia LIU Sijia LIANG Xuan
(1. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China;
2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To investigate the effect of Xieqing Pill on the behavior and substantia-nigra striatum dopamine (DA) pathway in Tourette syndrome (TS) model rats and the possible microsubstance of TS "liver wind". Methods 40 rats were randomly selected from 50 rats and were modeled with iminodipropyl nitrile. After modeling, the model rats were randomly divided into model group, tiapride group, Xieqing Pill high-dose group and Xieqing Pill low-dose group, the rats without modeling treatment were used as blank group, with 10 rats in each group. Tiapride group was given tiapride hydrochloride tablet suspension 30 mg/kg intragastric administration, and blank group and model group were given distilled water intragastric administration. Xieqing Pill high-dose group and Xieqing Pill low-dose group were given 0.45 and 0.90 g/mL, respectively. All groups were given continuous gavage for 14 days. Body weight and behavioral scores (including stereotyped behavior and motor behavior) of rats were recorded at 7 d of modeling, 7 d of intragastric administration and 14 d of intragastric administration. All groups were given continuous gavage for 14 days. Body weight and behavior (including stereotyped behavior and motor behavior) scores of rats were recorded at 7 d after modeling, 7 d and 14 d after intragastric administration. After 14 days of intragastric administration, the rats were killed by neck removal, and the brains were cut off. The content levels of DA and homovanillic acid (HVA) in striatum were determined by ELISA. Results The scores of motor and stereotyped behavior in model group were significantly higher than those in blank group at 7 d after modeling, 7 d and 14 d after intragastric administration (P<0.05). After 14 days of intragastric administration, the scores of motor and stereotyped behavior in Xieqing Pill low-dose group and Xieqing Pill high-dose group were significantly lower than those in model group (P<0.01), and the scores of motor and stereotyped behavior in Xieqing Pill low-dose group and Xieqing Pill high-dose group were significantly lower than those in tiapride group (P<0.05). The body weight of model group was significantly lower than that of blank group at 7 d after modeling and 14 d after intragastric administration (P<0.05). After 14 days of intragastric administration, the body weight of Xieqing Pill low-dose group and Xieqing Pill high-dose group was significantly higher than that of model group and tiapride group (P<0.05, P<0.01). DA and HVA content levels in model group were significantly higher than those in blank group (P<0.05, P<0.01). The content levels of DA and HVA in tiapride group, Xieqing Pill low-dose group and Xieqing Pill high-dose group were significantly lower than those in model group (P<0.01). Conclusion Xieqing Pill can improve the stereotyped behavior and abnormal motor behavior of TS model rats, regulate the metabolism of DA and HVA in substantia-nigra striatum DA pathway. The metabolic disorder of DA may be the internal micro essence of the imbalance of liver wind in TS.0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
〔Keywords〕 multiple tic syndrome; Xieqing Pill; iminodipropyl nitrile; monoamine neurotransmitters; liver wind
多发性抽动症(Tourette syndrome, TS)又称为抽动秽语综合征,是临床常见的精神心理行为疾病。其以慢性频繁发作的不自主的运动性抽动和(或)发声抽动为特征,临床症状多种多样,缺少特异性,病情反复难愈,是抽动障碍分型中病情较复杂、病情严重的一种分型[1]。该病反复发作对于患儿的学习、社交、日常生活、心理健康都会造成严重的影响,并且对家庭物质及精神压力、社会管理均有诸多不利影响[2-3]。目前,本病的发病机制尚未明确[4],“神经递质失衡”,特别是以多巴胺(dopamine, DA)为主的功能紊乱导致TS发病得到众多学者认可。DA是一种单胺类神经递质,高香草酸(homovanillic acid, HVA)是DA的代谢产物,是反映DA活性的主要指标。DA具有广泛的调节作用,其与多种生理活动尤其是运动、情感、应激行为等关系密切。DA的代谢失常被认为是TS发病的基础。目前,认为合成DA的脑区及其纤维投射组成4条通路,其中黑质-纹状体通路是一个被认为参与控制运动、调节行为活动的基本结构。DA能纤维的主要富集区在黑质-纹状体部,DA由黑质神经元合成释放,释放的DA可与纹状体中DA受体相结合,产生兴奋作用,导致抽动发生[5-6]。
中医学通过辨证施治,可以明显减轻患儿抽动症状,不良反应较少,改善症状后不易复发,与西药相比具有独到的优势[7]。《小儿药证直诀·卷下》载:“泻青丸……治肝热搐搦,脉洪实。当归、龙脑、川芎、山栀子仁、川大黄、羌活、防风……等分为末,炼蜜和丸,鸡头大。每服半丸或一丸,煎竹叶汤同沙糖温水化下。”为探究泻青丸治疗TS的作用靶点及作用机制,以亚氨基二丙腈(iminodipropionitrile, IDPN)诱导的TS模型大鼠为研究对象,探讨泻青丸对TS大鼠行为学及黑质-纹状体DA通路的影响。
1 材料
1.1 实验动物
幼年(3周龄)SPF级SD大鼠50只,雌雄各半,体质量(60±10) g,由湖南中医药大学中心实验室提供,实验大鼠购买于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-004、SYXK(湘)2020-0010。将50只实验大鼠分笼饲养于湖南中医药大学第一附属医院SPF级实验室,动物实验伦理审批号:ZYFY20200825,饲养温度为23~26 ℃,湿度为50%~60%,日照时间从8∶00至18∶00,严格按照实验室要求,每2 d更换1次垫料,厚度3~5 cm,保持清洁干燥。
1.2 主要仪器
超低温冷冻储存箱(海尔集团电器有限公司,型号:DW-86L338A);电热恒温水浴锅(天津泰斯特仪器有限公司,型号:DK-98-I);台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);全自动酶标洗板机(深圳市汇松科技发展有限公司,型号:PW-812);多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:MB-530);电热恒温培养箱(北京市永光明医疗仪器有限公司,型号:DHP-500)。
1.3 主要试剂
HVA试剂盒(武汉华美试剂公司,批号:CSB-EQ027785RA);DA试剂盒(武汉华美试剂公司,批号:CSB-E08660r);IDPN(湖南海星生物科技有限公司,批号:1829733)。
1.4 主要藥物
泻青丸组成:当归、川芎、龙胆、栀子、大黄、羌活、防风、淡竹叶、沙糖各5 g(处方为3~8岁儿童临床用药剂量),同一批次中药饮片均购自湖南中医药大学第一附属医院中药房;盐酸硫必利片(江苏恩华医药业股份有限公司,0.1 g/片,批号:LY210507)。
2 方法
2.1 药物配制
2.1.1 中药制备方法 生药用10倍蒸馏水浸泡0.5 h后加蒸馏水分次煎煮,共2次,第1次0.5 h,第2次1∶8比例加入蒸馏水3600 mL煎煮0.5 h,合并2次滤液,过滤后的药液共4500 mL,将煎煮好的药液倒入旋转蒸发仪中,调试好仪器,加速蒸发后获得药液约800 mL,将药液放置水浴锅恒温加热,浓缩至400 mL,4 ℃冰箱保存待用。按照人与大鼠体表面积比值计算大鼠给药剂量,用蒸馏水配制成低、高剂量的泻青丸药液,生药浓度为分别为0.45、0.90 g/mL。配制后立即置于4 ℃冰箱中保存,备用。
2.1.2 西药制备 将盐酸硫必利片碾碎成药粉,加入适量蒸馏水后使用超声波清洗机进行快速溶解,按照人与大鼠体表面积比值计算大鼠给药剂量,配制成3.194 mg/mL的混悬液。配制后立即置于4 ℃冰箱中保存,备用。
2.2 动物分组和药物干预
2.2.1 动物分组及造模 50只大鼠适应性喂养4 d后称质量,随机取40只,根据车立纯、柯钟灵等[8-9]采用IDPN造模,据李亚群等[10]的报道,本课题选用所用IDPN药物剂量为300 mg/kg,配制成30 mg/mL的IDPN溶液,每天1次,连续腹腔注射7 d。余下10只为空白组,使用腹腔注射的方法注射等体积生理盐水,每天1次,连续腹腔注射7 d。参照文献[10-11]的判定方法,全部大鼠都出现刻板行为及运动行为表明造模成功,再随机分为模型组、硫必利组、泻青丸低剂量组、泻青丸高剂量组,每组10只。
2.2.2 药物干预 自造模成功之日起进行。空白组:等体积蒸馏水每天1次灌胃连续2周。模型组:等体积蒸馏水每天1次灌胃连续2周。硫必利组:盐酸硫必利片混悬液每次30 mg/kg,每天1次,连续灌胃2周。泻青丸低剂量组:泻青丸药液每次1 mL/100 g,每天1次,连续灌胃2周。泻青丸高剂量组:泻青丸药液每次1 mL/100 g,每天1次,连续灌胃2周。0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
2.3 观察指标
2.3.1 行为评分 参照文献[11]的判定方法,于造模7 d和灌胃7、14 d,将大鼠放入实验观察笼内适应5 min后,进行双盲观察1 h,记录大鼠行为,包括刻板行为及运动行为。(1)刻板行为:无刻板行为计0分;有旋转行为计1分;头和颈部的上下运动过多计2分;头和颈部的上下运动过多加旋转行为计3分;头向侧摆合并头和颈部的上下运动过多计4分。(2)运动型为:安静或正常活动计0分;过度兴奋计1分;探究行为增加,不连续吸鼻计2分;不停跑动计3分;不停跑动伴有惊跳计4分。
2.3.2 体质量 于造模7 d和灌胃7、14 d,测量大鼠体质量,并记录。
2.3.3 纹状体中DA及HVA含量 在末次给药24 h后用脱椎法处死所有大鼠,在冷冻台上快速断头取脑组织,剥离纹状体并将其放入离心管内,将离心管放置于-80 ℃冰箱保存待测。在湖南中医药大学第一附属医院中心实验室采用ELISA法检测大鼠纹状体中DA及HVA含量,主要步骤:(1)将试剂在室温(18~25 ℃)下平衡40 min,按说明书配制试剂,备用。(2)分空白孔、标准孔和待测样本孔,空白孔不加任何溶液,其余每孔分别加标准品或待测样本50 μL,立即加入抗体工作液50 μL(空白孔不加),混匀后覆上板贴,置37 ℃温育40 min。弃去孔内液体后甩干、洗板。每孔酶结合物工作液100 μL(空白孔不加)再进行温育、甩干、洗板等步骤。最后按照顺序每孔加底物溶液避光显色20 min后再加终止液50 μL,终止反应后用酶标仪在450 nm波长依序测量各孔的光密度值。
2.4 统计学方法
采用SPSS 25.0统计软件进行数据分析及处理。计量资料以“x±s”表示,若同时满足正态性分布及方差齐性,则采用单因素方差分析;若方差齐,则采用t检验;若数据不满足正态性分布或方差不齐,则采用非参数检验中的H检验。以P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠运动行为评分比较
造模7 d和灌胃7、14 d,模型组运动行为评分均明显高于空白组(P<0.05)。造模7 d、灌胃7 d,模型组、硫必利组、泻青丸低高剂量、泻青丸高剂量组间运动行为评分比较,差异均无统计学意义(P>0.05)。灌胃14 d,硫必利组运动行为评分与模型组比较,差异无统计学意义(P>0.05);泻青丸低、高剂量组运动行为评分均明显低于模型组(P<0.01);泻青丸低、高剂量组运动行为评分均明显低于硫必利组(P<0.05);泻青丸低剂量组运动行为评分与泻青丸高剂量组比较,差异无统计学意义(P>0.05)。详见表1。
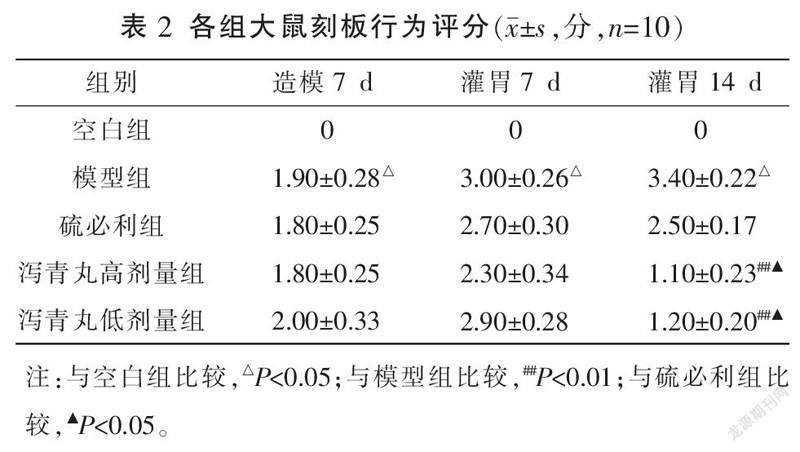
3.2 各组大鼠刻板行为评分比较
造模7 d和灌胃7、14 d,模型组刻板行为评分均明显高于空白组(P<0.05)。造模7 d、灌胃7 d,模型组、硫必利组、泻青丸低剂量组、泻青丸高剂量组间刻板行为评分比较,差异均无统计学意义(P>0.05)。灌胃14 d,硫必利组刻板行为评分与模型组比较,差异无统计学意义(P>0.05);泻青丸低、高剂量组刻板行为评分均明显低于模型组(P<0.01);泻青丸低、高剂量组刻板行为评分均明显低于硫必利组(P<0.05);泻青丸低剂量组刻板行为评分与泻青丸高剂量组比较,差异无统计学意义(P>0.05)。详见表2。
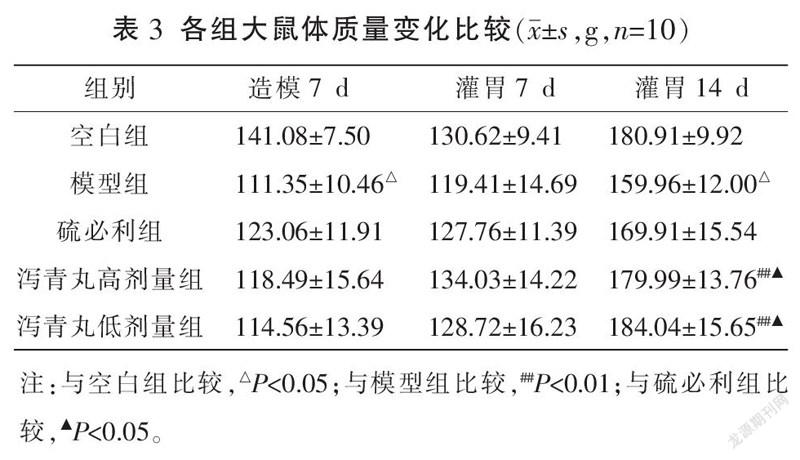
3.3 各组大鼠体质量比较
造模7 d、灌胃14 d,模型组体质量均明显小于空白组(P<0.05)。造模7 d、灌胃7 d,模型組、硫必利组、泻青丸低剂量组、泻青丸高剂量组间体质量比较,差异均无统计学意义(P>0.05)。灌胃14 d,泻青丸低、高剂量组体质量均明显大于模型组(P<0.01);泻青丸低、高剂量组体质量均明显大于硫必利组(P<0.05)。详见表3。
3.4 各组大鼠纹状体中DA和HVA含量比较
模型组DA、HVA含量均明显高于空白组(P<0.05,P<0.01)。硫必利组、泻青丸低高剂量、泻青丸高剂量组DA、HVA含量均明显低于模型组(P<0.01)。硫必利组、泻青丸低高剂量、泻青丸高剂量组间DA、HVA含量比较,差异均无统计学意义(P>0.05)。详见表4。
4 讨论
除了行为学的改变,实验中大鼠造模后体质量有明显减轻的一个过程,但是实验过程中无大鼠死亡。IDPN造模后大鼠从易激惹逐渐变为安静、活动减少,毛色变黯淡,尾巴及耳朵颜色由粉红转为紫红,颜色转暗。刻板行为与异常运动行为改变越明显,上述表现越典型。另外,药物干预后大鼠并未出现大鼠腹泻的情况,但粪便颜色由浅转深,泻青丸低、高剂量组较明显。泻青丸原方为丸剂,本研究采用煎剂,大黄剂量为5 g,且经熬煮、浓缩,煎煮时间较长。研究表明,大黄久煎、制用、小量时泻下作用较缓和[12-13],故本研究大鼠大便无明显改变,未出现腹泻的情况可能与大黄的用量、煎服法及配伍有关。本研究结果表明,泻青丸低、高剂量组大鼠体质量增长较明显,泻青丸可以柔肝、泻肝,肝木不乘土,则脾土健运,饮食正常。
研究证实,单胺类神经递质如DA、去甲肾上腺素(norepinephrine, NE)与TS相关,而DA系统对TS的发生尤为重要[14-15]。脑内DA能神经元及其纤维的分布有以下4条通路:(1)新边缘系统DA通路;(2)结节漏斗DA通路;(3)黑质-纹状体DA通路,其中黑质-纹状体DA通路可易化大脑皮质,产生兴奋作用,且DA能纤维的主要富集区在黑质-纹状体部;(4)中脑-皮质DA通路[16]。大脑皮质边缘系统及下丘脑等结构与情绪关系密切。神经递质中DA、NE、5-羟色胺、谷氨酸及乙酰胆碱等神经递质与情绪的关系密切[17-18]。TS肝风证候表现主要为摇头、仰颈、扭肩等。本研究结果表明,灌胃14 d,泻青丸低、高剂量组运动和刻板行为评分均明显低于模型组(P<0.01);泻青丸低、高剂量组体质量均明显大于模型组(P<0.01)。泻青丸低、高剂量组DA、HVA含量均明显低于模型组(P<0.01);泻青丸可以通过调节黑质-纹状体DA通路中单胺类神经递质代谢来改善TS模型大鼠异常运动行为及刻板行为。泻青丸这一泻肝经典方剂可以通过肝的疏泄作用于黑质-纹状体DA通路以调控DA及其代谢物HVA来畅达脑内气机,从而平息肝风。神经递质按功能区分有抑制性神经递质及兴奋性神经递质两种,DA与情绪、感觉、认知认为及运动行为关系密切[19]。DA受体分为兴奋性的D1和抑制性的D2[20]。这与中医学阴阳的概念类似,依据中医学阴阳理论,动者、亢奋者属于阳,静者、抑制者属于阴。综上,DA的代谢紊乱可能是TS肝风阴阳失衡的内在微观实质。0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
参考文献
[1] 江载芳,申昆玲,沈 颖.诸福棠实用儿科学[M].8版.北京:人民卫生出版社,2015:2089-2092.
[2] 柯钟灵,陈燕惠.抽动障碍相关共患病及治疗[J].中国儿童保健杂志,2020,28(9):1009-1012.
[3] ROSE O, HARTMANN A, WORBE Y, et al. Tourette syndrome research highlights from 2018[J]. F1000 Research, 2019, 8: 988.
[4] 翟 倩,丰 雷,张国富.儿童抽动障碍病因及治疗进展[J].中国实用儿科杂志,2020,35(1):66-72.
[5] PASCHOU P, M?LLER-VAHL K R. Editorial: The neurobiology and genetics of Gilles de la Tourette syndrome: New avenues through large-scale collaborative projects[J]. Frontiers in Psychiatry, 2017(8): 197.
[6] HIENERT M, GRYGLEWSKI G, STAMENKOVIC M, et al. Striatal dopaminergic alterations in Tourette's syndrome: A meta-analysis based on 16 PET and SPECT neuroimaging studies[J]. Translational Psychiatry, 2018, 8(1): 143.
[7] 杨翠玲,张肖瑾,赵 琼,等.儿童多发性抽动症的中医认识及治疗概况[J].中国中西医结合儿科学,2020,12(4):277-280.
[8] 车立纯,刘秀梅,衣明纪.抽动障碍动物模型的行为学研究[J].中国儿童保健杂志,2013,21(12):1273-1276.
[9] 柯钟灵,陈燕惠.抽动障碍动物模型的研究进展[J].中国实验动物学报,2020,28(3):416-422.
[10] 李亞群,阎兆君,金 枝,等.关于不同剂量IDPN诱导TS大鼠模型的探讨[J].中华中医药学刊,2016,34(10):2442-2444.
[11] 肖愉箫,万 滨.静安口服液对DOI致抽动症模型大鼠行为学的影响[J].药学研究,2018,37(6):322-324,355.
[12] 李东辉,王临艳,吴红伟,等.四种因素对大黄有效成分含量影响研究[J].辽宁中医杂志,2021,48(6):182-185.
[13] 蔡悦萍,张贵君,向 丽,等.大黄甘草汤汤剂与煎膏剂中药效成分的比较研究[J].现代药物与临床,2019,34(6):1625-1629.
[14] NOMURA Y. Pharmacological therapy for Tourette syndrome: What medicine can do and cannot do[J/OL]. Biomedical Journal, 2021: 1-11(2021-09-20)[2021-10-29]. https://doi.org/10.1016/j.bj.2021.09.002.
[15] 翟 倩,丰 雷,张国富.儿童抽动障碍病因及治疗进展[J].中国实用儿科杂志,2020,35(1):66-72.
[16] UEDA K, BLACK K J. Recent progress on tourette syndrome[J]. Faculty Reviews, 2021, 10: 70.
[17] 田 蕾,吴 昊,韦 昱,等.肝主疏泄与单胺类神经递质相关性的研究进展[J].环球中医药,2019,12(4):636-640.
[18] 冯 鹏,史正刚,孙治前,等.中医药调控神经递质治疗多发性抽动症的研究进展[J].中药药理与临床,2020,36(2):267-271.
[19] HE F, ZHENG Y, HUANG H H, et al. Association between Tourette syndrome and the dopamine D3 receptor gene rs6280[J]. Chinese Medical Journal, 2015, 128(5): 654-658.
[20] 刘玉河,王树新,程东源,等.多巴胺作用机制及代谢[J].实用医药杂志,2003,20(6):473-474.
(本文编辑 黎志清)0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
