枸杞多糖对脂多糖刺激下牙周膜干细胞氧化应激及炎症因子表达影响的初探
2022-06-01马琳莎吴玉冰范晓川李菁王焱炜黄晓峰
马琳莎 吴玉冰 范晓川 李菁 王焱炜 黄晓峰


〔摘要〕 目的 探索枸杞多糖(Lycium barbarum polysaccharide)改善牙龈卟啉单胞菌来源脂多糖(lipopolysaccharide, LPS)刺激下牙周膜干细胞的氧化应激水平及炎症因子的表达情况。方法 体外培养人牙周膜干细胞,分为对照组(不加LPS刺激,不加枸杞多糖处理)、炎症组(10 μg /mL LPS)、实验组(分为炎症+50 μg/mL枸杞多糖组、炎症+100 μg/mL枸杞多糖組、炎症+200 μg/mL枸杞多糖组3个亚组,均采用10 μg/mL LPS刺激,之后分别添加50、100、200 μg/mL枸杞多糖处理)。CCK-8检测细胞活性,荧光探针检测活性氧水平,RT-PCR及Western blot检测炎症因子表达。结果 牙周膜干细胞在10 μg/mL LPS刺激下,增殖活力下降,活性氧水平及炎症因子表达上调;枸杞多糖能够提升LPS刺激下的牙周膜干细胞增殖活性,且100 μg/mL与200 μg/mL(P<0.01)枸杞多糖较50 μg/mL(P<0.05)枸杞多糖提升更明显;50 μg/mL枸杞多糖能下调LPS刺激下IL-1β基因表达(P<0.05);100 μg/mL与200 μg/mL枸杞多糖能下调LPS刺激下活性氧水平(P<0.05),以及TNF、IL-1β基因(P<0.01)和蛋白表达水平(P<0.05)。结论 枸杞多糖能够改善LPS刺激下牙周膜干细胞的活性,减轻活性氧水平及炎症因子表达,保护牙周膜干细胞抗氧化潜能。
〔关键词〕 枸杞多糖;脂多糖;牙周膜干细胞;氧化应激;炎症因子
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.05.013
Effect of Lycium barbarum polysaccharide on oxidative stress and inflammatory factors
expression of periodontal ligament stem cells under lipopolysaccharide stimulation
MA Linsha1, WU Yubing2, FAN Xiaochuan1, LI Jing1, WANG Yanwei1, HUANG Xiaofeng1*
(1. Department of Stomatology, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China; 2. Division of Development Planning and Hospital Management, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To explore the influence of Lycium barbarum polysaccharide (LBP) on the oxidative stress and inflammatory factors expression of periodontal ligament stem cells stimulated by lipopolysaccharide (LPS) derived from porphyromonas gingivalis. Methods Periodontal ligament stem cells were obtained and cultured in vitro, and divided into control group (no LPS stimulation, no LBP treatment), inflammatory group (10 μg/mL LPS) and experimental group (divided into three subgroups of inflammation+50 μg/mL LBP group, inflammation+100 μg/mL LBP group, inflammation+200 μg/mL LBP group, all were treated with 10 μ g/mL LPS stimulation, followed by 50, 100, 200 μg/mL LBP treatment). CCK-8 was conducted to evaluate cell viability. The fluorescent probe was used to detect reactive oxygen species. The inflammatory factors expression was measured by RT-PCR and Western blot. Results The viability of periodontal ligament stem cells was decreased and the expression of reactive oxygen species and inflammatory factors increased under 10 μg/mL LPS stimulation; LBP could enhance the proliferation activity of LPS-stimulated periodontal ligament stem cells, and 100 μg/mL and 200 μg/mL (P<0.01) LBP increased more obviously than 50 μg/mL (P<0.05) LBP; 50 μg/mL LBP could down-regulate IL-1β gene expression under LPS stimulation (P<0.05); 100 μg/mL and 200 μg/mL LBP could down-regulate the level of reactive oxygen species (P<0.05), TNF, IL-1β gene (P<0.01) and protein expression (P<0.05) under LPS stimulation. Conclusion LBP can improve the viability of LPS-stimulated periodontal ligament stem cells and alleviated the reactive oxygen species level and inflammatory factors expression, and protect the antioxidant potential of periodontal ligament stem cells.0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
〔Keywords〕 Lycium barbarum polysaccharide; lipopolysaccharide; periodontal ligament stem cell; oxidative stress; inflammatory factors
牙周炎是牙菌斑堆积所致慢性感染性疾病,伴随牙龈卟啉单胞菌来源脂多糖(lipopolysaccharide,LPS)等毒力因子作用于局部,诱发炎症反应,损害细胞功能,并最终导致牙槽骨丧失,牙松动脱落[1]。牙周膜干细胞是来源于牙周组织的间充质干细胞,具有自我更新、多向分化及免疫调节潜能,在组织再生及牙周病治疗领域研究颇多[2-3]。然而,在炎症环境下,牙周膜干细胞的生物学功能出现损伤,因此,减轻炎症刺激对干细胞的损伤具有实际意义[4]。
枸杞多糖(Lycium barbarum polysaccharide)提取自中药枸杞子,枸杞多糖中含有多种活性成分,包括多肽、多聚糖等,在抗衰老、抗氧化及免疫调节方面具有重要价值,近年来受到广泛关注[5-6]。而枸杞多糖是否能改善毒力因子LPS刺激下牙周膜干细胞的生物学功能,尚未见报道。因此,本研究以牙周膜干细胞为对象,LPS构建体外炎症环境,从枸杞多糖抗氧化潜在功效的角度,探索枸杞多糖对牙周膜干细胞的保护作用及炎症因子表达的影响。
1 材料与方法
1.1 材料
1.1.1 细胞 牙周膜干细胞取自北京友谊医院口腔科因正畸需要拔除前磨牙的患者,年龄18~28岁,拔牙术前签署知情同意,本实验经首都医科大学附属北京友谊医院生命伦理委员会批准(批号21-2019)。本研究中细胞来自符合纳入标准志愿者6人(男女各3人),每项实验均进行生物学重复及技术重复。志愿者纳入标准:18~28岁青年男女,自愿参与此项研究,因正畸需要而拔除前磨牙,无牙体、牙周疾病,无全身系统性疾病,无遗传性疾病;排除标准:不符合纳入标准者。
1.1.2 试剂 枸杞多糖标准品(批号:P7850)购自北京索莱宝科技有限公司;牙龈卟啉单胞菌来源脂多糖(批号:SMB00610)购自美国Sigma公司;a-MEM培养基(批号:12571071)、胎牛血清(批号:10100147)及0.25%胰酶(批号:25200072)购自美国Gibco公司;增强型CCK-8试剂盒(批号:C0041)、活性氧检测试剂盒(批号:S0033S)购自上海碧云天生物技术有限公司;细胞总RNA提取、反转录、PCR试剂盒购自北京天根生物科技有限公司;Western blot试剂购自美国赛默飞世尔科技公司及美国CST公司。
1.2 方法
1.2.1 实验分组 本研究分为对照组(正常条件培养细胞)、炎症组(添加10 μg/mL LPS构建炎症刺激)及实验组[添加10 μg /mL LPS构建炎症刺激后12 h添加不同浓度枸杞多糖培养后检测,根据枸杞多糖浓度(分别为50、100、200 μg/mL枸杞多糖)不同,再分3个实验亚组:炎症+50 μg/mL枸杞多糖组、炎症+100 μg/mL枸杞多糖组、炎症+200 μg/mL枸杞多糖组]。
1.2.2 牙周膜干細胞原代培养 采用酶消化法培养牙周膜干细胞,取前磨牙牙根中三分之一段牙周膜组织,在无菌EP管中剪碎,配置Ⅰ型胶原酶3 mg/mL,37 ℃摇床消化40 min,而后加入a-MEM终止消化,1000 r/min离心5 min(离心半径:20 cm),弃上清,含15%胎牛血清的a-MEM重悬,37 ℃、5% CO2培养箱中培养,约5 d后观察细胞贴壁后换液,之后每隔3 d换液,细胞融合达到培养皿80%,0.25%胰酶消化,采用免疫磁柱分选STRO-1阳性细胞,继续传代培养,采用第4代细胞进行实验。
1.2.3 细胞活性检测 细胞以103/孔接种于96孔板,贴壁后添加10 μg/mL LPS,12 h后分别添加50、100、200 μg/mL枸杞多糖,再过12 h后每孔加入10 μL增强型CCK-8溶液,培养箱内继续孵育1 h,采用酶标仪在450 nm测定吸光度,每组3个复孔,实验重复3次。
1.2.4 细胞活性氧水平检测 细胞以104/孔均匀接种于12孔板,贴壁后添加10 μg/mL LPS,12 h后添加50、100、200 μg/mL枸杞多糖,再过12 h后采用DCFH-DA荧光探针原位装载于培养板中的细胞,无血清培养基清洗后,每孔加入DCFH-DA荧光探针,37 ℃细胞培养箱内孵育20 min,无血清培养基清洗3遍,倒置荧光显微镜下拍摄,并通过Image-Pro Plus 6.0进行荧光强度的定量分析。
1.2.5 细胞炎症因子基因表达 细胞以105/孔均匀接种于6孔板,贴壁后添加10 μg/mL LPS,12 h后添加50、100、200 μg/mL枸杞多糖,再过12 h后采用试剂盒提取细胞总RNA,测定RNA浓度后,经过42 ℃孵育15 min,95 ℃孵育3 min,反转录成cDNA,而后进行Real-time PCR,以GAPDH为内参基因。PubMed Gene及Primer bank用于引物设计,Primer blast用于引物序列验证,引物序列见表1。
1.2.6 细胞炎症因子蛋白表达 细胞以105/孔均匀接种于6孔板,贴壁后添加10 μg/mL LPS,12 h后添加50、100、200 μg/mL枸杞多糖,再过12 h后采用RIPA裂解液(添加1 mmol/L PMSF蛋白酶抑制剂)处理细胞,刮刀收集并超声振荡提取总蛋白,BCA法测定蛋白浓度,加入5×上样缓冲液100 ℃变性5 min,配制10% SDS-PAGE凝胶,取40 μg蛋白上样,电泳分离,切胶转PVDF膜(湿转,220 mA,60 min),5% BSA溶液封闭,洗膜,一抗(1∶1000)4 ℃过夜,GAPDH为内参蛋白,TBST洗膜,二抗(1∶5000)室温2 h,TBST洗膜,加入ECL发光液,曝光拍照,ImageJ软件分析条带。0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
1.3 统计学分析
使用SPSS 26.0软件进行统计学分析,使用Shapiro-Wilk法进行正态性检验,数据符合正态性,采用单因素方差分析比较组间差异。以P<0.05为差异具有统计学意义。
2 结果
2.1 枸杞多糖对LPS刺激下牙周膜干细胞活性的影响
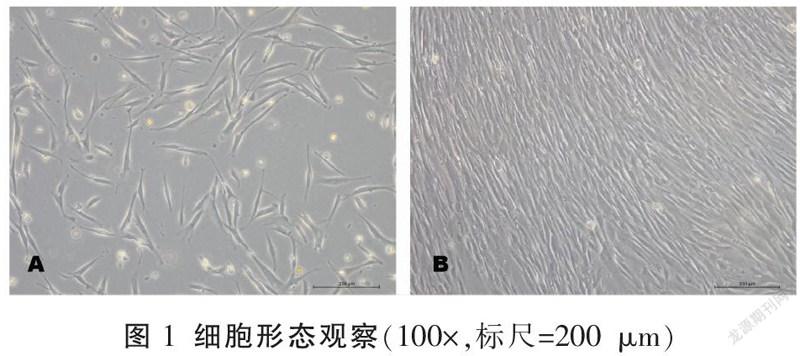
体外培养约5 d后,可见细胞贴壁生长,呈梭形或纤维条状,见图1A。细胞分选后传代培养,采用第4代进行实验研究,见图1B。采用CCK-8进行细胞活性评估,发现10 μg/mL LPS能够抑制细胞活性,炎症组与对照组差异具有明显统计学意义(P<0.01),而添加枸杞多糖均能够缓解LPS对牙周膜干细胞增殖活性的抑制作用,50 μg/mL枸杞多糖组牙周膜干细胞增殖活性强于对照组(P<0.05),并且100 μg/mL与200 μg/mL枸杞多糖组提升牙周膜干细胞增殖活性更明显(P<0.01)。详见图2。
2.2 枸杞多糖对LPS刺激下牙周膜干细胞活性氧水平的影响
10 μg/mL LPS能明显促使细胞活性氧水平上升,與对照组相比差异具有明显统计学意义(P<0.01);添加50 μg/mL枸杞多糖,差异无统计学意义(P>0.05);100 μg/mL枸杞多糖与200 μg/mL枸杞多糖均能有效减少LPS刺激下牙周膜干细胞的活性氧水平(P<0.05)。详见图3。
2.3 枸杞多糖对牙周膜干细胞炎症水平的影响
在10 μg/mL LPS刺激下,牙周膜干细胞TNF、IL-1β、IL-6基因表达均显著上调(P<0.05);50 μg/mL枸杞多糖能够部分下调IL-1β的基因表达(P<0.05);100 μg/mL与200 μg/mL枸杞多糖能够明显下调TNF及IL-1β的基因表达(P<0.01)。其中IL-6未见明显改变(P>0.05)。100 μg/mL与200 μg/mL枸杞多糖均能下调TNF及IL-1β蛋白表达水平(P<0.05)。详见图4。
3 讨论
枸杞是养生常用保健食品,枸杞经过提炼所得产物枸杞多糖是一种大分子水溶性多糖,由甘露糖、木糖等6种单糖构成的蛋白多糖,近年受到中西医研究者的关注[7],多项研究显示枸杞多糖具有抗炎、抗氧化、调节免疫及抗肿瘤等药理作用[8-11]。有研究报道,枸杞多糖能够抑制NK-kB信号通路保护人脐静脉血管内皮细胞增殖活性及其分泌功能,另有学者发现枸杞多糖通过下调人视网膜上皮细胞内炎性因子IL-1β、MCP-1及NK-kB/MAPK通路阻止LPS诱导的细胞炎性反应,并抑制高糖环境下人视网膜血管内皮细胞的增殖和VEGF表达[12-14]。研究认为枸杞多糖发挥抗氧化作用的机制主要包括:清除超氧阴离子自由基及羟基自由基,激活Nrf2抗氧化通路,增强超氧化物歧化酶SOD的活性,调控凋亡途径,减轻氧化应激损伤[15-16]。
牙周膜干细胞是来源于牙周组织的间充质干细胞,对牙周组织微环境稳态维持及牙周健康至关重要,临床获取较容易,并具有较强增殖活性、多向分化能力、免疫调节能力,因此,在口腔组织再生及牙周疾病治疗方面有较好的应用前景[17-18]。然而干细胞在局部微环境中,面临多种来自细菌自身或代谢产生的毒性产物,对干细胞的活性及功能造成损伤。LPS来自革兰氏阴性菌细胞壁成分,通过细胞表面Toll样受体,激活下游炎症通路,通过激活NF-kB和IRF途径,促使与炎症相关基因启动子或增强子结合,启动炎症因子包括TNF、IL-1β、IL-6等多效性促炎细胞因子的表达,进一步激活iNOS,而炎症因子会诱发ROS聚集,从而破坏细胞及微环境稳态[19-21]。低水平ROS起调节细胞信号作用,而过量ROS则会是引起氧化应激,导致DNA损伤,如DNA突变、缺失、断裂等致命遗传效应;导致生物膜脂质过氧化,从而生成异常代谢物;导致蛋白质变性,损伤细胞功能,细胞出现生长抑制、凋亡、自噬、坏死等[22-23]。因此,本研究亦选择检测炎症因子TNF、IL-1β、IL-6的基因及蛋白表达水平,从而初步探索枸杞多糖改善炎症刺激下牙周膜干细胞抗氧化的机制。而枸杞多糖通过何种途径改善牙周膜细胞抗氧化及维护细胞内稳态,以及炎症通路与抗氧化系统的内在联系,有待后续研究进一步阐明。
目前,众多研究围绕调控牙周膜干细胞的药物及作用机制,以对抗炎症环境下牙周膜干细胞受损的生物学功能,而枸杞多糖对牙周膜干细胞的作用尚无报道,本实验结果表明,枸杞多糖能够增强LPS刺激下牙周膜干细胞的活性,下调炎症因子TNF、IL-1β基因表达,减轻胞内ROS水平,并发现这一作用与枸杞多糖的浓度呈现一定剂量效应关系,为后续研究枸杞多糖对牙周膜干细胞生物学功能的作用及深入探索机制奠定了基础;另一方面,枸杞是保健食品,咀嚼枸杞能否对牙周组织炎症有直接作用,尚未见报道。此外,枸杞多糖成分与药效,还与不同产地及品种的枸杞,以及不同提取过程有重要关系。
综上,通过本实验发现枸杞多糖能够维护牙周膜干细胞的增殖活性,通过下调炎症基因的表达缓解氧化应激损伤,提示枸杞多糖对牙周膜干细胞的保护作用,而枸杞多糖发挥作用的具体组分及机制仍有待进一步验证,同时本研究也为枸杞多糖用于口腔疾病的治疗带来了启发。
参考文献
[1] KINANE D F, STATHOPOULOU P G, PAPAPANOU P N. Periodontal diseases[J]. Nature Reviews Disease Primers, 2017, 3: 17038.
[2] SEO B M, MIURA M, GRONTHOS S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. The Lancet, 2004, 364(9429): 149-155.0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
[3] LEI M, LI K, LI B, et al. Mesenchymal stem cell characteristics of dental pulp and periodontal ligament stem cells after in vivo transplantation[J]. Biomaterials, 2014, 35(24): 6332-6343.
[4] ZHANG Z Y, DENG M T, HAO M, et al. Periodontal ligament stem cells in the periodontitis niche: Inseparable interactions and mechanisms[J]. Journal of Leukocyte Biology, 2021, 110(3): 565-576.
[5] GAO Y J, WEI Y F, WANG Y Q, et al. Lycium barbarum: A traditional Chinese herb and A promising anti-aging agent[J]. Aging and Disease, 2017, 8(6): 778-791.
[6] 谢 文,陈华国,赵 超,等.枸杞多糖的生物活性及作用机制研究进展[J].食品科学,2021,42(5):349-359.
[7] WANG H Q, LI J N, TAO W W, et al. Lycium ruthenicum studies: Molecular biology, phytochemistry and pharmacology[J]. Food Chemistry, 2018, 240: 759-766.
[8] 陈艳平,廖海锋,王 青,等.不同分子量的枸杞多糖组分对树突状细胞成熟的影响[J].中国免疫学杂志,2021,37(4):385-388,394.
[9] PENG Q, LIU H J, SHI S H, et al. Lycium ruthenicum polysaccharide attenuates inflammation through inhibiting TLR4/NF-κB signaling pathway[J]. International Journal of Biological Macromolecules, 2014, 67: 330-335.
[10] 孙 青,陈 亮,陈莎莎.枸杞多糖通过核因子κB信号通路对过氧化氢诱导的神经细胞損伤保护作用的研究[J].中国糖尿病杂志,2021,29(9):692-699.
[11] XIAO J, WANG F, LIONG E C, et al. Lycium barbarum polysaccharides improve hepatic injury through NFkappa-B and NLRP3/6 pathways in a methionine choline deficient diet steatohepatitis mouse model[J]. International Journal of Biological Macromolecules, 2018, 120(Pt B): 1480-1489.
[12] 刘 倩,韦建瑞,张 雷,等.枸杞多糖通过抑制NF-κB信号通路保护脂多糖损伤的人脐静脉血管内皮细胞增殖活性与分泌功能[J].暨南大学学报(自然科学与医学版),2017,38(3):240-246.
[13] 闫 梅,马 倩,马雅玲,等.枸杞多糖对LPS诱导的人视网膜色素上皮细胞炎性反应的影响及机制[J].国际眼科杂志,2021,21(3): 411-416.
[14] 杨雪艳,彭 俊,赵永旺,等.枸杞多糖对高糖环境下HRCEC增殖及VEGF表达的影响[J].湖南中医药大学学报,2020,40(11): 1310-1314.
[15] CHENG J, ZHOU Z W, SHENG H P, et al. An evidence-based update on the pharmacological activities and possible molecular targets of Lycium barbarum polysaccharides[J]. Drug Design, Development and Therapy, 2015, 9: 33-78.
[16] VARONI M V, PASCIU V, GADAU S D, et al. Possible antioxidant effect of Lycium barbarum polysaccharides on hepatic cadmium-induced oxidative stress in rats[J]. Environmental Science and Pollution Research International, 2017, 24(3): 2946-2955.
[17] MA L S, HU J C, CAO Y, et al. Maintained properties of aged dental pulp stem cells for superior periodontal tissue regeneration[J]. Aging and Disease, 2019, 10(4): 793-806.0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
[18] TOMOKIYO A, WADA N, MAEDA H. Periodontal ligament stem cells: Regenerative potency in periodontium[J]. Stem Cells and Development, 2019, 28(15): 974-985.
[19] SCHERES N, CRIELAARD W. Gingival fibroblast responsiveness is differentially affected by Porphyromonas gingivalis: Implications for the pathogenesis of periodontitis[J]. Molecular Oral Microbiology, 2013, 28(3): 204-218.
[20] BARADARAN RAHIM V, KHAMMAR M T, RAKHSHANDEH H, et al. Crocin protects cardiomyocytes against LPS-Induced inflammation[J]. Pharmacological Reports, 2019, 71(6): 1228-1234.
[21] NARUISHI K, NAGATA T. Biological effects of interleukin-6 on gingival fibroblasts: Cytokine regulation in periodontitis[J]. Journal of Cellular Physiology, 2018, 233(9): 6393-6400.
[22] DI MEO S, REED T T, VENDITTI P, et al. Role of ROS and RNS sources in physiological and pathological conditions[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 1245049.
[23] SCHERZ-SHOUVAL R, ELAZAR Z. Regulation of autophagy by ROS: Physiology and pathology[J]. Trends in Biochemical Sciences, 2011, 36(1): 30-38.
(本文編辑 苏 维)0D79B62C-9DB2-4857-A4C1-F7BF93609B3A
