策勒黑羊ERα基因克隆、生物信息学分析及卵巢组织表达研究
2022-05-31张继虎米热妮萨王子渲刘书东
张继虎,米热妮萨,王子渲,李 琳,邢 凤,刘书东
(1.塔里木大学动物科学与技术学院,阿拉尔 843300;2.新疆生产建设兵团塔里木畜牧科技重点实验室,阿拉尔 843300;3.青岛农业大学动物科技学院,青岛 266109)
雌激素是动物体内最重要的激素之一,对完善动物生殖系统的结构和功能是不可或缺的。雌激素通常指内源性雌激素化合物17β-雌二醇(E2)、雌酮和雌三醇,其中E2活性最强[1],其广泛的生物作用是通过与其受体结合实现的,这几种物质都可与由雌激素受体1(estrogen receptor 1,ESR1)基因编码的雌激素受体α(estrogen receptor α,ERα)结合[2-4]。ERα是核受体家族的成员[5-6],对促进动物卵泡发育和提高繁殖力具有重要作用[7-9]。促性腺激素释放激素(gonadotropin releasing hormone,GnRH)通过脉冲式的方式从下丘脑分泌到垂体前叶,并与垂体促性腺激素细胞上的受体结合,从而促进促卵泡素(follicle stimulating hormone,FSH)和促黄体生成素(luteinizing hormone,LH)的合成与分泌[10]。FSH和LH通过血液循环到达卵巢促进卵巢发育,并促使卵巢合成雌激素[11]。雌激素与卵巢ERα特异性结合后,能够刺激卵巢颗粒细胞的增殖,增强颗粒细胞促性腺激素受体的水平和颗粒细胞对促性腺激素的应答[12]。研究表明,ERα基因发生突变后可导致卵巢早衰丧失生育功能[13];小鼠ERα基因缺失后可导致LH分泌和发情周期紊乱[14]。策勒黑羊是新疆地区典型的代表品种,具有性成熟早、常年发情等特点,目前,国内外少有对策勒黑羊ERα基因原核表达及卵巢不同时期表达等研究报道。鉴于此,本研究对策勒黑羊ERα基因进行克隆及生物信息学分析,并对卵泡期、黄体期和妊娠30 d时卵巢中ERα基因表达量进行检测,以期为研究ERα基因的功能及其对绵羊发情、妊娠等过程的影响提供参考依据。
1 材料与方法
1.1 试验材料
于新疆阿克苏市某屠宰场,选取处于卵泡期、黄体期和妊娠30 d的策勒黑羊各3只,取适量上述时期策勒黑羊的卵巢,用无菌手术剪剪碎后放入冻存管中,迅速置于液氮中保存,后转入-80 ℃保存备用。
1.2 主要试剂
DL2000 DNA Marker、胶回收试剂盒均购自天根生化科技(北京)有限公司;pMD19-T克隆载体购自TaKaRa公司;反转录试剂盒、qPCR试剂盒、大肠杆菌DH5α感受态细胞均购自北京全式金生物技术有限公司;蓝白斑试剂购自北京索莱宝科技有限公司。
1.3 RNA提取及cDNA合成
取出卵巢组织,利用Transzol法提取RNA,提取后的RNA利用核酸蛋白检测仪检测浓度。检测合格后,统一浓度进行反转录合成cDNA。反应体系:5×gDNA Eraser 2 μL,gDNA Eraser 1 μL,RNA 2 μL,RNase-free ddH2O 5 μL,反应条件为42 ℃ 2 min;RNase-free ddH2O 4 μL,Prime Script RT Enzyme Mix 1 μL,RT Prime Mix 1 μL,5×Prime Script Buffer 4 μL,反应条件为42 ℃ 2 min,37 ℃ 15 min,85 ℃ 5 s。
1.4 引物设计及合成
从GenBank中查询绵羊ERα基因序列(登录号:XM_042253635.1),用Primer Premier 6.0软件设计ERα基因克隆和实时荧光定量PCR引物,引物信息见表1。其中,引物ERα-1扩增编码区的1-805 bp,ERα-2扩增777-1 401 bp,ERα-3扩增1 284-1 791 bp。以β-actin(登录号:NM_001009784.3)为内参基因。引物均由生工生物工程(上海)股份有限公司合成。
1.5 PCR扩增及克隆
PCR反应体系25 μL:2×EasyTaqPCR SuperMix 12.5 μL,上、下游引物各1 μL,cDNA 1 μL,ddH2O 9.5 μL。PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,退火30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸5 min;4 ℃保存。其中,ERα-1为60 ℃(每个循环降0.5 ℃),ERα-2和ERα-3退火温度为58 ℃。PCR产物经1.5%琼脂糖凝胶电泳检测后,胶回收纯化目的片段并与pMD19-T克隆载体连接,16 ℃反应30 min;取5 μL连接产物与100 μL大肠杆菌DH5α感受态细胞混合,冰浴30 min后,42 ℃条件下热激90 s,快速转入离心管中冰浴;加入400 μL不含氨苄青霉素的培养基,于37 ℃、225 r/min摇床复苏90 min。待溶液变浑浊后,4 000 r/min离心5 min,弃掉适量上清液,将剩余菌液均匀地铺在含有氨苄青霉素的培养基上,放置30 min;将培养皿倒置,37 ℃恒温培养箱过夜。合格菌液送至生工生物工程(上海)股份有限公司进行测序。
1.6 相似性比对、系统进化树构建及生物信息学分析
通过DNAMAN对策勒黑羊ERα基因与山羊(登录号:XP_042109569.1)、牛(登录号:NP_001001443.1)、猪(登录号:XP_020938716.1)、人(登录号:NP_000116.2)、犬(登录号:XP_038509304.1)和小鼠(登录号:NP_001289460.1)进行氨基酸序列相似性比对,并构建系统进化树。利用表2中的在线软件对策勒黑羊ERα氨基酸序列进行生物信息学分析。
1.7 实时荧光定量PCR扩增
以策勒黑羊cDNA为模板,利用实时荧光定量PCR检测卵泡期、黄体期和妊娠30 d时策勒黑羊卵巢中ERα基因表达量。PCR反应体系15 μL:2×Transtant qPCR Mix 7.5 μL,上、下游引物各0.5 μL,cDNA 1 μL,ddH2O 5.5 μL。PCR反应条件:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火15 s,68 ℃延伸20 s,共40个循环。
1.8 统计分析
采用2-ΔΔCt法计算策勒黑羊卵泡期、黄体期和妊娠30 d时卵巢中ERα基因的相对表达量。使用SPSS 24.0统计软件进行单因素方差分析(One-Way ANOVA),数据以平均值±标准差表示,P<0.05表示差异显著。
2 结 果
2.1 策勒黑羊ERα基因克隆
策勒黑羊ERα基因PCR扩增产物经1.5%琼脂糖凝胶电泳检测后显示片段长度分别为811、624和791 bp(图1),与预期片段大小相符。将得到的序列通过BLAST比对发现,与绵羊ERα基因序列相似性为99.78%。在第242、681、862和1 238 bp处发生替换,分别是G→A、G→A(同义突变)、G→C和G→T,相应第81、288和413位氨基酸变化为G→D、R→T、R→S。
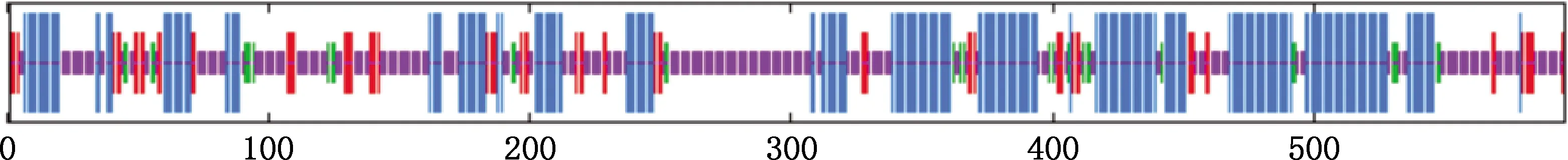
绵羊ERα氨基酸序列划分为6个功能区(图2),分别是A/B(1-182)、C(183-258)、D(259-328)、E(329-525)和F(526-596)区域,在A/B和E域含分别含有AF-1(activation function 1)和AF-2(activation function 2)区域。策勒黑羊ERα氨基酸突变分别在发生A/B、D和E区域。
2.2 相似性比对及系统进化树构建
由图3可知,策勒黑羊ERα氨基酸序列与山羊、牛、猪、人、犬和小鼠的相似性较高,分别为99.0%、97.8%、92.4%、92.1%、91.2%和89.1%。由图4可知,策勒黑羊与山羊、牛的亲缘关系较近,与猪、人和犬的亲缘关系次之,与小鼠的亲缘关系最远。
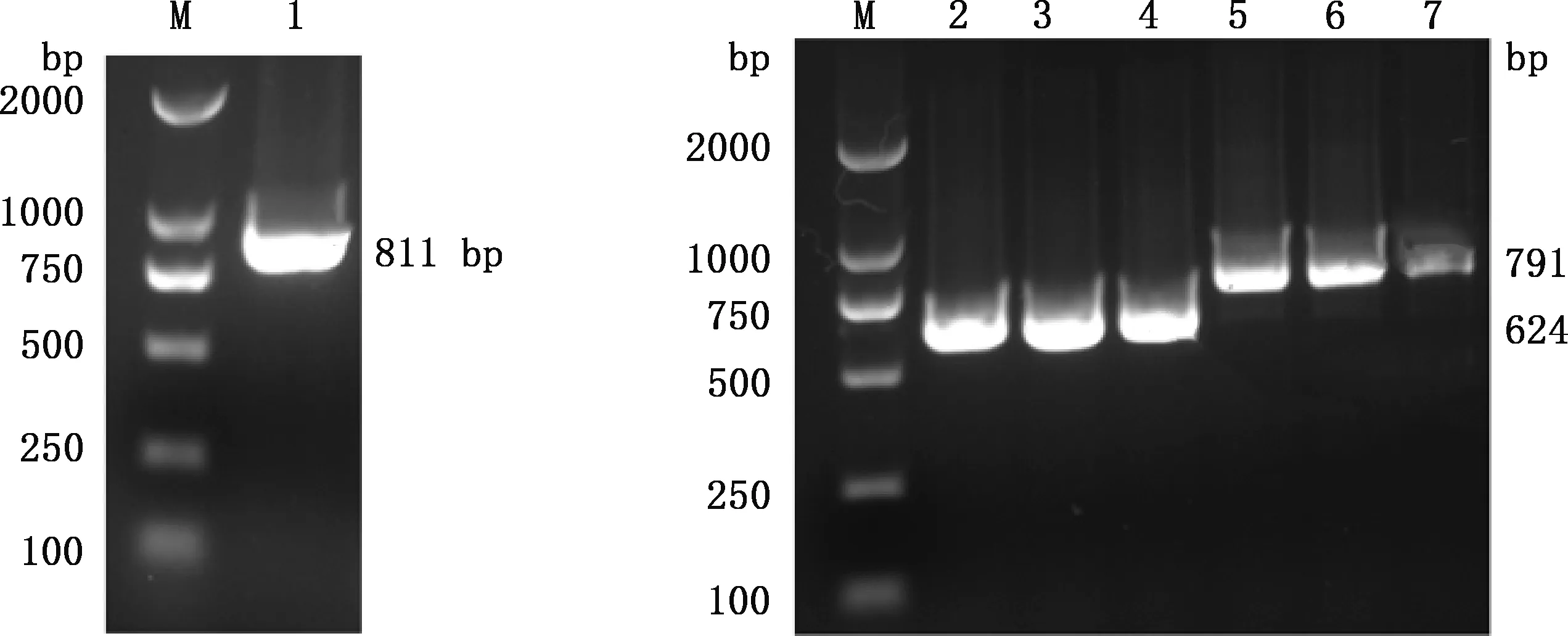
M,DL2000 DNA Marker;1,ERα-1基因PCR扩增产物;2~4,ERα-2基因PCR扩增产物;5~7,ERα-3基因PCR扩增产物M,DL2000 DNA Marker;1,PCR amplification product of ERα-1 gene;2-4,PCR amplification products of ERα-3 gene;5-7,PCR amplification products of ERα-3 gene图1 策勒黑羊ERα基因PCR扩增产物检测Fig.1 Detection of PCR amplification products of ERα gene in Cele Black sheep

图2 ERα氨基酸序列功能划分Fig.2 Function division of ERα amino acid sequences

图3 ERα氨基酸相似性比对Fig.3 Amino acid similarity alignment of ERα protein
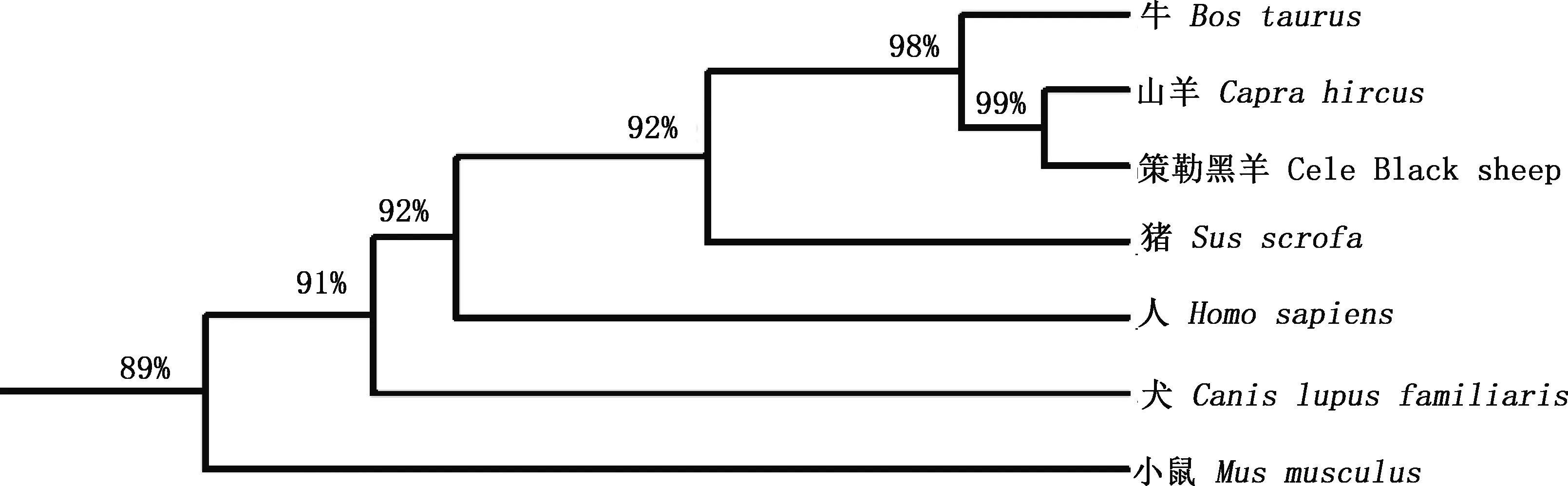
图4 不同物种ERα系统进化树构建Fig.4 Phylogenetic tree construction of ERαin different species
2.3 生物信息学分析
2.3.1 理化性质及亲/疏水性 利用ExPASy软件预测策勒黑羊ERα蛋白的理化性质及亲/疏水性,结果显示,策勒黑羊ERα蛋白分子式为C2930H4600N822O862S41,理论等电点(pI)为7.32,存在60个带负电荷的氨基酸残基(天冬氨酸+谷氨酸)和60个带正电荷的氨基酸残基(精氨酸+赖氨酸),不稳定指数为50.33,属于不稳定蛋白;ERα氨基酸序列第271位谷氨酰胺(Gln)亲水性指数最小,为-3.433,位于389位的蛋氨酸(Met)亲水性指数最大,为2.511,亲水性总平均值为-0.355,表明该多肽属于亲水蛋白(图5)。
2.3.2 糖基化位点和磷酸化位点 使用NetOGlyc 4.0预测策勒黑羊ERα蛋白的O-糖基化位点,结果显示存在28个O-糖基化位点;利用NetNGlyc 1.0预测N-糖基化位点,结果显示不存在N-糖基化位点;利用NetPhos 3.1预测磷酸化位点,结果显示存在54个磷酸化位点(图6)。
2.3.3 亚细胞定位 利用PSORTⅡ预测ERα蛋白在细胞中的定位发现,ERα主要定位于细胞核中,占比为73.9%;线粒体中占8.7%,细胞质、内质网、囊泡和质膜中各占4.3%。
2.3.4 二级结构和三级结构 通过SOPMA软件预测策勒黑羊ERα蛋白二级结构,主要由α-螺旋和无规则卷曲组成,分别为39.43%和43.79%,其余结构为延伸链和β-转角,分别为11.41%和5.37%(图7)。利用SWISS-MODEL在线软件预测策勒黑羊ERα蛋白三级结构,仍以α-螺旋和无规则卷曲为主(图8)。
2.4 策勒黑羊卵泡期、黄体期及妊娠30 d时卵巢中ERα基因表达水平
以β-actin为内参基因,通过实时荧光定量PCR检测ERα基因在策勒黑羊卵泡期、黄体期和妊娠30 d卵巢中的表达情况,结果见图9。由图9可知,与卵泡期相比,ERα基因在黄体期表达量极显著下降(P<0.01),妊娠30 d时卵巢中的表达量极显著上升(P<0.01)。
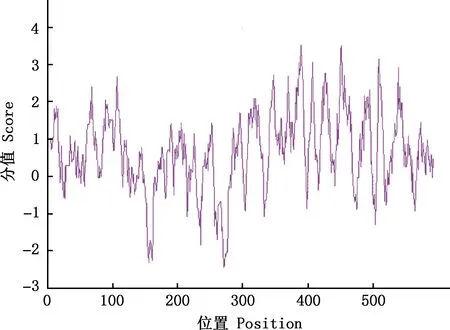
图5 策勒黑羊ERα蛋白质亲/疏水性预测Fig.5 Hydrophilicity and hydrophobicity prediction of ERα protein in Cele Black sheep

图6 策勒黑羊ERα蛋白磷酸化位点预测Fig.6 Phosphorylation sites prediction of ERα protein in Cele Black sheep
线条从长到短依次为α-螺旋、延伸链、β-转角及无规则卷曲The order of lines from long to short are alpha helix,extended chain,beta turn and random coil图7 策勒黑羊ERα蛋白二级结构预测Fig.7 Secondary structure prediction of ERα protein in Cele Black sheep

图8 策勒黑羊ERα蛋白三级结构预测Fig.8 Tertiary structure prediction of ERα protein in Cele Black sheep
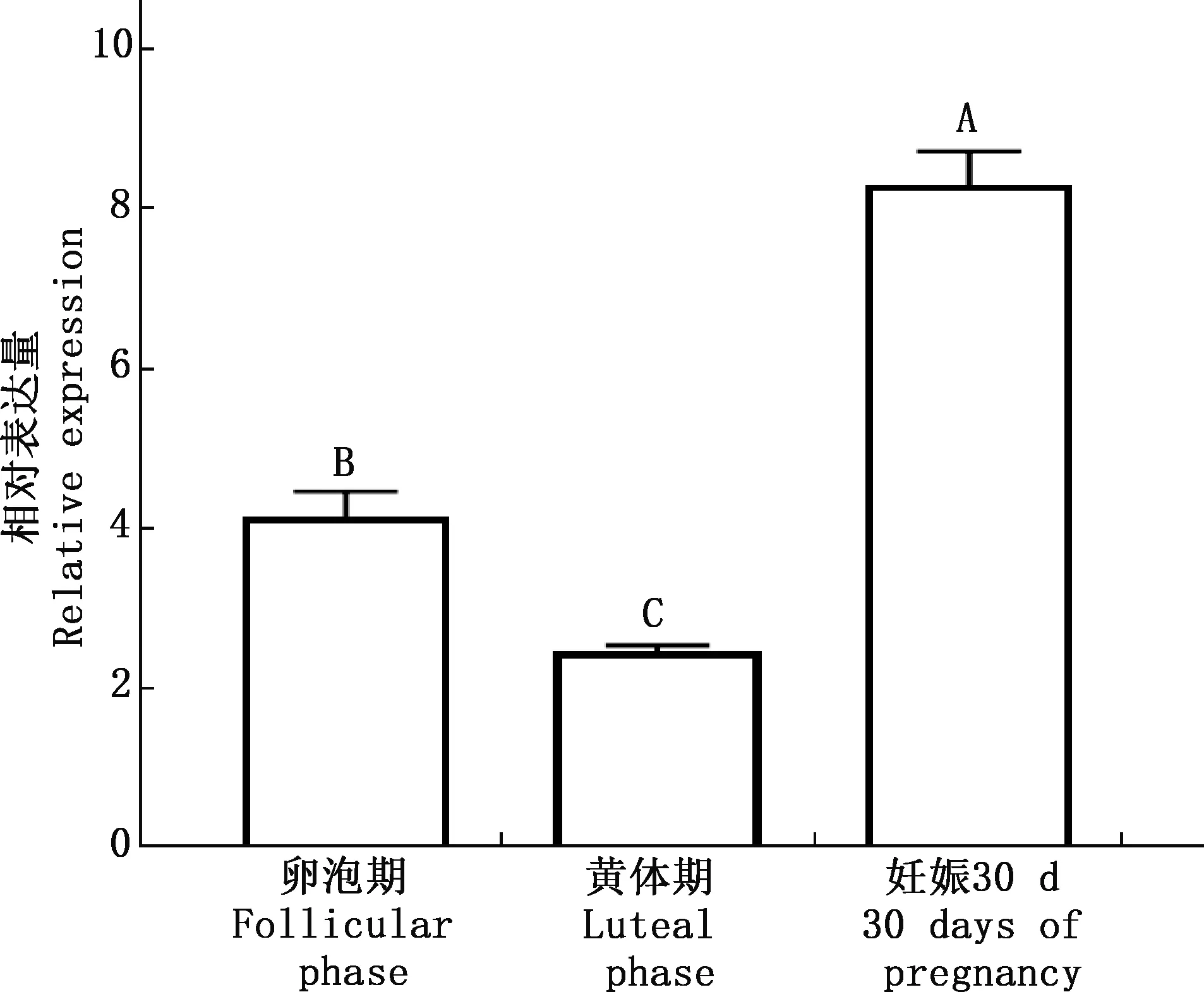
肩标不同大写字母表示差异极显著(P<0.01);肩标相同字母表示差异不显著(P>0.05)Values with different capital letter superscripts mean extremely significant difference (P<0.01);While with the same letter superscripts mean no significant difference (P>0.05)图9 策勒黑羊卵泡期、黄体期及妊娠30 d卵巢中ERα基因表达量Fig.9 Expression of ERα gene in ovary of Cele Black sheep at follicular phase,luteal phase and 30 days of pregnancy
3 讨 论
本研究克隆获得策勒黑羊ERα基因CDS序列,全长1 791 bp,编码596个氨基酸。策勒黑羊ERα氨基酸序列与山羊、牛的相似性较高,分别为99.0%和97.8%,与小鼠的相似性为89.1%,表明该基因在进化上有较高的保守性。ERα定位在细胞内,且细胞核中占比最多,属于核受体家族成员,为亲水蛋白,不存在跨膜结构,这与其属于核受体家族成员相符合。ERα蛋白具有54个磷酸化位点,可能成为蛋白激酶和磷酸酶的修饰位点,在细胞调节通路过程中发挥着重要作用。
目前已证明ERα可分为6个功能区:A/B、C、D、E、F区域[15]。A/B域包含1个非配体依赖型转录激活功能区AF-1区,能与相关转录因子相互作用激活靶基因[16];C域包含有2个锌指结构,并富含高度保守的碱性氨基酸残基,主要参与DNA的结合[17];D区域为绞链区,在无雌激素的条件下,该区可结合1个热应激蛋白并进行适当的折叠以保护疏水的配体结合区,从而维持受体的非活性状态[18],这一不保守的无规则区域在A/B和C域具有分子变构的作用,能够对生物环境的变化做出反应;E区域含有1个在激素依赖的转录过程中有重要作用的AF-2区,在转录激活中起调节作用[19];F区域为碳端结合域。雌激素受体是所有性类固醇激素受体中唯一存在该区域的受体,目前对这一区域功能了解甚少。
本研究结果表明,ERα基因在策勒黑羊不同时期卵巢组织中均有表达,表明其在生殖系统中发挥作用。雌激素主要来源于卵泡内膜细胞和卵巢颗粒细胞,与ERα结合后可以与神经和内分泌系统调节动物的排卵周期。雌激素在卵巢卵泡发育的过程中逐渐积累,卵泡期时呈现逐渐上升的趋势,在排卵之前达到最高峰,排卵后急剧降低。Juengel等[20]在绵羊卵巢颗粒细胞中发现ERα基因有表达,且三级卵泡和成熟卵泡中表达量偏高。如果排出的卵子未受精,黄体维持一段时间后在前列腺素(PGF2α)作用下退化。处于卵泡期的策勒黑羊卵巢受到外周血液中高水平雌激素的影响,ERα基因表达量极显著高于黄体期。包莹莹等[21]在甘加藏羊(绵羊)卵巢中发现,发情期和发情前期ERα基因相对表达量高于发情后期和间情期,且间情期其蛋白表达量相对较低。如果排出的卵子已受精,PGF2α则会受到抑制,维持黄体功能并成为妊娠黄体。妊娠后卵泡不再发育,雌激素的分泌量减少,但黄体和胎盘可以分泌雌激素,所以仍可以检测到雌激素。在绵羊妊娠14~33 d时,黄体细胞经过未成熟和成熟2个阶段。18~28 d时成熟黄体期细胞数量增多、体积变大,未成熟黄体细胞较少,这2种细胞占据全部黄体细胞的83%[22],在妊娠90 d左右时,雌激素含量达到最高。策勒黑羊妊娠30 d时卵巢中ERα基因高表达,暗示其在妊娠过程中发挥着重要作用。Berisha等[23]观察到牛妊娠90 d时卵巢中ERα基因表达量较少,推测可能是不同物种不同妊娠时间存在差异。ERα基因在策勒黑羊卵巢卵泡期、黄体期和妊娠30 d时均有表达且有显著变化,表明ERα基因在卵泡生长、黄体形成和妊娠的调节中起着重要作用,但其具体机制仍有待进一步研究。
4 结 论
本研究克隆获得策勒黑羊ERα基因序列,全长1 791 bp,编码596个氨基酸,与山羊和牛的相似性较高。ERα为亲水蛋白,定位在细胞内,不存在跨膜结构,二级结构以α-螺旋和无规卷曲为主。ERα基因在策勒黑羊卵泡期、黄体期和妊娠30 d的卵巢中均有表达,卵泡期和妊娠30 d时高表达,黄体期时表达量最低,表明ERα基因在策勒黑羊生殖过程中发挥重要作用。
