P[1]型A群牛轮状病毒VP8重组蛋白的表达与免疫原性研究
2022-05-31姜晓明
姜晓明,汤 承,岳 华
(西南民族大学畜牧兽医学院,成都 610041)
A群牛轮状病毒(Bovine rotavirus A,BRVA)是导致新生犊牛腹泻的重要病原[1-2]。病牛主要表现为精神沉郁、食欲减退及水样腹泻等症状,新生犊牛感染BRVA后发病率为60%~80%,死亡率高达30%[3]。BRVA呈世界范围内流行,给养牛业带来巨大的经济损失[4]。目前尚未研制出治疗BRVA感染的特效药物,疫苗是防控传染病最经济有效的手段,目前仅有美国研制的G6型单价BRVA减毒活苗用于临床[5],也有牛轮状病毒(BRV) DNA疫苗、病毒样颗粒疫苗、植物可食用疫苗[6-8]的研究报告,中国尚无商用BRVA疫苗。
VP4蛋白是BRVA的外衣壳刺突蛋白,能诱导机体产生中和抗体,是BRVA的重要保护性抗原之一[9],但VP4蛋白较大,完整表达存在困难且溶解性差[10]。 VP4蛋白在胰蛋白酶的作用下裂解为VP8和VP5亚基[11],VP8亚基上有4个中和表位[12-13]和5个线性B细胞表位,携带VP4的主要抗原表位,与VP4蛋白一样能刺激机体产生中和抗体且免疫应答强度相当[14-16],可见VP8亚基是制备BRVA亚单位疫苗的潜在靶点。本研究利用原核表达系统表达P[1]型BRVA VP8蛋白,并免疫兔评价其免疫原性,以期为研发BRVA亚单位疫苗奠定基础。
1 材料与方法
1.1 菌种、血清及试验动物
大肠杆菌TOP10和BL21(DE3)感受态细胞、pET-30a(+)载体均购自天根生化科技(北京)有限公司;兔抗G6P[1]型BRVA血清、G6P[1]型BRVA病毒液(TCID50:105.76)、G8P[1]型BRVA病毒液(TCID50∶105.39)均由西南民族大学动物医学实验室制备保存。1.8~2.2 kg成年雄性新西兰大白兔购自成都达硕实验动物有限公司。
1.2 主要试剂及仪器
辣根过氧化物酶(HRP)标记的羊抗兔IgG购自Abbkine公司;TMB、Ultra- Signal超敏ECL化学发光底物均购自四正柏(北京)生物科技有限公司;HisCap 6FF镍离子纯化柱购自常州天地人和生物科技有限公司;Imidazole购自BioFroxx公司;BCA蛋白浓度测定试剂盒购自Boster(武汉)公司;DL5000 DNA Marker和PageRuler预染蛋白Marker均购自Thermo Fisher Scientific公司;IPTG购自Sigma公司。
电泳仪和凝胶成像系统均购自天能(上海)科技有限公司;MONTANIDE ISA 201 VG 购自赛比科(上海)特殊化学品有限公司;凝胶半干转印装置Trars-Blot SD和多功能免染蛋白印迹系统均购自Bio-Rad公司。
1.3 P[1]型BRVA VP8基因表达载体构建
参照国内流行毒株RVA/Cow-tc/CHN/SDA2/2018/G6P[1](GenBank登录号:MN937517)VP8基因序列进行优化,在不改变任何氨基酸情况下,使其密码子偏好性接近大肠杆菌。在其5′-端增加酶切位点NdeⅠ,3′-端增加酶切位点XhoⅠ,N-端添加His标签,将序列送至生工生物工程(上海)股份有限公司合成,将合成的序列与经过NdeⅠ和XhoⅠ双酶切的pET-30a(+)载体连接,转化大肠杆菌TOP10感受态细胞,挑取单克隆菌落,经PCR鉴定正确的阳性克隆送至生工生物工程(上海)股份有限公司测序。
1.4 P[1]型BRVA VP8重组蛋白的诱导表达
参考王珍贤等[17]方法将重组质粒pET30a-VP8转化大肠杆菌BL21(DE3) 感受态细胞,涂布于含有30 μg/mL卡那霉素的LB平板,37 ℃培养过夜,挑取单克隆菌落,震荡培养10 h后,挑取转化后单菌落于含30 μg/mL卡那霉素的LB液体培养基中,37 ℃、220 r/min培养,当D450 nm值达到0.6时,将菌液分2组,分别添加0.5 mmol/L IPTG诱导表达,一组20 ℃诱导过夜,另一组37 ℃诱导6 h。诱导后离心收集菌体,以PBS 1∶100(W/V)重悬,超声破碎15 min后离心收集上清与沉淀,进行SDS-PAGE,使用多功能免染蛋白印迹系统拍照,采用Image J软件分析灰度值。
1.5 P[1]型BRVA VP8重组蛋白的纯化
诱导后菌体使用溶解液(50 mmol/L Tris、300 mmol/L NaCl、0.2 mmol/L PMSF)溶解,超声破碎15 min后离心收集上清,按照镍琼脂糖亲和层析蛋白纯化方法以5 mL HisCap 6FF镍离子纯化柱进行纯化,收集到的组份经SDA-PAGE检测。将纯度高的重组蛋白组份使用透析液(50 mmol/L Tris、300 mmol/L NaCl)透析,每隔6 h换一次透析液,共透析4次。透析后的蛋白使用PEG20000包埋浓缩至原蛋白体积的1/2,0.45 μm滤膜过滤,分装至1.5 mL管中,每管1 mL,于-80 ℃冻存。使用BCA蛋白浓度测定试剂盒测定P[1]型BRVA VP8重组蛋白浓度。
1.6 P[1]型BRVA VP8重组蛋白Western blotting鉴定
参考王珍贤等[17]方法对P[1]型BRVA VP8重组蛋白进行SDS-PAGE,然后将P[1]型BRVA VP8重组蛋白转移至硝酸纤维素膜,5%脱脂奶粉封闭过夜,加入1∶ 1 000 稀释的兔抗G6P[1]型BRVA阳性血清,37 ℃摇床孵育2 h,TBST洗涤3次,加入1∶ 5 000稀释的HRP标记的羊抗兔IgG作为二抗,37 ℃摇床孵育2 h,TBST洗涤3次,加ECL显色,多功能免染蛋白印迹系统拍照。 鉴定P[1]型BRVA VP8重组蛋白反应原性。
1.7 动物分组与免疫
4只成年健康兔分为2组,每组2只。将P[1]型BRVA VP8重组蛋白稀释为1 mg/mL,与201佐剂按1∶1(V/V)比例混合,试验组每只兔颈背部皮下注射0.5 mg重组蛋白,首免第2周加强免疫1次,共免疫2次;对照组注射等体积的PBS。首免前0周和第1次免疫免后第1~5周对试验兔耳缘静脉采血并分离血清,用于抗体测定。
1.8 间接ELISA方法检测兔血清抗体的消长
使用1 μg/mL P[1]型BRVA VP8重组蛋白包被96孔酶标板100 μL/孔,4 ℃包被过夜,用4% PEG6000于37 ℃封闭1 h,加入1∶64 000稀释的待检血清,同时设立阴性孔(未免疫兔血清)与空白对照孔(1% BSA),37 ℃孵育1 h。加入HRP标记的羊抗兔IgG(1∶20 000稀释),37 ℃孵育1 h。TMB 37 ℃显色15 min,2 mol/L浓硫酸终止反应,酶标仪测定D450 nm值。以≥Cut Off值(阴性孔D450 nm值×2.1)为阳性,反之为阴性。计算免疫前后各阶段每组兔血清抗体D450 nm平均值。
1.9 兔血清中和效价的测定
利用ELISA方法检测抗体水平最高的兔血清,56 ℃水浴30 min后进行病毒血清中和试验,分别测定兔血清对G6P[1]与G8P[1]毒株的中和效价。用DMEM营养液将待检血清分别稀释100和10倍,再用DMEM营养液在96孔板中倍比稀释(21、22、23、……、210),每个稀释度设立4个对照孔,同时设立阳性对照孔(100 μL病毒液加100 μL维持液)与阴性对照孔(200 μL维持液)。其余试验步骤按照病毒中和试验固定病毒稀释血清法进行,每天观察细胞病变(CPE)孔数至第4天,计算兔血清中和效价。 Reed-Muench氏血清中和效价计算公式如下:
距离比例=(50%-低于50%的病变率)/(高于50%的病变率-低于50%的病变率)
中和效价的反对数=低于50%的病变率的血清稀释度的对数+距离比例×稀释系数的对数
2 结 果
2.1 P[1]型BRVA VP8基因表达系统的构建与鉴定
重组质粒双酶切鉴定结果显示,在约500与5 000 bp 出现2个条带(图1),大小与预期一致,测序结果显示目的基因序列正确插入pET-30a(+)。
2.2 P[1]型BRVA VP8重组蛋白表达情况
重组菌经IPTG诱导表达的产物经SDS-PAGE检测,在约20 ku处有特异性条带,重组蛋白为可溶性表达,且重组菌在37 ℃诱导6 h比20 ℃诱导过夜表达量更高(图2),经Image J软件分析37 ℃诱导6 h条件下目的蛋白占总蛋白的62.08%(表1)。

图1 重组表达质粒pET30a-VP8双酶切电泳图Fig.1 Double enzyme digestion electrophoresis of recombinant expression plasmid
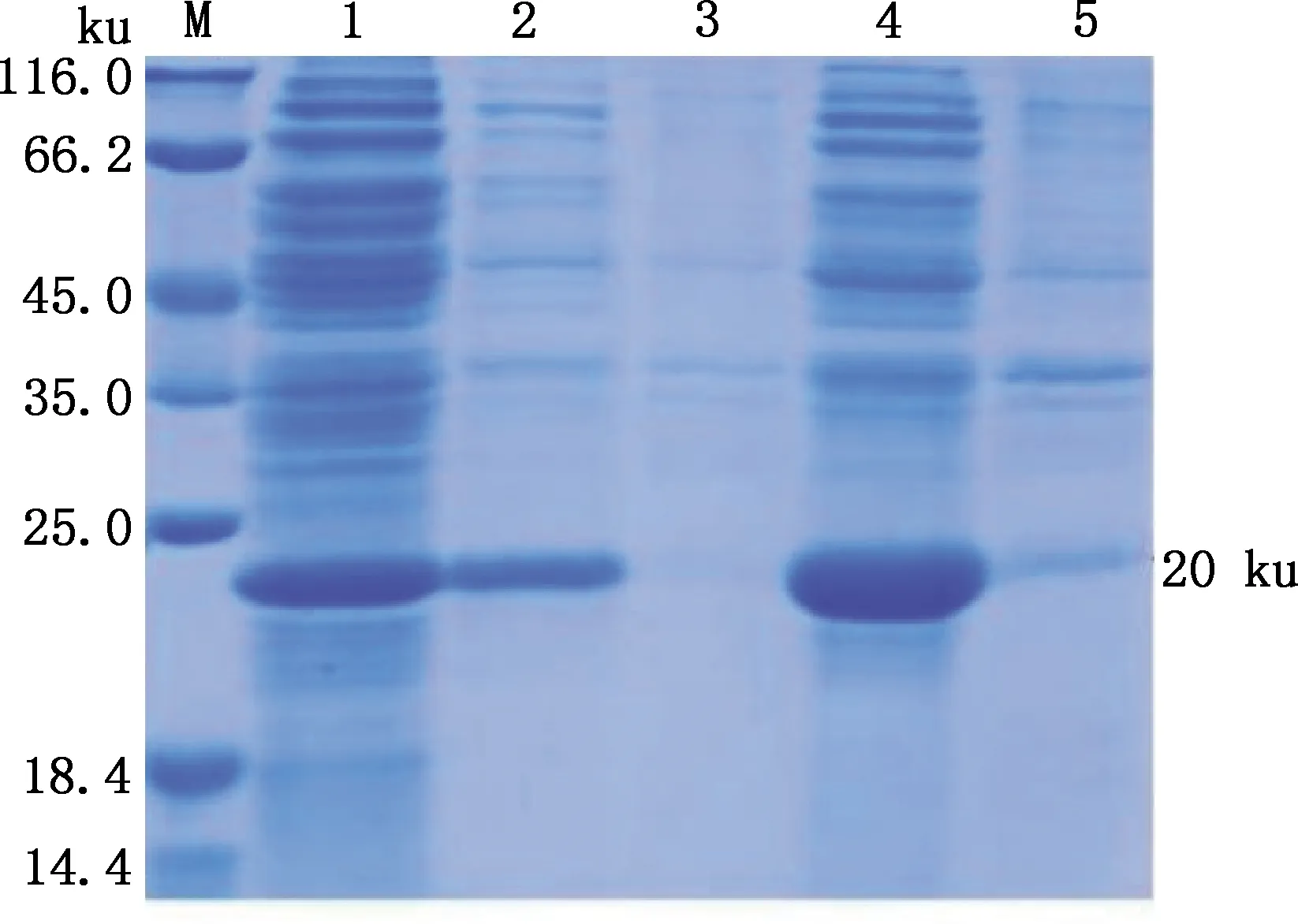
M,蛋白质分子质量标准;1,IPTG诱导前总蛋白;2,20 ℃上清;3,20 ℃沉淀;4,37 ℃上清;5,37 ℃沉淀M,Protein Marker;1,Total protein before IPTG induction;2,Supernatant at 20 ℃;3,Precipitation at 20 ℃;4,Supernatant at 37 ℃;5,Precipitation at 37 ℃图2 重组蛋白表达分析Fig.2 Expression analysis of recombinant protein
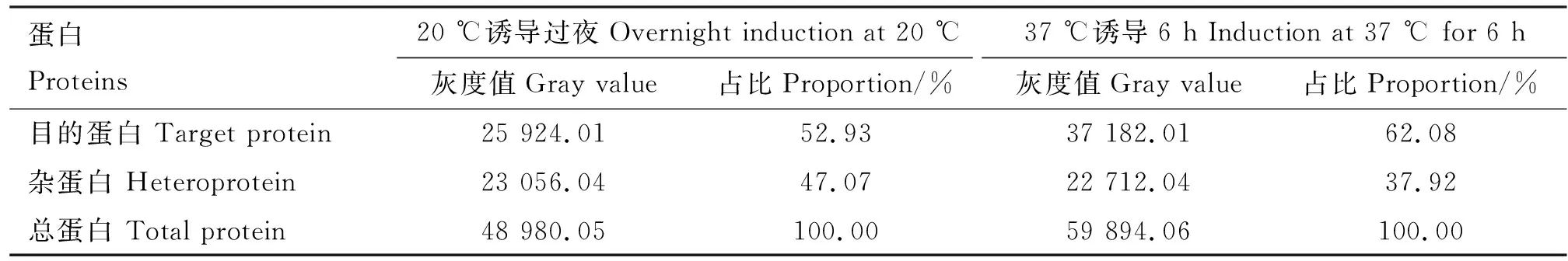
表1 不同温度蛋白表达情况
2.3 P[1]型BRVA VP8重组蛋白的纯化与浓度
纯化的P[1]型BRVA VP8重组蛋白经SDS-PAGE显示呈单一电泳条带,大小为20 ku,蛋白纯度>99%(图3)。BCA试剂盒测定蛋白浓度为2.74 mg/mL,每升菌液可得到10.96 mg纯化重组蛋白。

图3 纯化的P[1]型BRVA VP8重组蛋白SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified P[1] BRVA VP8 recombinant protein
2.4 P[1]型BRV VP8重组蛋白反应原性检测
Western blotting 结果显示,重组蛋白能与兔抗G6P[1]型BRVA血清抗体结合,在约20 ku处可见特异反应条带(图4),证实P[1]型BRVA VP8重组蛋白具有反应原性。
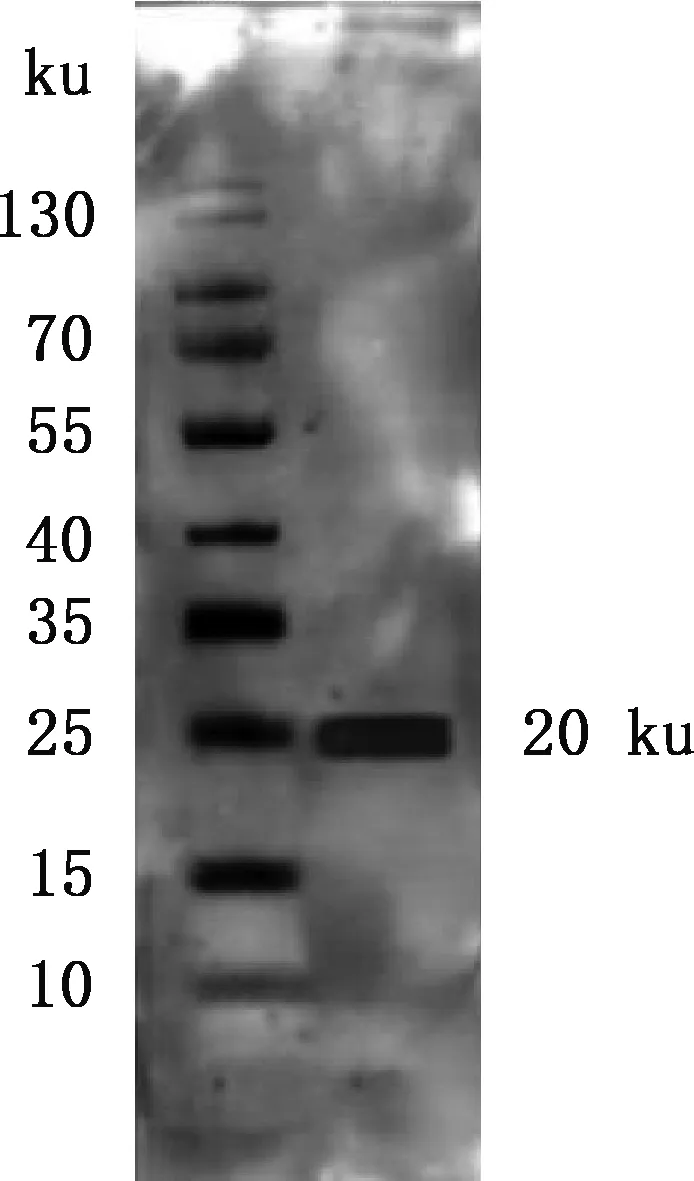
图4 P[1]型BRVA VP8重组蛋白 Western blotting 检测Fig.4 Western blotting detection of P[1] BRVA VP8 recombinant protein
2.5 兔血清抗体的消长情况
免疫后不同时间试验兔血清抗体水平检测结果显示,首免1周后抗体开始出现并迅速上升,于第3周达到高峰,至第5周仍维持在较高水平(图5)。
2.6 P[1]型BRVA VP8重组蛋白诱导兔产生中和抗体
P[1]型BRVA VP8重组蛋白免疫兔血清对同源和异源BRVA的中和试验结果见表2、3。采用Reed-Muench氏法计算免疫兔血清对G6P[1]型和G8P[1]型BRVA的中和效价分别为1∶17 783和1∶64。说明P[1]型BRVA VP8重组蛋白对同源毒株具有良好的中和活性,对异源毒株具有部分交叉中和活性。

图5 免疫兔血清抗体消长曲线Fig.5 Fluctuation curve of serum antibody in immunized rabbits

表2 血清对G6P[1]型BRVA毒株中和试验结果
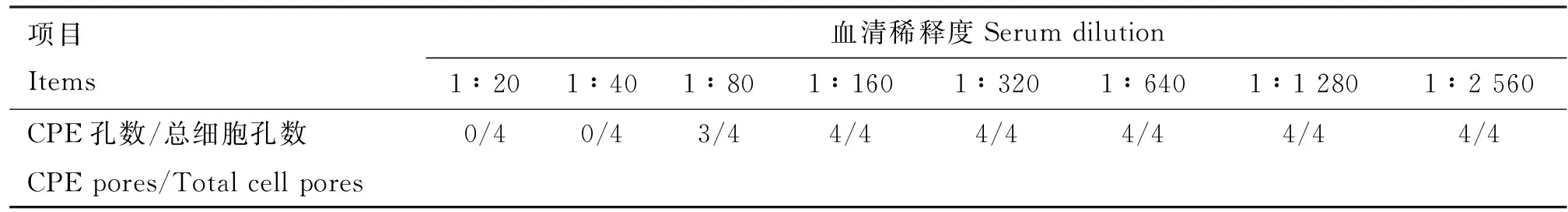
表3 血清对G8P[1]型BRVA毒株中和试验结果
3 讨 论
BRVA呈世界范围内流行,该病原导致的高发病率对养牛业造成严重的经济损失,目前尚无特效药物可用于治疗BRVA引起的疾病,疫苗是预防和控制BRVA最有效的策略。VP4蛋白为BRVA结构蛋白,决定病毒的P型,且可诱导中和抗体的产生[18]。但BRVAVP4基因较长(全长2 359 bp),完整表达存在困难[19]。VP4在胰蛋白酶作用下可裂解成VP8与VP5亚基,Dunn等[15]通过真核表达轮状病毒(RV) VP4、VP8、VP5蛋白,并将其作为免疫原分别免疫小鼠产生的抗体中和效价分别为1∶640至1∶10 240、1∶1 640至1∶10 240、1∶640至1∶2 560,证实VP8重组蛋白与VP4蛋白一样能刺激机体产生中和抗体,且免疫效果相当,具有研发亚单位疫苗的潜力。流行病学调查显示,中国牛群中存在多种基因型BRVA,G6P[1]型是优势流行株[20-21],因此本研究合成了G6P[1]型BRVA毒株VP8基因序列,利用原核表达系统表达P[1]型BRVA VP8重组蛋白。
原核表达系统操作简单、时间短、成本低,且表达量高,是表达外源蛋白的首选方案。但原核表达的蛋白没有经过修饰,不一定具有活性,而BRVA VP4蛋白抗原表位大多为线性,不需要翻译后修饰[22],且Nasiri等[23]、Kim等[24]均证实BRVA VP8原核重组蛋白免疫鸡后可产生抗体。本研究结果显示,VP8重组蛋白可诱导机体产生高水平中和抗体,证实原核表达不影响BRVA VP8蛋白的免疫原性。原核表达系统表达的蛋白主要以包涵体与可溶性2种形式存在,包涵体表达需要复性,复性过程复杂,复性过程中变性剂与去垢剂的使用可能会引起蛋白质的改变,在一定程度影响蛋白的免疫原性[25]。本研究采用可溶性表达策略获得大量P[1]型 BRVA VP8可溶性蛋白,无需复性且易于纯化,为BRVA VP8重组蛋白的生产策略提供了参考。
目前商品化BRVA疫苗仅有美国USDA批准的G6型单价减毒疫苗[26],也有BRVA灭活疫苗、DNA疫苗、亚单位疫苗、转基因植物疫苗等的研究报告,常继涛等[5]制备的BRVA 基因重配二价减毒疫苗免疫牛后可产生高水平的中和抗体,中和抗体效价最高可达1∶20 480。张俭伟等[27]制备BRV CHLY株灭活疫苗免疫昆明小鼠可检出高水平IgG抗体,证实其具有良好的免疫原性。Wei等[28]利用BRVA GSB01株VP7基因原核表达VP7重组蛋白,制备亚单位疫苗免疫小鼠对初生乳鼠保护率达91.7%。BRVA DNA疫苗、植物转基因疫苗等均具有免疫原性[29-31]。亚单位疫苗免疫与其他疫苗相比不仅能诱导免疫动物产生高水平抗体,还具有安全性较高、成本低、操作简单等优势,具有良好的市场潜力,为进一步研发BRVA亚单位疫苗提供参考数据。
4 结 论
本研究以pET-30a(+)为载体,以大肠杆菌BL21(DE3)为表达工程菌成功高效表达了P[1]型BRVA VP8蛋白,该蛋白具有良好的免疫原性和反应原性,为进一步研发BRVA亚单位疫苗提供参考。
