小鼠窦前卵泡二维体外培养法的优化研究
2020-09-02王喜艳潘晓燕孙艳美吴迪史沛德王富
王喜艳,潘晓燕,孙艳美,吴迪,史沛德,王富
吉林医药学院生殖医学研究中心,吉林省吉林市 132013
卵泡的生长发育依次经历原始卵泡、初级卵泡(primary follicles,PM卵泡)、次级卵泡、窦卵泡及成熟卵泡等阶段[1],整个卵泡的发育过程受来自垂体的卵泡刺激素(follicle-stimulating hormone,FSH)和黄体生成素(luteinizing hormone,LH)的调控[2-3]。卵泡的发育过程分为FSH依赖阶段及非FSH依赖阶段[4]。窦卵泡时期是FSH依赖阶段,FSH对窦卵泡的生长发育及类固醇激素合成是必需的[5]。但FSH对窦前卵泡生长发育的作用尚不清楚。Pedersen等[6]和Mandl等[7]将小鼠的窦前卵泡分为原始卵泡、初级卵泡和次级卵泡。Halpin等[8]发现,在FSH缺乏的情况下,直径为150~180 μm的窦前卵泡在体外无法生长,其生长发育要依赖于FSH。Cortvrindt等[9]的研究也发现FSH能促进小鼠95~142 μm的窦前卵泡存活,表明PM卵泡及早期次级卵泡(early second follicles,ES卵泡)均已获得了对FSH的敏感性,但其接受FSH刺激的能力尚不清楚。目前常选择直径为80~180 μm的窦前卵泡进行体外培养,但培养效果不稳定,导致了卵泡不同的体外发育率[10-12]。考虑该直径的卵泡差异较大,包括了PM卵泡和ES卵泡阶段,很可能这两个阶段的卵泡对FSH刺激具有不同的敏感性,因而在FSH刺激下使得卵泡具有不同的体外发育率。因此,进一步研究各级窦前卵泡对FSH的敏感性,确定最佳的FSH添加浓度和选择最佳发育阶段的窦前卵泡进行培养,将会进一步促进窦前卵泡的体外发育。
本研究将直径80~100 μm的PM卵泡和直径110~130 μm的ES卵泡置于不同FSH浓度培养液中培养,观察FSH对卵泡体外生长情况、空间生长模式及分泌功能的影响,以确定小鼠窦前卵泡培养的最佳时期和FSH的最佳添加浓度,优化小鼠窦前卵泡的二维培养体系,提高小鼠窦前卵泡的体外发育率。
1 材料与方法
1.1 实验动物 出生第14天的雌性清洁级ICR小鼠40只,购自吉林大学实验动物中心。小鼠饲养在可控的环境中,室温(22±2) ℃,湿度(50±10)%,维持14 h:10 h的光照:黑暗周期,自由饮食。本实验经吉林医药学院医学研究伦理委员会审核批准,实验过程符合动物实验研究管理规定。
1.2 窦前卵泡体外培养 颈椎脱臼法处死小鼠,迅速取其双侧卵巢置于含10%胎牛血清(FBS)的L-15工作液(美国Gibco公司,11415064)中。在体视镜下,分离去除卵巢周围的组织,机械分离出卵泡。根据Pedersen等[6]的卵泡分级标准,选取直径80~100 μm、含有1~2层颗粒细胞的PM卵泡和直径110~130 μm、含有3层颗粒细胞的ES卵泡,分别置于含有10 mU/ml或100 mU/ml重组FSH(r-FSH)、5% FBS、1%胰岛素-转铁蛋白-硒(insulin-transferrinselenium,ITS)的α-MEM培养液中,置于37 ℃、5% CO2培养箱中连续培养10 d。隔天半定量换液,同时观察记录各组卵泡生长情况。第10天置入含有2.5 U/ml人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)的α-MEM培养液中培养16 h。用拉长的细玻璃吸管去除卵丘卵母细胞复合体(cumulus-oocytes complexes,COCs)周围的颗粒细胞,观察第一极体的排出情况,具有第一极体的卵母细胞为成熟卵母细胞。
1.3 ELISA法检测培养液中雌二醇(estradiol,E2)水平 于第4、8、10天的下午3点收集卵泡培养液,-20 ℃保存。每组每次培养40个卵泡,收集各组的卵泡培养液4次,采用ELISA试剂盒(中国博奥森,bsk00483)检测培养液中的E2水平。
1.4 Western blotting检测卵泡中FSH受体(FSHR)、类固醇激素合成限速酶3β-羟基类固醇脱氢酶(3b-HSD)、17α-羟化酶(CYP17)及芳香化酶(CYP19)的表达水平 获取培养第8天和第10天的卵泡各80个,利用RIPA强裂解液(含1% PMSF)提取蛋白。制胶,上样,120 V恒压电泳约80 min,然后300 mA湿转膜60 min,再用5%脱脂奶粉封闭1 h,最后以兔源FSH受体抗体、3b-HSD抗体、CYP17抗体、CYP19抗体或GAPDH抗体孵育,4 ℃过夜。以GAPDH作为内参。次日以辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔二抗(以上抗体均购自中国博奥森公司)室温孵育1 h。最后,将转有蛋白的PVDF膜放入Tanon 4600成像系统,覆上增强显影液200 μl,用Tanon Imaging System软件进行摄片。每个实验组重复3次后用Tanon GIS ID软件分析图片的灰度值。
1.5 统计学处理 采用SPSS 17.0软件进行统计分析。所有数据以表示,卵泡的贴壁面积分析及卵泡中FSHR表达水平比较采用t检验,其他数据的比较采用方差分析,进一步组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 FSH对窦前卵泡体外生长发育的影响 体外分离出的PM卵泡及ES卵泡见图1。大部分卵泡于第2天开始贴壁生长;第4天各组卵泡的颗粒细胞增殖突破基膜,ES卵泡更为明显;第6天ES卵泡颗粒细胞继续增殖向周围膨出,而PM卵泡的颗粒细胞未向周围膨出;第8天大部分ES卵泡开始出现卵泡腔,而仅有极少数培养在100 mU/ml r-FSH中的PM卵泡出现卵泡腔;第10天卵泡腔继续增大,窦卵泡接近成熟(图2)。
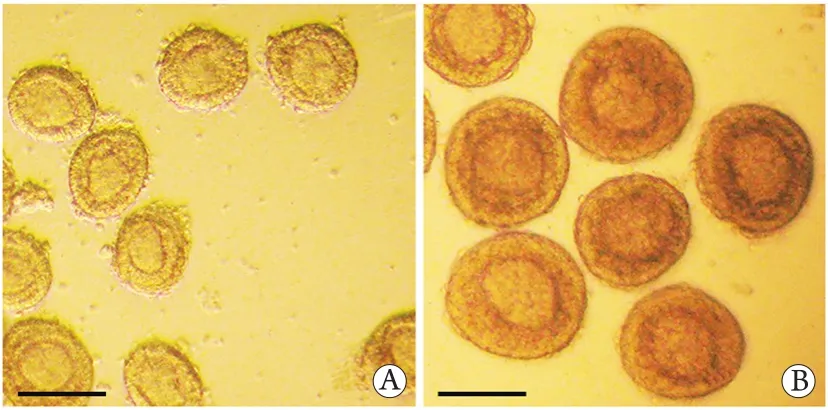
图1 体外分离出的初级卵泡(A)和早期次级卵泡(B)(倒置显微镜,标尺=100 μm)Fig.1 The in vitro isolated PM follicles (A) and ES follicles(B) (Inverted microscope, bar=100 μm)

图2 初级卵泡和次级卵泡体外生长情况(倒置显微镜,标尺=100 μm)Fig.2 The in vitro development of PM follicles and ES follicles (Inverted microscope, bar=100 μm)
PM卵泡在100 mU/ml r-FSH培养液中的存活率高于在10 mU/ml r-FSH中的存活率,ES卵泡在10、100 mU/ml r-FSH中的存活率均高于PM卵泡在10、100 mU/ml r-FSH中的存活率,差异均有统计学意义(P<0.05);ES卵泡在10 mU/ml r-FSH与在100 mU/ml r-FSH中的存活率无明显差异。PM卵泡培养在10 mU/ml r-FSH培养液中不能形成窦卵泡,而在100 mU/ml r-FSH培养液中36.14%的PM卵泡形成窦卵泡。ES卵泡在10、100 mU/ml r-FSH培养液中均可形成窦卵泡,且在100 mU/ml r-FSH中的成腔率明显高于在10 mU/ml r-FSH中的成腔率,差异有统计学意义(P<0.05,表1)。
表1 PM、ES卵泡在不同FSH浓度下的体外发育及成熟情况比较(±s,n=8)Tab.1 Development and maturity of PM and ES follicles in vitro (±s, n=8)
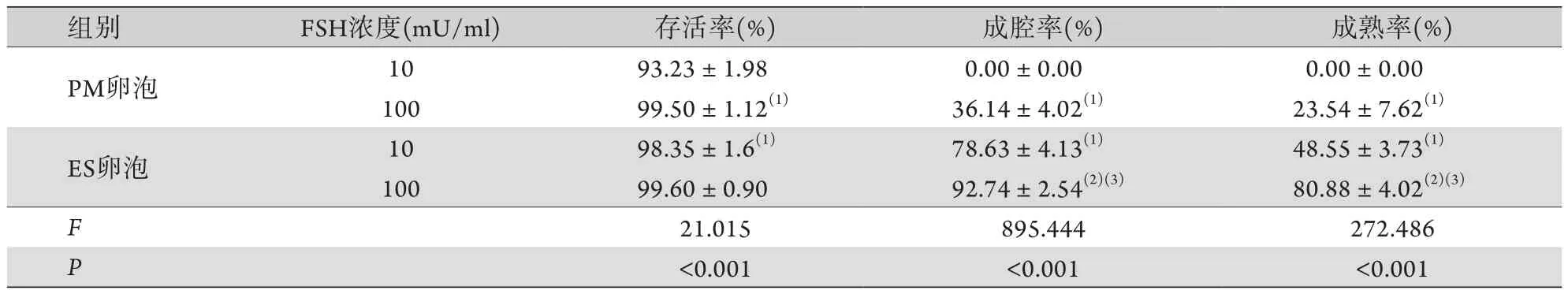
表1 PM、ES卵泡在不同FSH浓度下的体外发育及成熟情况比较(±s,n=8)Tab.1 Development and maturity of PM and ES follicles in vitro (±s, n=8)
与PM卵泡10 mU/ml FSH组比较,(1)P<0.05;与PM卵泡100 mU/ml FSH组比较,(2)P<0.05;与ES卵泡10 mU/ml FSH组比较,(3)P<0.05。
组别 FSH浓度(mU/ml) 存活率(%) 成腔率(%) 成熟率(%)PM卵泡 10 93.23±1.98 0.00±0.00 0.00±0.00 100 99.50±1.12(1) 36.14±4.02(1) 23.54±7.62(1)ES卵泡 10 98.35±1.6(1) 78.63±4.13(1) 48.55±3.73(1)100 99.60±0.90 92.74±2.54(2)(3) 80.88±4.02(2)(3)F 21.015 895.444 272.486 P<0.001 <0.001 <0.001
2.2 FSH对窦前卵泡发育成熟的影响 卵泡发育成熟后,排出具有第一极体的成熟M2期卵母细胞(图3)。PM卵泡培养在含10 mU/ml r-FSH的培养液中,由于未形成窦卵泡,故无成熟的卵母细胞;在含100 mU/ml r-FSH的培养液中,PM卵泡的成熟率明显低于ES卵泡,表明ES卵泡期为窦前卵泡体外培养的最佳时期。ES卵泡在含100 mU/ml r-FSH培养液中的卵母细胞成熟率明显高于在10 mU/ml r-FSH培养液中的成熟率,差异有统计学意义(P<0.05,表1)。
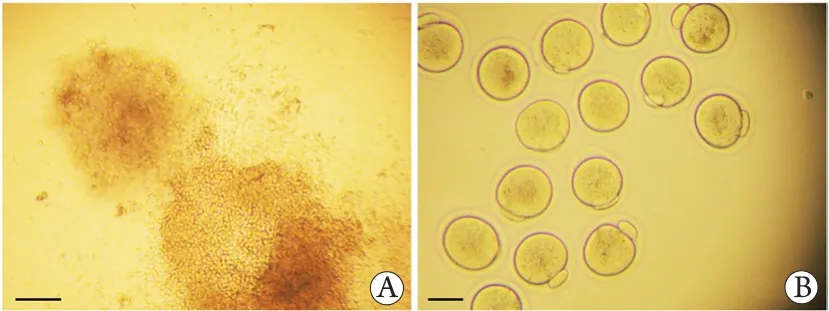
图3 排出的卵丘卵母细胞复合体(A)及成熟的卵母细胞(B)(倒置显微镜,标尺=50 μm)Fig.3 The expelled COCs (A) and matured oocytes (B)(Inverted microscope, bar=50 μm)
2.3 FSH对卵泡体外空间生长方式的影响 大部分PM卵泡在体外生长到第6天后不再继续生长。ES卵泡在10、100 mU/ml r-FSH培养液中呈现两种不同的生长方式:在10 mU/ml r-FSH培养液中生长的ES卵泡,在培养皿底部呈平铺式生长;而在100 mU/ml r-FSH培养液中生长的ES卵泡颜色较暗,呈立体三维空间生长方式,更接近于体内卵泡的生长模式(图4)。ES卵泡在10 mU/ml r-FSH培养液中形成的窦卵泡贴壁面积为(35 861±325) μm2,明显大于在100 mU/ml r-FSH培养液中形成的窦卵泡的贴壁面积[(23 083±291) μm2],差异有统计学意义(t=19.83,P<0.05)。在100 mU/ml r-FSH培养液中生长的ES卵泡更能模拟体内卵泡的生长。
2.4 FSH对卵泡分泌E2水平的影响 ES卵泡组卵泡在第4、8、10天的E2水平明显高于PM卵泡组;PM卵泡在10、100 mU/ml r-FSH培养液中的E2分泌水平差异无统计学意义(P>0.05);ES卵泡在100 mU/ml r-FSH培养液中的E2分泌水平明显高于10 mU/ml r-FSH培养液(表2)。
2.5 窦前卵泡中FSHR的表达 FSHR在PM卵泡和ES卵泡中均有表达,ES卵泡中FSHR的相对表达水平(1.86±0.32)明显高于PM卵泡(1.19±0.28),差异有统计学意义(t=4.94,P<0.05,图5)。
2.6 FSH对卵泡中类固醇激素合成限速酶3b-HSD、CYP17及CYP19表达的影响 培养第8天和第10天,在10、100 mU/ml r-FSH培养液中PM卵泡3b-HSD、CYP17及CYP19的表达差异无统计学意义,而在100 mU/ml r-FSH培养液中的ES卵泡较10 mU/ml r-FSH培养液中的ES卵泡CYP17及CYP19表达明显升高,且在100 mU/ml r-FSH培养液中生长的ES卵泡3b-HSD、CYP19表达水平较PM卵泡明显升高,差异均有统计学意义(图6,表3)。
3 讨 论
目前,小鼠窦前卵泡最常用的体外培养方法是二维液滴法[13-15]。研究者们多采用80~180 μm的窦前卵泡进行体外培养[10-12],培养液中常用的FSH浓度为10或100 mU/ml[11-12,16],在上述条件一致的情况下,卵泡卵母细胞的体外成熟率为60%~70%[13-15],体外成熟效果不稳定,成熟率差异很大(8.00%~80.88%)[14,16-17]。Cortvrindt等[9]选取95~142 μm的卵泡在100 mU/ml r-FSH培养液中进行二维培养,获得了41%的M2期卵母细胞。本研究选取ES卵泡培养在100 mU/ml r-FSH培养液中,获得了80.88%的卵母细胞成熟率。导致卵母细胞成熟率差异很大的原因可能是80~180 μm的窦前卵泡包括了PM、ES这两个阶段的卵泡,这些卵泡的大小和颗粒细胞多少存在差异,对FSH刺激具有不同的敏感性,使在相同浓度FSH的作用下,PM卵泡及ES卵泡具有不同的发育率及成熟率,最终导致小鼠窦前卵泡体外培养的效果不稳定。因此,本研究在培养前对窦前卵泡进行严格选择,选择ES卵泡进行体外培养,获得了高效、稳定的小鼠窦前卵泡。

图4 窦卵泡的生长模式(倒置显微镜,标尺=100 μm)Fig.4 The growth model of antral follicles (Inverted microscope, bar=100 μm)
表2 培养液中的E2含量(ng/L, ±s, n=4)Tab.2 The concentration of E2 in culture media (ng/L, ±s, n=4)

表2 培养液中的E2含量(ng/L, ±s, n=4)Tab.2 The concentration of E2 in culture media (ng/L, ±s, n=4)
与PM卵泡10 mU/ml FSH组比较,(1)P<0.05;与PM卵泡100 mU/ml FSH组比较,(2)P<0.05;与ES卵泡10 mU/ml FSH组比较,(3)P<0.05。
组别 FSH浓度(mU/ml) 第0天 第4天 第8天 第10天PM卵泡 10 0.00±0.00 1.18±0.40 2.45±0.44 3.30±0.34 100 0.00±0.00 2.35±0.59 3.84±1.03 4.62±0.61 ES卵泡 10 0.00±0.00 4.21±0.69(1) 5.29±0.47(1) 8.62±0.62(1)100 0.00±0.00 6.49±1.81(2)(3) 9.97±1.86(2)(3) 14.08±1.75(2)(3)F 14.396 19.095 70.773 P 0.001 0.001 <0.001

图5 窦前卵泡中FSH受体的表达Fig.5 The expression of FSH receptor in preantral follicles

图6 培养第8、10天卵泡中3b-HSD、CYP17及CYP19的表达水平Fig.6 Expressions of 3b-HSD, CYP17 and CYP19 in follicles at day 8 and day 10
表3 培养第8、10天卵泡中3b-HSD、CYP17及CYP19表达水平比较 (±s, n=4)Tab.3 Expressions of the rate-limiting enzymes for steroid hormone synthesis at day 8 and day 10 (±s, n=4)

表3 培养第8、10天卵泡中3b-HSD、CYP17及CYP19表达水平比较 (±s, n=4)Tab.3 Expressions of the rate-limiting enzymes for steroid hormone synthesis at day 8 and day 10 (±s, n=4)
与PM卵泡10 mU/ml FSH组比较,(1)P<0.05;与PM卵泡100 mU/ml FSH组比较,(2)P<0.05;与ES卵泡10 mU/ml FSH组比较,(3)P<0.05。
组别 r-FSH浓度(mU/ml) 第8天 第10天3b-HSD CYP17 CYP19 3b-HSD CYP17 CYP19 PM卵泡 10 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 100 0.00±0.00 0.00±0.00 1.18±0.35 0.00±0.00 0.03±0.00 0.02±0.00 ES 卵泡 10 0.24±0.08(1) 0.24±0.07(1) 1.18±0.35(1) 0.12±0.04(1) 0.22±0.06(1) 0.38±0.09(1)100 0.26±0.01(2) 0.51±0.03(2)(3) 2.23±0.41(2)(3) 0.27±0.07(2)(3) 0.43±0.08(2)(3) 1.29±0.11(2)(3)F 8.247 10.039 23.271 11.875 14.575 18.463 P 0.001 0.001 <0.001 0.001 0.001 0.001
Hardy等[18]发现,直径<110 μm的卵泡在含有10 ng/ml r-FSH以及不含FSH的环境中生长速度无明显差异。Kumar等[19]将FSH基因敲除,发现早期卵泡的生长仍能维持,卵泡可以很好地发育到次级卵泡阶段;Dierich等[20]发现,在FSH受体缺失的情况下,雌性小鼠不能排卵,但卵泡能发育到成腔之前。以上研究表明,小鼠初级卵泡生长可能不依赖于FSH。本研究也发现,在PM卵泡的体外培养过程中添加不同浓度的FSH,大部分PM卵泡培养至第6天生长就会减缓,且不能形成卵泡腔。因此,在窦前卵泡体外培养过程中,如果将PM卵泡也进行培养,会明显降低卵泡的发育率及成熟率。因此,目前的小鼠窦前卵泡二维培养体系不适合PM卵泡的体外培养,其合适的培养体系仍需进一步研究。
卵泡对FSH刺激的应答反应与FSH受体的表达密切相关[12]。Otkay等[21]发现,在含有1层颗粒细胞的初级卵泡上已有FSH受体的表达,本研究也发现在PM卵泡、ES卵泡上均有FSH受体的表达,但ES卵泡的FSH受体表达水平明显高于PM卵泡,ES卵泡对FSH的刺激较为敏感,100 mU/ml r-FSH更能刺激ES卵泡的发育。且在100 mU/ml r-FSH培养液中ES卵泡CYP17及CYP19的表达明显高于10 mU/ml r-FSH培养液中培养时。CYP17及CYP19在卵泡颗粒细胞中可将膜细胞合成的雄烯二酮转变为E2,因此,在100 mU/ml r-FSH培养液中ES卵泡E2的表达明显高于在10 mU/ml r-FSH培养液中培养时。此外,本研究发现,FSH不仅会影响窦前卵泡的体外发育率,还会影响窦前卵泡的体外发育模式。ES卵泡在10 mU/ml r-FSH培养液中呈平铺式生长模式,缺乏立体感,贴壁的底面积较大;而在100 mU/ml r-FSH培养液中则呈立体的空间生长模式,贴壁的底面积较小,与体内卵泡的生长模式非常接近。虽有研究报道了FSH会影响窦前卵泡的发育[22-24],但未见FSH影响窦前卵泡体外生长模式的报道。原因可能是大部分研究均将PM卵泡及ES卵泡一起培养,在发育率不高的情况下未发现发育模式的差异。本研究将次级卵泡与初级卵泡分开培养,从而发现了FSH对卵泡体外生长模式的影响。因此,将ES卵泡培养在100 mU/ml r-FSH培养液中,不仅提高了卵泡的分泌功能及体外发育率,且使卵泡的体外生长模式更接近于体内。
综上所述,目前常用的小鼠窦前卵泡二维培养体系不适合PM卵泡的培养,其合适的培养系统仍需进一步研究。ES卵泡(110~130 μm)在100 mU/ml r-FSH的二维培养环境中可获得较高的体外发育率及成熟率,100 mU/ml r-FSH能明显刺激ES卵泡颗粒细胞快速增殖,使其向立体空间生长,并促使更多的类固醇激素合成限速酶表达,合成、分泌更多的雌激素,最终获得较高的卵母细胞成熟率。因此,将ES卵泡培养在100 mU/ml r-FSH的二维液滴中,是一个理想的、能模拟体内卵泡生长模式的小鼠窦前卵泡二维培养体系。
