牛丙型肝炎病毒研究进展
2022-05-31郭銮英李家磊金芹芹
郭銮英,李家磊,金芹芹,马 骏,刘 全
(1.佛山科学技术学院生命科学与工程学院,佛山 528000;2.中国农业科学院生物技术研究所,北京 100081)
丙型肝炎病毒(Hepacivirus)是一类有囊膜的单股正链RNA病毒,属于黄病毒科(Flaviviridae)成员。2020年,国际病毒分类委员会(International Committee on Taxonomy of Virus,ICTV)将丙型肝炎病毒分为14个不同病毒种。目前为止,除了田鼠可被丙型肝炎病毒F和J型感染外,其他病毒种均存在宿主特异性。A型丙型肝炎病毒感染马[1],B、C型感染猴和人[2],D型感染猴[3],E、F、G、H、I和J型感染啮齿动物[4],K、L和M型感染蝙蝠[5],N型感染牛[6]。
长期以来,丙型肝炎病毒属只有人丙型肝炎病毒(Hepatitis C virus,HCV)1个种。HCV在自然情况下,只感染人和黑猩猩,是导致人类慢性肝炎、肝硬化及肝癌的重要病原体之一[7]。全球约有5 800万人感染慢性HCV,每年约有150万名新感染者,2019年约有29万人死于丙型肝炎[8],目前尚无针对HCV的有效疫苗,由于缺乏合适的动物模型,HCV的致病机理及疫苗的研制受到极大的阻碍,积极治疗及控制病毒感染成了主要防控手段。
近年来随着高通量测序技术的广泛应用,研究者在不同动物物种中发现了丙型肝炎病毒,包括马[9-10]、啮齿动物[11]、蝙蝠[5]和多种非灵长类动物[2]。目前该病毒属已增加至14个病毒种(A~N种),其中最新的病毒种是——N型丙型肝炎病毒(Hepacivirus N,HNV),2015年,德国首次报道在奶牛血清中发现该病毒,因此也称牛丙型肝炎病毒(Bovine hepacivirus,BovHepV),HNV同HCV相似,能造成宿主无明显临床症状的急性和慢性感染[12],因此尽管没有肝损伤迹象,但HNV的感染对畜牧业的发展及与病毒密切接触的农民和育种人员健康均构成潜在威胁。目前HNV的研究及报道内容有限,国内更是缺乏对HNV研究进展的系统整理,笔者就HNV的病原学研究、流行情况及检测方法方面的研究进展进行综述,以期为HNV的病原学发展、发病机制、人畜共患感染潜力的研究提供参考。
1 HNV特征
1.1 HNV的形态结构
HCV呈球形,直径50 nm,有囊膜,病毒核心直径约30 nm[13],详细结构尚不明确。而黄病毒科成员的病毒颗粒形态、基因组结构和复制方式相似[14],加之丙型肝炎病毒属病毒在体外细胞中增殖能力有限,目前尚无HNV分离成功的报道,因此可参照HCV的病毒颗粒形态,寻找HNV的病毒颗粒并观察记录。
1.2 HNV的基因组结构及功能
HNV的基因组结构及功能与黄病毒科病毒成员相似。 HNV为单股正链RNA病毒,长约8.8 kb。HNV基因组包含非编码区5′-UTR、3′-UTR及1个长开放阅读框(ORF)。ORF编码1个含2 779个氨基酸的前体多蛋白,前体多蛋白在信号肽酶和蛋白酶共同作用下,被加工成约10个蛋白,其中包括3种结构蛋白:衣壳蛋白C(Core,C)、囊膜蛋白E1(为糖蛋白)、囊膜蛋白E2(含有能诱导产生中和抗体的抗原表位)。此外,还有7种非结构蛋白p7、NS2、NS3、NS4A、NS4B、NS5A和NS5B[15]。其中,5′-UTR、NS3及NS5B是HNV的高度保守区,NS3作为解旋酶和蛋白酶,还具有部分RNA聚合酶复合物的功能,NS3负责多聚蛋白酶的大部分剪切作用,而宿主蛋白酶参与剩余的剪切作用[13]。
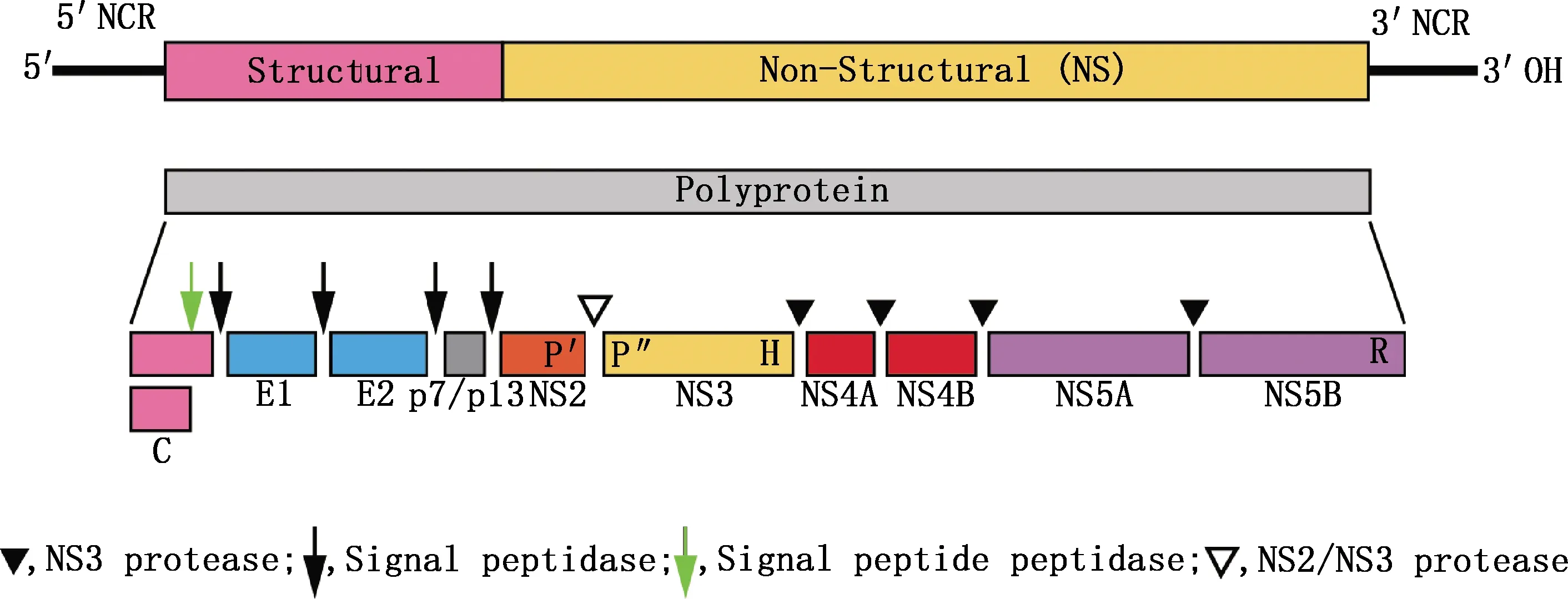
图1 丙型肝炎病毒基因组模式图[14]Fig.1 Hepacivirus genome model map[14]
1.3 HNV的遗传多样性
2019年,Gang等[16]根据HCV的分类原则,将HNV分为1个基因型和7个亚型(A~G亚型),2021年,Shao等[17]将HNV分为2个基因型和8个亚型(图2),其中HNV的A和F亚型主要存在于德国;加纳流行B、C亚型;巴西流行D亚型;中国广东、江苏及四川鉴定发现存在E、G和H亚型[16-19],表明HNV基因型和亚型的地理分布复杂。
整体上,HNV的基因多样性远不如HCV丰富,一方面,可能是因为已有的HNV研究成果是建立在地理隔离较大的牛群上,意味着可能存在更多的HNV有待发现,这与在历史上人们发现不同HCV基因型的过程相似[20];另一方面,可能是人类圈养动物的行为对病毒多样性有一定的影响,如影响了HNV毒株跨地域传播及基因重组。最后,想要更详细地研究HNV的遗传多样性,需要更大的样本量、纵向研究或动物感染试验,对不同牛种的HNV流行情况进行调查也有助于了解病原与病原、病原与生态之间的进化关系。
值得注意的是,近几年随着高通量测序技术的发展,HNV基因亚型的种类不断增加,分布情况也逐步改变。截至2021年中国至少存在HNV的4种亚型[17],这可能是由于中国活牛国际贸易频繁,促进了HNV的跨界传播。此外,目前仅在中国广东、江苏、云南和四川等有限地区的牛中检测到HNV[16,18-19],扩大HNV流行病学调查范围,可更好地揭示中国HNV的遗传多样性和流行病学特征。
1.4 HNV的致病机理
研究表明,持续的HCV感染与原发性肝癌、肝硬化和自身免疫性肝炎有关[21],但非人类灵长类动物、啮齿动物、蝙蝠、牛和马的肝炎病毒的致病机理和特征尚不明确。
有研究发现,两头持续性感染HNV的牛检测不到病毒抗体[22]。已知人或动物慢性感染病毒时,在血清中基本能检测到病毒抗体,但当慢性感染HCV的患者共感染人类免疫缺陷综合征病毒(HIV)时,其CD4+T细胞衰竭引起的免疫抑制会导致检测不到HCV抗体[23-24]。据此推测这2头牛可能是存在机体免疫抑制,另一种推测是HNV可通过垂直传播使幼畜产生特异性免疫耐受。
HNV 5′-UTR中存在1个核糖体进入位点(internal ribosome entry site,IRES),可与宿主因子microRNA-122(miR-122)结合,在不依赖5′-UTR帽子结构的情况下显著增强病毒翻译效率[25-26]。牛肝脏组织中存在大量miR-122,在HNV生命周期中起着关键作用[27],未来的研究集中于miR-122是如何影响病毒复制的过程,或可阐明HNV的致病机理。
2 HNV的流行病学研究
2.1 临床症状
人急性感染HCV常因无明显临床症状而被忽略,感染者不能自行清除病毒则发展为慢性感染,这是导致肝炎和肝癌的主要原因[28]。有证据表明,马感染丙型肝炎病毒时病毒的清除速度比人更快速,因此只会引起较轻微的肝脏炎症,且马的品种和年龄也会影响病毒感染结果[29]。
HNV同大多丙型肝炎病毒相似,有强嗜肝性,可造成牛无明显临床症状的急性和慢性感染[29-31],HNV慢性感染时间可达9个月甚至更久[22]。但感染HNV的牛肝脏生化指标正常,未见肝损伤或病变[32-33],表明肝损伤与肝脏内病毒滴度之间没有相关性。尽管这一发现出人意料,但对于肝病毒感染来说并不少见,如HCV驱动肝损伤的发病机制主要是免疫介导的[34],此外,参考HCV从感染到致病甚至引起肝癌一般需要几十年的时间,目前没有HNV感染引起动物产生临床症状的相关报道可能正是因为HNV的慢性感染尚未发展到临床期其宿主就被宰杀。
2.2 流行情况
HNV在牛群中呈高度流行趋势。自2015年Christine等[12]首次通过高通量测序技术在德国奶牛血清中发现一种新型丙型肝炎病毒HNV后,世界范围内多个研究陆续报道了HNV的在牛群中流行率在0.2%~19.9%[6,12,20,22,33-35]。2015年,研究者在非洲牛群中检测到HNV并对12个养殖场的牛群进行核酸筛查,结果显示,6个牛场具有阳性病例[6]。2017年,Canal等[32]利用贝叶斯系统分析方法证明HNV可能至少在1996年就在巴西流行,比德国的报道要早20年。2019年,中国商业化的血清中检测到HNV核酸[16]。值得一提的是,2021年,有研究者在中国广东的蜱中发现HNV新亚型并获得全基因组[17],提示蜱可能是HNV潜在的传播媒介。
2.3 易感宿主
目前认为牛科动物为HNV的主要宿主,其中以牛为主,有可能感染共同圈养的羊,病毒感染无性别及年龄差异[36]。2020年,强欣[37]首次在云南的羊体内发现HNV,羊是牛科羊亚科的统称,与牛亲缘关系较近,所以牛羊一同饲养造成HNV感染羊的可能性非常大。考虑到其他肝病毒的物种特异性,HNV可能不会感染牛科以外的物种,但动物丙型肝炎病毒的 NS3/4A 蛋白酶可切割动物宿主及人的先天免疫接头——线粒体抗病毒信号蛋白 (mitochondrial antiviral signaling protein,MAVS)来规避宿主的免疫反应,导致干扰素产生减少并有助于丙型肝炎病毒的持续感染[38],在人兽共患病暴露的情况下,人类MAVS可能无法有效抑制这些非人类病毒的复制。
2.4 传播途径
丙型肝炎病毒几乎完全通过血液、血液制品和被血液污染的物体进行传播。Gather等[39]在一项马的研究中,揭示了动物丙型肝炎病毒存在垂直传播的可能。
对于牛而言,受血液污染的注射器是最重要的传播因素。初步怀疑未更换的针头、精液为HNV潜在的感染源,具体的传染源、传播途径及传播机制还需深入研究。德国一项HNV流行病学调查显示,阳性血清宿主(牛)的鼻咽拭子核酸检测为阴性[12],表明该病毒可能不是通过鼻分泌物在动物之间传播的。中国在商品化的血清中检测出HNV核酸[16],揭示HNV可能垂直传播给胎牛。2021年在中国广东蜱中发现HNV新亚型[17],但蜱虫可能只是病毒的传播载体,而不是病毒的自然宿主。
3 HNV的检测诊断
目前,黄病毒科病毒的检测方法已得到发展和推广,可分为基于抗原、抗体的免疫学检测方法和基于核酸序列的分子生物学检测方法两类[40]。免疫学方法包含酶联免疫吸附试验 (ELISA)、间接免疫荧光试验(IFA)、中和抗体试验(VNT)、荧光素酶免疫沉淀反应系统(luciferase immunoprecipitation systems,LIPS)等[25]。分子学方法有直接测序、PCR、特异性探针杂交法等。
HNV的鉴定及检测采用何种方法主要取决于实验室的现有条件及目的。成熟的免疫学方法对试验条件要求不高,对临床而言,免疫学检测方法提供了快速、简便、高效的方法;评估病毒在动物种群中受感染的比率及感染既往史,免疫学(血清学)调查可提供比核酸检测更真实的结果。对于流行病学研究而言,确定病毒基因型、准确定位到病毒亚型的核酸检测方法也是必需的。每种方法都有各自的优点和不足,所有这些方法都能正确辨别病毒基因组别,但只有核苷酸测序能有效区分病毒亚型。传统检测方法结合多组学联合分析可更全面、更系统、更深入地研究新发病毒的生物学特征及其感染宿主后的发病机理,能为病毒的异质性特征分析、新型靶向药物开发和疫苗研发提供更为可靠的理论依据和数据支撑。
3.1 分子生物学诊断
Elia等[31]利用针对5′-UTR基因区的实时荧光定量RT-PCR探针法发现在配对的血清和肝脏样本中病毒载量之间存在正相关现象[34],表明病毒血症水平可能反映了肝脏中的病毒量。
针对新型、未知病毒或变异较活跃的病毒,如丙型肝炎病毒,高通量组学测序技术与传统分子生物方法相比具有显著优势,仅需投入少量核酸即可构建文库得到大量数据,是科学研究中强有力的工具,HNV就是基于高通量组学测序技术发现并进行深入研究的[5,41-42]。随着高通量组学方法的快速发展,先前报道的HNV保守引物已不适用于新发现的HNV基因亚型的检测,需研究者不断更新检测方法。
3.2 免疫学诊断
ELISA是利用表达重组蛋白作为抗原,抗体与酶复合物结合,通过显色来检测血清中病毒的抗体水平[43]。ELISA方法操作简便、特异性强、灵敏度高、时间短、效率高,适用于临床检测数量较多的血清样品[44],以及牛羊群HNV的流行病学调查,目前HNV的ELISA检测研究还完全空白。
有研究者构建HNVNS3基因的LIPS检测方法[22],但该方法与马丙型肝炎病毒存在交叉反应现象,在此之前也有报道马丙型肝炎病毒NS3融合蛋白与牛血清样本产生免疫反应[10],因此免疫学检测方法也存在不足之处。
4 HNV的预防控制
伴随养殖模式多样化、养殖密度高、从业人员素质参差不齐、对HNV没有足够的认识,HNV防控形势还远不尽如人意。截至目前,既无有效的治疗方法,又无免疫预防制剂用来防控HNV。
控制HNV的主要目标是为了进一步预防畜群出现感染或持续性感染,但尚无经济可行的控制措施。控制HNV首先需通过检疫筛查和淘汰感染动物,畜群要避免引入感染动物,这个策略成本略高,因其需要对畜群进行血清学调查并尽量把阳性动物隔离,使用核酸探针和RT-PCR可能更敏感,但成本较高。另一种方法是只允许免疫成年动物引入畜群,但目前尚无HNV的预防制剂。
HNV的防控策略很大程度上依赖于严格的生物安全。HNV可能通过血液、垂直传播及节肢动物叮咬途径感染牛,养殖场喷洒杀虫剂灭蚊和清除蚊及蜱等的滋生可有效减少HNV的感染;群体注射疫苗时应加强监控,杜绝注射针头的交叉使用;此外做好环境消毒,建立经济、快速的检测方法,及时监测、发现并隔离病牛,加强HNV的流行病学研究是预防和控制HNV传染的重要措施。
5 小结与展望
在过去的十年中,已在不同动物中发现了HCV同源病毒,极大促进了对HCV起源和进化的理解,并有利于在同源动物模型中研究HCV感染的发病机制和免疫应答能力。特别需要指出的是,HCV具有很强的变异能力[45],可能导致感染率的增加或不可预测的宿主适应性,可能是导致其跨种传播的重要因素。目前,尚不清楚HNV是否会感染人类,而全世界牛的种群规模巨大,存在多种直接和间接(即食源性)感染途径,突出了其作为病毒宿主的作用,可能需对这些新病毒进行监测和详细描述,以排除其对公共卫生造成的风险。
与其他病毒相比,HNV的研究进展甚微,除了其为2015年新发现的病毒以外,主要有以下原因:①HNV感染通常是无症状或非致命性的;②丙型肝炎病毒在细胞中的增殖能力有限,HNV的分离培养体系还没有完善;③HNV动物模型尚未建立起来,这些因素给研究者们在HNV上开展工作带来了极大的挑战。因此,建立和优化HNV的分离培养体系及动物模型是需要解决的首要问题。除此之外,今后的研究方向可分为以下几点:①建立完善且高效的诊断方法,如ELISA检测法;②加强HNV的基因结构与功能的基础研究;③建立系统的HNV流行病学资料;④加强对病毒溯源、变异及演化机制方面的研究,明确病毒的传播规律及病毒变异与致病性之间的关系;⑤加强HNV与牛肝脏疾病的相关性研究,揭示HNV的入侵途径、致病机制、逃逸机制、免疫机制等;⑥研发高效的预防和治疗药品,如疫苗等。
随着科学技术的进步,发现和鉴定新的病原微生物的能力越来越强。从发现HCV的存在到鉴定其病毒序列经历了14 年,到2003年科学家们发现并鉴定严重急性呼吸综合征病毒(SARS-CoV)耗费了几个月[46],而如今鉴定SARS-CoV-2只用了不到1个月[47-48]。未来是否还会出现新的致病性病原微生物难以预测,但目前的科学技术让人们有信心也有能力尽早发现鉴定病原微生物,通过进一步研究来控制其感染对人类或动物健康带来的危害。
