动物细胞低氧培养相关调控因子研究进展
2022-05-31姚一凡陈树吾马芳芳
张 兰,姚一凡,2,3,陈树吾,2,3,马芳芳,2,3,许 瑾,杨 琨,2,3
(1.西北民族大学生命科学与工程学院,兰州 730030;2.西北民族大学生物医学研究中心,甘肃省动物细胞技术创新中心,兰州 730030;3.西北民族大学生物医学研究中心,生物工程与技术国家民委重点实验室,兰州 730030)
氧是动物机体生存的必要物质,在低氧条件下细胞将激活诸多适应性反应,使氧供应满足生物代谢、能量和氧化还原等需求。细胞对周围氧环境的变化很敏感,氧浓度改变是一种生理刺激,会触发细胞中某些机制,导致细胞凋亡或适应低氧环境存活[1]。低氧诱导因子是低氧环境的主要转录因子,可调节细胞在低氧环境下的适应性,并起主导作用[2],如调控降低低氧反应中氧化磷酸化,增加糖酵解等来增加三磷酸腺苷(ATP)的产量[3]。通过与低氧适应性基因之间的相互作用调控细胞增殖、凋亡、细胞外基质代谢、细胞迁移及炎症等过程。
1 细胞低氧培养
氧是动物细胞培养过程中的必要条件,细胞通过氧产生的能量进行代谢。大多数细胞在常氧条件下(21或37 ℃)培养,但有报道指出,活体状态下各组织细胞的氧分压不同,如动物血液中氧体积分数为10%左右,软骨细胞为0~7%,脑组织为3%~14%,肺泡血管为14%,骨髓腔为1%~7%等[4]。马金兰等[5]研究发现,低氧培养大鼠肾小球内皮细胞可引起细胞增殖,并具有时间依赖性。 Christine等[6]也验证了这一观点,通过计算累计数量来确定细胞在长期培养中的增殖能力;在低氧条件下(3% O2)培养的细胞群落形成单位数较高,细胞的增殖率显著增长[7]。故低氧培养细胞有助于细胞增殖活性。
Yu等[4]在犬骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的研究中发现,低氧促进了BMSCs的增殖、迁移和分化。Wang等[8-9]研究结果显示,在低氧条件下培养的BMSCs增加了体内/外神经元分化潜力,降低了细胞的扩张和衰老,增加分化成骨、脂肪和软骨的能力;其进一步比较低氧对大鼠脂肪干细胞和骨髓源性干细胞扩增和软骨分化影响,结果显示低氧增加了脂肪干细胞和骨髓源性干细胞软骨分化潜能,减少了体内软骨损伤。低氧培养骨髓间充质干细胞的适应性研究结果显示,低氧改善了细胞的固有特性,对于开发干细胞疗法至关重要[10]。张姝婷等[11]研究发现,低氧条件(2%~9% O2)显著提高了细胞体外扩增的生长动力学及趋化因子受体的表达,也证实低氧可提高干细胞治疗效果。有报道指出低氧有助于体外治疗靶点的鉴定,如低氧培养间充质干细胞的细胞外囊泡减轻了慢性哮喘小鼠的过敏性气道炎症和气道重塑,增强了小鼠的抗哮喘作用[12];低氧预处理后的脂肪干细胞与支架相结合可使尿道管腔直径变大,并且保留尿道形态,通过上调血管生成和糖酵解作用更好地促进尿道重建[13]。 目前,越来越多的动物细胞种类、低氧培养方法及检测手段被应用到科研、医疗等领域,低氧细胞培养相关研究逐渐成为热点。
2 低氧相关调控因子
低氧诱导因子是低氧微环境适应性反应的关键转录调控因子,包括低氧诱导因子(hypoxia inducible factor,HIF)、血管内皮生长因子(vascular endothelia growth factor,VEGF)、低氧促有丝分裂因子(hypoxia-induced mitogenic factor,HIMF)和促红细胞生成素(erythropoietin,EPO)等,能应答细胞内氧浓度的降低,对多种低氧适应性基因进行调控,其通过与胞质中的下游靶基因、转录因子和胞内激活因子之间的相互作用调控细胞增殖、凋亡等过程,使细胞适应低氧状态得以存活,且可上调机体糖代谢相关生理指标,并参与糖代谢有关基因的调节,对低氧条件下细胞的发生、发展有重要作用(图1)。
2.1 HIF
HIF是一种碱性异二聚体蛋白,HIF复合物由O2依赖的α亚单位(HIFα)和β亚单位(HIFβ)组成。其中HIFβ属于芳香烃类受体蛋白。HIFα有3种独立亚基,HIF-1α、HIF-2α和HIF-3α,它们结构相似,功能却不同。HIF-1α是氧敏感亚基,是多条信号通路中介导低氧信号的转导中枢,具有重要作用。当细胞在低氧条件下培养时,胞质中的转录因子被激活进入核内,特异性结合靶DNA序列,从而调控靶基因的表达。在体外模拟低氧环境培养心血管细胞,HIF-1α的过表达增加了血管生成基因的表达。HIF-1α还直接调控Sentrin特异性蛋白酶1(Sentrin-specific protease 1,SENP1)并作用于血管内皮细胞内,使VEGF表达增加[14],对心脏起到保护作用。HIF-1α在心脏肥大时过表达,使细胞膜上的Ca2+内流增加,激活钙调磷酸酶通路,从而发挥抗凋亡作用[15]。 牛铁生等[16]研究发现,HIF-1α对中枢神经也具有保护作用,在低氧条件下能上调小鼠脑组织中HIF-1α mRNA表达,在中枢神经中是重要的低氧调节转录因子。HIF-2α表达具有特异性,
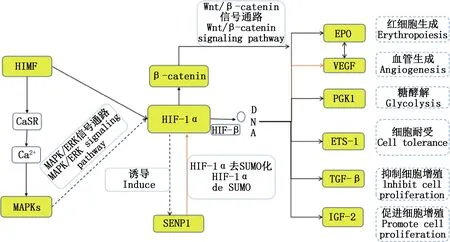
图1 低氧相关调控因子相互关系示意图Fig.1 Correlation diagram of hypoxia-related regulatory factors
对于靶基因调控与HIF-1α不同,主要介导慢性低氧期的机体反应,在不同动物器官中的表达不同,组织胚胎发育时期表达较高,而在成年表达较低,与HIF-1α功能上既相似,但又相互独立,二者在不同细胞之间表达差异机制还需进一步探索[17]。HIF-3α与HIF-1α和HIF-2α结构上差异大,功能也有很大不同,在转录水平上未发现直接受其调控的基因。其主要存在于动物心脏、胎盘组织、骨骼肌及肺脏组织中,其他组织少有表达,作为新发现的低氧诱导因子家族成员,其功能还不明确[18]。
2.2 VEGF
VEGF能促进全身各组织器官中血管内皮细胞的增殖、迁移和趋化。低氧是VEGF表达中最重要的诱因,VEGF是低氧条件下HIF-1α的靶基因,HIF-1α与VEGF基因的5′-端增强子结合位点相互作用,从而调节其转录与表达。Semenza等[19]研究证实了HIF-1α可调节VEGF的转录和翻译,HIF-1α使VEGF表达上调且具有相似的时间依赖性。此外,用siRNA技术抑制HIF-1α,细胞系中VEGF表达量明显下降,HIF-1α的调控作用也进一步得到证实[20]。 韩志伟等[21]报道指出,抑制HIF-1α/VEGF可抑制细胞的增殖。
2.3 HIMF
HIMF属于富含半胱氨酸的抵抗素样分子家族,主要结构是由111个氨基酸编码而成的10-半胱氨酸残基序列,分子质量约为9.4 ku,具有多种生物学功能,最早发现于低氧小鼠肺脏组织分离出的一种分泌蛋白,其在低氧条件下肺动脉高压形成,具有刺激血管收缩、细胞增殖、血管再生及肺血管重塑等多种作用[22]。
目前,低氧条件下HIMF介导的信号通路有Ca2+通道、PI3K/Akt/mTOR及PI3K/Akt-NFκB等。在低氧下,HIMF参与细胞内储存的Ca2+释放,在肺动脉平滑肌细胞外Ca2+浓度为零,使细胞内Ca2+浓度增加。吉廉治[22]为了证实细胞增殖是否也受Ca2+调控,加入Ca2+螯合剂,发现HIMF明显降低,HIMF可能作为一个配体通过与受体结合来影响整个细胞内Ca2+的释放,HIMF也可激活蛋白激酶B(protein kinase B,PKB,Akt)磷酸化,而磷脂酰肌醇3-激酶(PI3K)的抑制剂能抑制HIMF激活Akt磷酸化。低氧条件下HIMF增加细胞内第二信使Ca2+浓度后进一步激活PI3K/Akt/mTOR等通路,促进DNA合成,从而促进肺血管收缩反应和低氧性肺血管重塑形成[23]。此外,HIMF于气道上皮细胞研究中发现,PI3K/Akt通路参与HIMF诱导核因子κB (nuclear factor kappa-B,NF-κB)激活VEGF及血管黏附分子-1(vascular adhesion molecule,VCAM-1)表达,参与细胞有丝分裂、血管生成、炎症和血管收缩等过程。
HIMF还能与Bruton酪氨酸蛋白激酶(Bruton’s tyrosine kinase,BTK)功能性结合,使得细胞BTK磷酸化,通过激活该通路引起细胞迁移。Burke等[24]研究发现,在低氧条件下HIMF通过细胞因子对炎症反应起调控作用,介导促炎症微环境形成,从而促进循环细胞的招募、记忆、分化等,形成肺血管重塑。
2.4 EPO
EPO是红细胞生成调控过程中一种重要的糖蛋白激素。目前已证实在低氧刺激条件下,EPO在肾脏[25]、肝脏[26]等多个组织中均表达。在低氧刺激下EPO的适应性调控对于红细胞适应能力至关重要[27]。研究发现,低氧条件下HIF-1α通过与EPO基因的启动子结合实现EPO的转录,HIF-1α降解减缓,从而使EPO等下游靶基因表达增强[28]。Lee等[29]在HIF途径与红细胞增多症研究中发现,EPO的转录受一种独特的氧敏感机制的调控,在这一途径中,脯氨酸羟化酶域蛋白(PHD)对转录因子HIF-α的α亚基进行特异性羟基化,从而使HIF-α被肿瘤抑制蛋白(VHL)降解。 在低氧条件下,HIF-α翻译后修饰被抑制,从而稳定HIF-α并促进EPO的转录激活,进而明确低氧条件下HIF-1α与EPO的相互调控作用。
2.5 转录生长因子-β
转录生长因子-β(transforming growth factor β,TGF-β)是具有多种生物学功能的生长因子,主要存在于哺乳动物。在低氧培养大鼠肾小球内皮细胞的研究中发现,低氧条件下TGF-β1表达量明显比常氧下高,并随低氧时间延长而增加[30],说明低氧与TGF-β1存在间接联系。低氧培养大鼠骨髓间充质干细胞发现,HIF-1α高表达后TGF-β的mRNA与蛋白表达水平也显著增高,而HIF-1α低表达TGF-β的表达也显著降低,沉默内源性HIF-1α后,TGF-β表达没有变化,从而证实了HIF-1α与TGF-β的调控关系[31]。此外,胡媚[32]研究发现下调TGF-β-PI3K/AKT-HIF-1α信号通路可抑制HIF-1α及AKT表达,进而抑制细胞增殖。
2.6 磷酸甘油酸激酶1
磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK1)是可调节糖酵解的蛋白激酶,催化糖酵解途径中两个产生ATP的反应之一,与能量产生及氧化还原平衡有极大关系[3],PGK1也被归类为兼职蛋白,除在糖酵解和糖异生中的作用,还包括DNA复制和修复、血管生成、纤溶酶原结合和细胞侵袭等[33]。Xu等[34]研究发现,低氧使PGK1的表达量增加,并调节凋亡基因表达。此外,研究发现低氧条件下激活HIF-1α并与下游靶基因启动子区的乏氧反应元件结合,进而调控PGK1的转录,通过稳定上调PGK1的表达促使葡萄糖吸收、糖酵解和线粒体代谢等过程[35],为细胞代谢提供ATP,从而提高低氧诱导细胞糖酵解能力[36]。
2.7 ETS-1
ETS-1(E26 transformation specific 1,ETS-1)是一种转录因子,可通过对骨桥蛋白和黏蛋白等细胞外基质(extracellular mtrix,ECM)合成相关基因的调控,在血管形成中起重要作用;还可调节细胞黏附力、细胞外基质蛋白降解、细胞低氧耐受等多个环节。低氧条件下HIF-1α抑制内皮素-1启动子结合复合物,诱导ETS-1表达,进而提升了细胞对低氧的耐受力,使细胞生存、适应等一系列的生物学反应[37]。此外,研究发现,低氧条件下HIF-1α的激活诱导了ETS-1的表达,进而促使新血管的生成,因此ETS-1参与血管生成、细胞黏附力调节、细胞外基质蛋白降解和调节细胞低氧耐受等过程[38]。
2.8 胰岛素样生长因子-2
胰岛素样生长因子-2(insulin-like growth factor-2,IGF-2)在细胞有丝分裂的过程中起重要作用,IGF-2表达刺激细胞的增殖,并参与DNA复制和转录。IGF-2在大脑中枢神经系统的表达量非常高,与中枢神经系统的发生发展有着密切关系。IGF-2抑制细胞凋亡,进一步使组织器官生长、分化得到促进。研究表明,在体外低氧无血清的条件下,可诱导心肌细胞中IGF-2表达升高[39]。有报道指出,IGF-2是调节胚胎的生长因子[40]。IGF-2基因的表达在动物胚胎发育、脂肪沉积、骨骼与神经发育、细胞增殖分裂及调控转化等方面具有极显著的作用[41]。
2.9 β-连环素
Wnt/β-catenin是Wnt经典途径,β-连环素(β-catenin)是Wnt信号通路中重要因子。低氧通过HIF-1α中枢信号激活Wnt/β-catenin通路,同时Wnt/β-catenin通路反调控HIF-1α的转录,作用于下游的基因。有学者指出,在低氧培养骨肉瘤细胞体外增殖的研究证实了Wnt/β-catenint通路被低氧激活,进而调控下游转录因子的激活,使细胞异常增殖,说明低氧条件下细胞的增殖可能与HIF-1α经β-catenin激活Wnt通路诱导下游基因有关[42]。Wnt/β-catenin也可调控HIF-1α的转录,干扰β-catenin后,HIF-1α的表达明显降低,Wnt/β-catenin和HIF-1α互相调节以适应低氧微环境的变化进而影响细胞增殖。
2.10 丝裂原活化蛋白激酶
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 是胞内的一类蛋白激酶,主要介导细胞反应的重要信号系统及参与细胞的很多生长过程。低氧应激能诱导MAKP的家族成员的细胞外信号调节激酶(extracellular signal regulated kinase,ERK)磷酸化使细胞生长。ERK的上游调控因子丝氨酸/苏氨酸蛋白激酶Raf的N-端结构域与ERK结合并激活,使得ERK磷酸化,从而提高HIF-1α的表达水平[43]。余治国等[44]研究表明,下调HIF-1α抑制了细胞内MAPK/ERK通路,且抑制了细胞的和上皮-间质转化(EMT)。在HIF-1α和MAPK共同调控低氧肝星状细胞的活化刺激的研究中证实MAPK/ERK信号通路对HIF-1α的活性至关重要,包括HIF-1α的泛素化的减弱以及核易位的促进,从而使HIF-1α进入细胞核作为转录因子,在低氧条件下调节细胞的存活[45]。
2.11 SENP1
SENP1是小类泛素相关修饰物(small ubiquitin-related modifier,SUMO),HIF-1α靶蛋白被SUMO化修饰,其活性受到抑制,HIF-1α的稳定性增加[46-47]。在低氧条件下SENP1调节HIF-1α的研究中发现,HIF-1α诱导SENP1表达,反之SENP1使HIF-1α去SUMO化,进而形成正反馈回路,在低氧条件下稳定HIF-1α[48]。目前已确定低氧条件下SENP1是HIF-1α积累的关键因子,SENP1通过稳定HIF-1α来调节细胞的低氧适应性,如低氧条件下SENP1与HIF-1α的反馈回路能调节细胞增殖[49]。在低氧维持肝窦内皮细胞的研究中证实了这一观点,通过SENP1/HIF-1α/VEGF信号通路促进细胞增殖[50]。还有研究证明低氧条件下HIF-1α通过SENP1介导泛素特异性蛋白酶28(USP28)去SUMO化,进一步在细胞中积聚HIF-1α,以SENP1-USP28-HIF-1α正反馈调节HIF-1α的浓度并增强其转录活性[47]。
3 小 结
低氧培养细胞有利于提高细胞的生长动力学及趋化因子受体的表达,在细胞培养过程中细胞增殖间期、干细胞分化能力显著增加,且低氧能调节细胞中的氧化酶活性,使细胞中线粒体膜电位具有稳定作用[11]。随着低氧培养细胞的技术提高及检测技术的先进,对于不同细胞的生物学特性与机制将会有更全面的认识。
在低氧条件下,HIF-1α调控激活因子使信号通路被激活,对下游转录因子及靶细胞因子进行调控,从而与其产生相互作用,促进细胞在低氧环境下的发生与发展,使因子具有转录活性。低氧条件下HIF-1α可调控靶细胞因子VEGF、EPO及PGK1,从而促进细胞的增殖,并调节转录因子ETS-1与IGF-2,使细胞具有低氧耐受及抗凋亡等作用[37,40]。HIF-1α介导Wnt/β-catenin、MAPK/ERK、TGF-β-PI3K/Akt-HIF-1α和SENP1/HIF-1α等信号通路影响细胞增殖及血管生成。HIMF主要对肺动脉平滑肌细胞的增殖、迁移具有刺激作用,参与肺部多种疾病的生理过程,能调节肺血管重塑相关的炎性细胞、因子等,它还具有促进血管新生及血管收缩等作用,从而进一步了解HIMF在低氧条件下是否是低氧肺部疾病的治疗的一个靶点。HIF-1α与其他下游靶基因在分子水平及其他水平的进一步联系是今后研究的重点,笔者对上述领域的研究成果进行了归纳与综述,以期能在更高的水平下建立完善的低氧细胞传导通路的信号网络。
