绒山羊毛囊发育中非编码RNA的研究进展
2022-05-31梁加越王笑冰夏慧岩肖红梅
王 东,梁加越,王笑冰,冯 娟,张 茹,夏慧岩,肖红梅
(1.内蒙古农业大学生命科学学院,呼和浩特 010010;2.中国农业大学食品科学与营养工程学院,北京 100083;3.内蒙古自治区动物遗传育种与繁殖重点实验室,呼和浩特 010010;4.内蒙古自治区生物制造重点实验室,呼和浩特 010010)
绒山羊是中国重要的绒肉兼用型山羊品种,生产的羊绒以其特有的优良品质享誉国内外,被称为“纤维钻石”,在国民经济中占有举足轻重的地位。毛囊是皮肤的衍生物,是形成毛被的重要器官。绒山羊的毛囊结构根据形成的时间先后及不同的功能特点分为初级毛囊和次级毛囊。初级毛囊由上皮细胞和真皮层细胞分化、发育而来,生长有髓的粗毛;次级毛囊由初级毛囊发育形成,生长无髓的羊绒。它们的成熟结构由结缔组织鞘、内根鞘、外根鞘、毛球和毛干等构成。初级毛囊的周期性变化不明显,而次级毛囊具有明显的周期变化,历经生长期(anagen)、退行期(catagen)和休止期(telogen)[1-2]。在生长期,核因子κB(NFκB)和Wnt/β-cantenin信号通路首先被激活,上皮细胞数目增加,运动能力增强[3],形成基板;同时丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中的成纤维细胞生长因子10(fibroblast growth factors 10,FGF10)[4]、和FGF20[5]以及骨形成蛋白(bone morphogenetic protein,BMP)-转化生长因子β(transforming growth factor-β,TGF-β)通路中的骨形成蛋白4(bone morphogenetic protein 4,BMP4)、BMP7[6]等信号分子被释放使成纤维细胞运动和迁移能力增强并定向聚集,加快真皮聚集内陷形成毛乳头细胞[7]。随着毛乳头细胞的形成,Wnt信号通路激活了基板上层一侧,SHH(Sonic Hedgehog)信号通路,诱导毛母质细胞快速增殖分化并在其他信号通路的参与下,向真皮层延伸形成毛干和内根鞘、外根鞘,毛囊形态和结构逐渐形成。因此,高表达的Wnt信号通路和SHH信号通路成为了毛囊生长期的重要标志物[8]。毛囊的形态结构是一种动态平衡,当生长期维持一段时期后,在表皮生长因子(epidermal growth factor,EGF)、TGF-β等信号通路的作用下[9],Wnt信号通路激活被阻断,并诱导促凋亡蛋白BAX的表达,毛囊可再生部位的毛母质细胞增殖减少,外根鞘角质形成细胞凋亡[10],毛球发生萎缩,毛干停止分化,进入退行期。当细胞活性水平低下时,毛囊便进入休止期。在休止期[11],毛乳头细胞处于休止状态,毛囊完全失去活性[12]。在休止期结束时,Notch、Wnt等信号通路作用使毛球开始再生,毛囊干细胞分化并增殖,并且毛囊再生部分重建,毛母质细胞新一轮增生,进入下一个生长周期。此时,由于产生新毛干,将杵状毛干从皮肤表面推出,直至脱落[13]。毛囊的周期性变化表明间充质细胞是毛囊发生的诱导者,上皮细胞是应答者,二者间通过信号的传导刺激了毛囊的周期性变化[14]。
非编码RNA(non-coding RNA,ncRNA)是指不编码蛋白质的RNA,既包括已知功能的核糖体RNA(rRNA)、转运RNA(tRNA)、环状RNA(circular RNA,circRNA)、长链非编码RNA(long non-coding RNA,lncRNA)和小RNA(microRNA,miRNA),还包括一些未知功能的RNA。近年来,随着高通量测序技术的不断发展与完善,以及新的分子检验和分析方法的创新,发现了诸多除基因和蛋白水平外对绒山羊毛囊发育起调控作用的ncRNA。这些ncRNA的发现,为绒山羊毛囊发育及绒毛生长调控机理的研究提供了新的机遇。文章就miRNA、lncRNA及circRNA的发现和形成过程以及其在绒山羊毛囊发育中的时空表达及靶向调控机制的研究进行总结,为进一步挖掘调控毛囊发育的节点ncRNA和信号通路,揭示绒山羊绒毛品质调控机理提供参考。
1 绒山羊毛囊发育中miRNA的研究进展
1.1 miRNA的发现及形成
miRNA是Lee等[15]在1993年于秀丽隐杆线虫内发现的一类长18~25 nt的ncRNA,广泛存在于各种生物中,调节生物体生长、发育和凋亡等过程[16],被miRNA调控的基因表达存在复杂的组合模式,具有时空特异性[17-20],所以对miRNA功能的研究主要是通过转录表达及测序方式进行。它通过5′-端的6~8个种子序列碱基与其靶向基因3′-非翻译区碱基结合成互补序列,引起靶向mRNA降解或抑制翻译调节基因表达,从而调控绒山羊毛囊发育及绒毛生长,属于转录后的调控因子(图1)[21]。
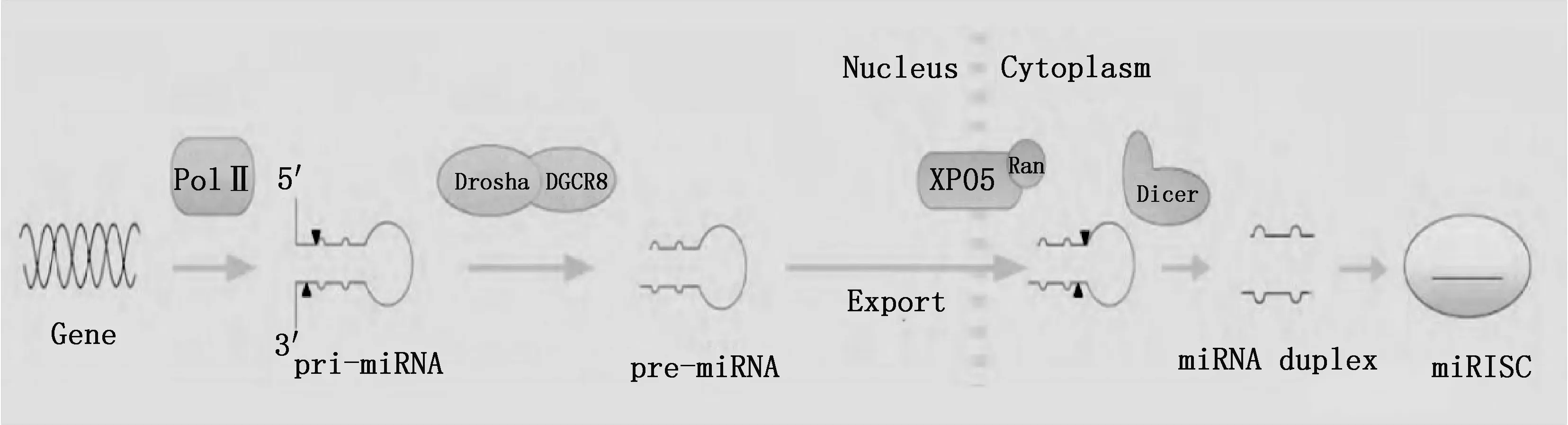
图1 miRNA形成的经典途径[21]Fig.1 The classical pathway of miRNA biogenesis[21]
1.2 miRNA在绒山羊毛囊发育中的时空表达及靶向调控机制
随着高通量测序技术和芯片等技术的不断发展,有关调控绒山羊毛囊发育的miRNA逐渐被发现和报道。 有研究指出,利用芯片技术得到了miR-24、miR-199a、miR-200b等15个可能在毛囊生长发育中起上调作用或直接靶向Wnt信号阻断通路的miRNAs[22];利用高通量测序鉴定了可能在毛囊发育和绒毛的生长中起重要调控作用的316个miRNAs,并发现miR-368、miR-668等22个新miRNAs[23]。有研究报道,Solexa测序比较山羊和绵羊皮肤miRNA转录组,鉴定了1 910个已知miRNAs和2 261个新的成熟miRNAs,并在此基础上鉴定出在两个文库中的差异表达的107个新的成熟miRNAs和1 246个已知miRNAs[24],此结果为探究与绒山羊毛囊发育相关的miRNA及进一步阐明miRNA在绒山羊毛囊发育中的调控作用奠定了基础;采用多组学方法鉴定了毛囊生长期与退行期表达的307个新的成熟miRNAs和差异表达的72个miRNAs,丰富了绒山羊的miRNA库,有助于更好地了解参与调控绒山羊毛囊生长和发育的miRNA的分子机制[25]。另外,通过研究褪黑素对绒山羊毛囊发育的影响发现,在毛囊兴盛前期,miRNA的下调能够提高毛囊细胞活性,抑制毛囊细胞凋亡,推测miRNA可与褪黑素相互作用,调控毛囊生长周期,从而影响绒山羊绒毛生长[26]。所以,miRNA不仅在毛囊中表达,而且具有选择表达性的特点[27],并与其他因子相互作用构成调控网络,调控毛囊生长发育相关靶基因的表达。
在皮肤毛囊生长发育过程中,miRNA及其靶向调控基因形成了多样化的调控网络,使得不同miRNA或同一miRNA具有多样化的靶基因。miRNA通过所在的信号通路负调控靶向基因从而抑制或促进毛囊的生长和发育。在Wnt/β-cantenin信号通路中,miR-214靶向抑制Wnt信号通路的传导,从而影响角质形成细胞增殖导致毛发形成减少[28]。有证据指出,miR-31的靶标为角蛋白16(KRT16)、KRT17、同源转录因子DLX3和FGF10,其过表达和缺失影响着BMP和Wnt/β-cantenin信号通路的活跃程度[29]。miR-let-7a的靶标为胰岛素样生长因子-1受体(IGF-1R)、C-myc和FGF5,通过调节它们所对应的信号通路影响毛囊的生长发育[30]。miR-195-5p在mRNA水平上抑制低密度脂蛋白相关受体蛋白(LRP6)的表达,调控毛乳头细胞Wnt/β-catenin通路的活化[31]。此外,基于毛乳头细胞构建的miR-125b的过表达模型和抑制表达模型证实了miR-125b影响FGF5、IGF-1、SHH、肿瘤坏死因子-α(TNF-α)、肌节同源框基因家族基因MSX2、淋巴细胞增强结合因子-1(LEF-1)、FGF7、头蛋白NOGGIN、BMP2、BMP4、TGF-β1和β-catenin的表达,双荧光素酶实验验证了miR-125b[32]与调控毛的长度的FGF5[33]和影响绒毛生长速度的TNF-α[34]之间有着直接的作用。TGF-β信号通路具有调控细胞的生长、分化、凋亡、迁移及细胞外基质的形成等多种重要的功能。有研究根据miR-1298-5p与TGF-βR1基因在毛囊周期中的表达趋势,推测miR-1298-5p可能通过负向调控TGF-βR1基因在毛囊不同时期的表达,来调控绒山羊绒毛的生长[35]。可见,miRNA在绒山羊毛囊发育中通过抑制与毛囊再生相关基因及相关信号通路的关键分子调控毛囊周期以及毛囊的再生能力。在毛囊发育的不同阶段,miRNA的表达水平也存在明显差异,miRNA表达的时空特异性更加彰显了其在毛囊生长发育中占据的重要地位。
2 绒山羊毛囊发育中lncRNA的研究进展
2.1 lncRNA的发现及形成
lncRNA是一类长度>200 nt的ncRNA分子,最初被看作是基因组转录的“噪音”,不具有任何生物学功能[36]。然而,1984年,Pachnis等[37]在小鼠中发现第一个真核lncRNA-H19,并在胚胎发育过程中高表达,开启了lncRNA参与生命活动过程并发挥重要作用的一系列研究,不同物种大量的lncRNA被发现,而且证实其具有mRNA样结构,经过剪接,具有polyA尾巴与启动子结构[38-39],参与细胞增殖与分化[40]、表观遗传调控、转录调控、转录后调控等[41-43]。大多数lncRNA在组织分化发育中具有特异性的时空表达[44-45]。lncRNA有4种产生模式(图2)[46]:①蛋白质编码基因突变导致框架结构断裂,从而产生lncRNA(图2A);②同一序列复制2次,使相邻的ncRNA产生重复序列(图2B);③转座原件序列插入之后,可产生具有功能的lncRNA(图2C);④非编码基因通过逆转录复制,也会产生lncRNA(图2D)。
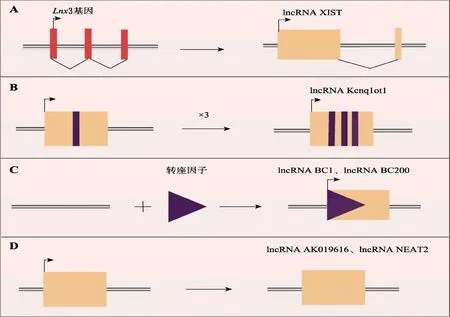
图2 形成lncRNA的主要模式[46]Fig.2 The origins of lncRNAs[46]
2.2 lncRNA在绒山羊毛囊发育中的时空表达及靶向调控机制
通过不同的研究方法对lncRNA进行筛选及功能验证,揭示了lncRNA多样化的作用机制。截至目前,发现影响毛囊发育的lncRNA有很多,但大部分lncRNA的作用主要是通过调控毛囊相关的信号通路以及相关基因的甲基化等来实现的。如应用lncRNA微阵列技术研究发现,Wnt通路中一些差异表达的lncRNA可能通过表观遗传修饰来调节Wnt通路抑制因子-1(WIF-1)和BMP,从而抑制毛乳头细胞中的Wnt信号传导,降低毛乳头细胞诱导毛囊重建的能力。其中,lncRNA-000133、lncRNA-H19、lncRNA-HOTAIR在绒山羊毛囊发育生长期的表达水平显著高于休止期[38]。通过对其靶基因的启动子甲基化分析表明,lncRNA-H19、lncRNA-HOTAIR、lncRNA-000133这3个靶基因的启动子区在休止期高度甲基化可促使其在绒山羊次级毛囊中的表达受到抑制。对羊绒周期性生长特异性lncRNA的筛选研究发现,生长期和休止期有6 127个lncRNAs表达,其中54个表达存在显著差异,有32个上调,22个下调。对差异表达的lnc5479进行靶向敲除发现其与毛囊的生长期密切相关,并且参与角蛋白的形成[47],该结果为进一步探究lncRNA的功能和特异的lncRNA在调控绒山毛囊发育及绒毛生长中的作用提供了理论依据。有研究报道,应用转录组测序技术研究发现,在次级毛囊休止期和生长期有13个差异表达的lncRNAs,其中lncRNA-599618、lncRNA-599556等6个lncRNAs均在毛囊生长期的Wnt信号通路中高表达,lncRNA-599528等4个lncRNAs在休止期高表达,这表明生长期高表达的6种lncRNAs可能与Wnt信号通路协同作用,促进毛囊基板形成及次级毛囊细胞(HFSC)的激活、分化和增殖,从而促进绒毛纤维生长,而休止期高表达的lncRNA可能抑制HFSC的分化,从而使毛囊处于休眠状态[48],该结果为进一步揭示lncRNA在其他哺乳动物皮肤毛囊中的周期转换机制提供了借鉴。随着多组学研究的发展,有研究采用多组学方法系统地鉴定了绒山羊毛囊生长期与退行期中表达的1 122个已知的lncRNAs和403个新的lncRNAs,通过差异分析寻找到173个差异表达的lncRNAs。联合miRNA研究,建立lncRNA-miRNA-mRNA网络,结果发现,在毛囊退行期lnc108635596通过miR-873介导靶基因TGF-β1和脑源性神经营养因子(BDNF)的表达[25],说明lncRNA和miRNA在绒山羊绒毛生长过程中共同作用,并作为miRNA的海绵调节与毛囊的发生发育及凋亡相关的基因表达。从竞争性内源RNA(ceRNA)调控网络角度研究,筛选出绒山羊生长期次级毛囊中4个显著上调的lncRNAs,9个显著下调的lncRNAs[49],所构建的网络表明,在山羊绒毛生长过程中,lncRNA475074可能通过与miR-653-3p竞争调控端粒聚合酶3(TANK3)的表达。因此,ceRNA调控网络的建立为进一步研究绒山羊次级毛囊中lncRNA的功能提供了条件。还有研究指出,lncRNA与褪黑激素有密切关系,褪黑激素通过上调lncRNAMTC的表达来激活NF-κB信号通路,并对lncRNAMTC对应的靶基因的表达量检测发现,lncRNAMTC的靶基因肿瘤坏死因子α诱导蛋白3(TNFAIP3)表达明显下调[50],而TNFAIP3(A20)基因的下调有利于激活NF-κB信号通路[51]。也有证据证明,lncRNA5322通过调控miR-21介导PI3K-Akt信号通路,上调丝裂原活化蛋白激酶1(MAPK1)的表达促进毛囊干细胞的增殖和表皮分化[52]。由此可见,lncRNA不仅在绒山羊毛囊细胞的增殖、凋亡和分化及绒毛生长中发挥重要的调控作用,而且在其他物种如细毛羊、小鼠等哺乳动物的毛囊发育中也起到同样的作用[41],通过参与调控毛囊生长相关靶基因的表达与多种信号通路NF-κB、Wnt、PI3K-Akt等互作发挥生物学功能。但目前对于lncRNA调控绒山羊毛囊发育及绒毛生长相关的研究主要集中在相关lncRNA的筛选、鉴定等方面,其调控机制仍不明确。随着分子生物学技术和基因编辑技术的快速发展,深入揭示lncRNA调控绒山羊毛囊发育及绒毛生长分子机制成为必然,从而为绒山羊绒毛品质的提高提供新的研究方向。
3 绒山羊毛囊发育中circRNA的研究进展
3.1 circRNA的发现及形成
circRNA是Diener[53]于1971年在植物类病毒中首次发现,具有闭合环状结构的一类新型的内源性ncRNA[54],由单个mRNA前体通过外显子和内含子的5′-端与3′-端反向剪接而成,存在于高等真核生物细胞内[55],富含在miRNA结合位点,在细胞中起到miRNA海绵的作用,即通过内源性竞争机制,解除miRNA对其靶基因的抑制作用,升高靶基因的表达水平。circRNA表达比其他ncRNA稳定,有组织特异性和物种保守性的特点[56],不易被RNA外切酶降解,但可通过小干扰RNA(small interfering RNA,siRNA)的介导降解[57]。circRNA按来源可分为外显子circRNA(exon circRNA)、内含子circRNA(intron circRNA)、外显子与内含子结合的circRNA(exon-intron circRNA)以及基因间circRNA(interegenic circRNA)[58]。但大多数为外显子circRNA[59]。circRNA的功能多样,除了作为miRNA海绵调控靶基因表达外[60],还可与RNA结合蛋白(RBP)形成RNA-蛋白复合物,调控基因的转录,甚至少数的circRNA可以编码、翻译为蛋白质[61-62]。circRNA的产生有2种模型,包括套索驱动的环化模型和内含子配对驱动的环化模型(图3)。由于RNA发生部分折叠RNA前体在转录过程中拉近相邻的外显子,使得下游外显子的剪接供体(splice donor,SD)的3′-端和上游外显子的剪接受体(splice acceptor,SA)的5′-端结合,致使外显子跳跃(exon skipping),产生包含外显子的内部拼接套索,去除内含子序列形成具有2个外显子的circRNA。RNA前体上2个不相邻的内含子互补配对,使得与该内含子相连的2个外显子相互接近,下游外显子的剪接供体3′-端和上游外显子的剪接受体5′-端结合,反向剪接形成套索,再切除内含子,形成circRNA[57](图3)。

图3 索尾插接(Backsplicing)形成模型和circRNA形成机制[57]Fig.3 Backsplicing formation model and circRNA formation mechanism[57]
3.2 circRNA在绒山羊毛囊发育中时空表达及靶向调控机制
circRNA可以作为miRNA的海绵,其与mRNA竞争miRNA的靶标结合位点,circRNA在绒山羊毛囊发育中的作用机制逐渐成为研究热点。在绒山羊次级毛囊的毛干中鉴定出circRNA-1926,经过分析验证,揭示circRNA-1926可通过miR-148a/b-3p的介导,调控细胞周期蛋白依赖性激酶19(CDK19)基因的表达,促进绒山羊毛囊干细胞向次级毛囊分化[63-64],表明circRNA可通过miRNA的介导调控关键基因的表达来调控毛囊发育。为探究不同物种特异表达的circRNA,通过比较分析辽宁绒山羊和内蒙古绒山羊中的转录组序列,鉴定出绒山羊皮肤中存在13 320个circRNAs,其中差异表达的有32个。 经实时荧光定量PCR验证得到4个circRNAs,即circRNA128、circRNA3620、circRNA4154和circRNA6854[65]。通过高通量测序获得45、55、65和75 d绒山羊胚胎毛囊中circRNA的表达谱,鉴定出21 784个circRNAs,通过GO功能富集分析和KEGG信号通路富集分析表明,与毛囊发育相关的信号通路为Notch信号通路和NF-κB信号通路,将75和45 d的circRNA与miRNA和mRNA数据库结合,构建了circRNA-miRNA-mRNA的调控网络,预测出102对相互作用的circRNA-miRNA和126对miRNA-mRNA;通过双荧光素酶报告基因检测验证了其中的circRNA3236和chi-miR-27b-3p、circRNA3236和chi-miR-16b-3p具有靶向关系[66],表明circRNA和特定的miRNA具有靶向关系,circRNA可通过miRNA调控靶基因表达。另外,在对湖羊的circFTO和circCSPP1与miR-148a和miR-10a的靶向关系研究中也得到了验证,即此2个circRNAs可通过结合miRNA正向调节靶基因BMP7的表达而促进毛乳头细胞的增殖,从而影响毛囊的生长发育[67]。由此可见,不管是绒山羊胎儿皮肤毛囊中circRNA的表达谱的建立还是circRNA-miRNA-mRNA调控网络的构建,均为今后有关circRNA调控绒山羊毛囊发育机制的研究提供了方法和思路。这些研究结果对于后续进行绒山羊皮肤毛囊发育中circRNA的作用及其所在信号通路研究奠定了基础。但由于circRNA-miRNA-mRNA形成的ceRNA网络在毛囊生长发育中的研究还处于起始阶段其调控机制十分复杂,因此circRNA在绒山羊毛囊生长发育中的相关信号通路及靶基因功能还需进一步深入研究。
4 小 结
ncRNA的发现及其功能的探究,为基因组无法诠释的复杂性的生物发育机制提供了新的思路。由于目前对ncRNA在绒山羊毛囊发育方面的研究甚少,缺乏相应功能的数据库,且研究大部分集中于筛选和鉴定及一些调控通路的网络的建立,技术比较单一,而且绝大部分如miRNA、lncRNA、circRNA的功能及其重要的调控机制仍不够清晰。因此,在以后的ncRNA研究中,利用毛囊单细胞测序、芯片等技术及实时荧光定量PCR、免疫组化、RNA干扰、过表达、原位杂交进行亚细胞定位、CRISPR/Cas9、酶联免疫等实验技术验证,结合全基因组序列及蛋白组学研究发现更多有关绒山羊毛囊发育的ncRNA,建立毛囊发育3个发育阶段的ncRNA数据库和ceRNA调控网络,深度挖掘调控毛囊发育的节点ncRNA和信号通路,同时通过表型遗传探究主要的信号通路(如Wnt/β-cantenin)与其他通路的关联性及受体与配体的相互作用,对揭示毛囊生长发育调控机制起重要作用。相信随着研究的深入及生物技术的日益发展,一些与绒山羊毛囊发育相关的未知ncRNA将逐渐被发现,其功能也会被深度解析。
