1株黄曲霉颉颃菌的鉴定及其抑菌活性成分分析
2022-05-31李天溪
李天溪,党 萌,龙 淼
(沈阳农业大学动物科学与医学学院,重要家畜疫病研究教育部重点实验室,沈阳 110161)
黄曲霉(Aspergillusflavus)作为曲霉属真菌能通过产生分生孢子的方式污染多种农作物,可导致花生黄霉病、玉米穗腐病[1]等多种常见的植物病害。其在受到刺激(如高温、干旱)时产生的黄曲霉毒素[2]是造成食品及饲料污染的主要原因[3]。人畜误食污染的农副产品会感染具有高发病率和死亡率的曲霉病,出现呼吸衰竭或神经麻痹等症状[4-5],给人们带来巨大的经济损失和安全隐患。但常见的物理化学等防治方法又存在药物残留等诸多弊端。近年来,生物防治因其专一性、环境友好性、易于产业化等优势逐渐成为热点[6]。生防菌的筛选鉴定为安全有效地抑制黄曲霉污染提供了可能[7]。解淀粉芽孢杆菌(Bacillusamyloliquefaciens)可颉颃多种导致植物患病的致病真菌[8-9],其不仅能抑制黄曲霉的生长,对黄曲霉产生的黄曲霉毒素也有很好的降解效果[10],是一种很有开发前景的生防菌。基于此,本试验尝试从试验室保存的若干菌株中筛选鉴定黄曲霉颉颃菌,以期为实际生产应用中通过生物防治方法安全有效地抑制黄曲霉污染提供理论依据。
生防菌对真菌的颉颃作用多源自于其代谢产生的抗菌活性物质[11-12],这些物质主要是存在于菌株无菌发酵上清液中的酶、抗生素、细菌素或其类似物及一些次生代谢产物和副产物。通过代谢工程或优化颉颃菌的培养条件可使颉颃菌高水平产生抑菌活性物质,从而产生更好的抑菌效果[13-15]。本研究对菌株培养条件进行了探索,并分离颉颃菌抗真菌活性成分,以期为进一步研究抗菌机制和量产应用奠定基础。
1 材料与方法
1.1 菌株
74种供试菌株由沈阳农业大学动物医学与科学学院临床教研实验室保存。
黄曲霉产毒菌株购自中国科学院微生物研究所(编号:3.4408)。孢子悬液的制备:黄曲霉菌通过高盐查氏培养基37 ℃培养72~96 h充分形成孢子。刮取孢子到装有灭菌水和数颗玻璃珠的锥形瓶中混合振荡1.5 h,活化并分散孢子。纱布过滤后制成单孢子悬液,通过血球计数板计数调整浓度至107CFU/mL。
1.2 主要试剂及仪器
革兰氏染色剂购自杭州滨和微生物试剂有限公司;核酸染色剂(GoldView)、50×TAE、考马斯亮蓝R-250、Tris、硫酸铵均购自北京索莱宝科技有限公司;细菌基因组总DNA提取试剂盒、TaqPCR 2×Master Mix均购自生工生物工程(上海)股份有限公司;PBS购自武汉赛维尔生物科技有限公司;PAGE凝胶快速制备试剂盒购自上海雅酶生物科技有限公司。
AB104-S型分析天平购自Mettler Toledo公司;SW-CJ-2F型超净工作台购自苏州安泰有限公司;DHP-9162恒温培养箱购自上海一恒科学仪器有限公司;高速冷冻离心机购自Thermo Fisher Scientific公司;凝胶成像仪、PCR仪、电泳仪均购自Bio-Rad公司;细菌过滤器(0.22 μm)购自白鲨生物科技有限公司;显微镜购自Leica公司;HiTrap Capto DEAE色谱柱(5 mL);SuperdexTM75 Increase 10/300 GL色谱柱和KTA蛋白纯化系统均购自Cytiva公司。
1.3 培养基
根据文献[16]配制GAM液体/琼脂培养基、高盐查氏培养基、PDA培养基、LB培养基、LA培养基、NA培养基、SYP培养基、MRS培养基。
1.4 方法
1.4.1 黄曲霉颉颃菌筛选 在PDA培养基中加入一定量配好的黄曲霉孢子悬液摇晃混匀制备固体平板,挑取供试菌单菌落用“十字划线法”划板,28 ℃培养72 h,以未接菌平板为空白对照,对黄曲霉颉颃菌进行初筛。
初筛通过的菌株在GAM液体培养基增菌24 h,菌液离心并滤掉菌体后取1 mL注入PDA培养基中制备固体平板。在平板中间打孔并注入25 μL黄曲霉孢子悬液,28 ℃培养72 h,以无菌空白培养基代替上清液为对照,对黄曲霉颉颃菌进行复筛。
测量黄曲霉生长直径,用抑菌率表示颉颃菌无菌上清液的抗菌效果。每个处理重复3次,取平均值作为测定结果。抑菌率计算公式:
抑菌率(%)=(对照组直径-试验组直径)/对照组直径×100%
1.4.2 黄曲霉颉颃菌鉴定 将菌株接种于LB固体培养基上培养24 h,观察其菌落形态特征并取样进行革兰氏染色,于显微镜下观察菌体形态。应用《常见细菌系统鉴定手册》所述方法及鉴定程序对菌株进行生理生化鉴定。
通过基因测序的方法对菌株进行分子生物学鉴定。应用细菌DNA提取试剂盒提取颉颃菌DNA,采用16S rDNA与gyrB基因组合的方式,通过PCR扩增相应序列。16S rDNA上、下游引物为F27:5′-AGAGTTTGATCCTGGCTCAG-3′;R1492:5′-ACGGCTACCTTGTTACGACTT-3′。gyrB基因上、下游引物为UP-1SF:5′-ATTGGTGACACC-GATCAAACA-3′;UP-2SR:5′-TCATACGTAT-GGATGTTATTC-3′。引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系均为50 μL:TaqPCR Master Mix 25 μL,DNA 模板4 μL,上、下游引物各2 μL,ddH2O 17 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共33个循环;72 ℃延伸10 min;4 ℃保存30 min。将PCR产物用1.0%琼脂糖凝胶电泳检测并回收纯化,交由生工生物工程(上海)股份有限公司进行测序。在GenBank数据库中使用BLAST程序分别对所得的16S rDNA和gyrB基因序列进行比对。应用DNAStar及Mega 7.0软件进行相似性分析及系统发育树构建。
1.4.3 颉颃菌最佳培养条件测定 通过单因素试验,在不同的培养基(NA、LA、MRS和SYP)、培养基装液量(15、30、40、50、75和100 mL)、温度(10、20、30、37、40和50 ℃)、转速(10、60、120、140、180和240 r/min)、培养时间(12、24、36、48 和60 h)、接种量(1%、2%、3%、4%和5%)及pH (5.0、6.0、7.0、8.0和9.0) 7个培养条件条件下培养颉颃菌制备菌液。按照复筛的操作及计算抑菌率的方法验证菌液作用效果。
1.4.4 抗真菌活性粗提物对黄曲霉作用的评价 参考文献[17]采用硫酸铵沉淀法对颉颃菌无菌发酵上清液进行粗提取:菌株活化后以1%接菌量接种于 LB 培养基,37 ℃、150 r/min震荡培养3 d后4 ℃、9 000 r/min离心15 min取上清液。向其中加入硫酸铵至其饱和度为50%,4 ℃过夜。之后4 ℃、13 000 r/min离心15 min,用适量PBS缓冲液收集沉淀。透析过滤得到蛋白粗提液。
观测粗提物对黄曲霉菌丝生长、重量及形态的影响。 PDA平板中央打孔注入黄曲霉孢子悬液,在距孔2 mm处放置滴加粗提物的滤纸片,用等量50%硫酸铵溶液处理的滤纸片作对照,观察菌丝生长情况。再在其中挑取正常生长的和受抑制的菌丝分别做成切片并用棉兰染色,在显微镜下观察其形态结构的差异。另外,分别将0、400、800和1 000 μL粗提物加入含有黄曲霉孢子混悬液的PDA培养基中,28 ℃培养5 d后过滤菌体并烘干称重。
1.4.5 抗真菌蛋白的分离纯化及其活性评价 通过阴离子交换色谱初步纯化。按上述方法制备粗提液并将其装载到HiTrap Capto DEAE色谱柱上,用线性浓度梯度为0.01~2.0 mol/L的Tris-NaCl(pH 8.0)缓冲液以1 mL/min的流速洗脱,按照吸收峰的不同分别收集洗脱液。制备含有黄曲霉孢子的PDA固体平板并打孔,分别注入不同组分的洗脱液每孔50 μL,以灭菌水作对照,37 ℃培养过夜,评估各组分抗真菌活性。
之后通过凝胶过滤色谱进一步纯化抑菌效果好的组分。将待测液装载到SuperdexTM75 Increase 10/300 GL色谱柱上,用缓冲液(含20 mmol/L Tris,50 mmol/L NaCl,pH 8.0)以0.2 mL/min的流速洗脱,按照吸收峰的不同分别收集洗脱液。按上述方法检测各组分抑菌情况。
1.4.6 抗真菌蛋白氨基酸序列测定 各组抗菌蛋白通过SDS-PAGE得到蛋白条带。结合抑菌情况进行分析,选取相应的条带交由北京华大蛋白质研发中心有限公司进行质谱测序鉴定。通过BLAST程序与NCBI蛋白序列数据库中相应序列进行比对,初步判断所得抗菌蛋白的种类及功能。
2 结 果
2.1 颉颃菌的筛选
初筛结果显示,有5株菌可抑制黄曲霉生长并形成抑菌带(图1),复筛后发现,仅编号为B10的菌株对黄曲霉有明显颉颃效果(图2),黄曲霉直径平均值为3.15 cm,对照组为5.21 cm,抑菌率达到39.54%。证明菌株B10抑制了黄曲霉的生长。

图1 黄曲霉颉颃菌初筛结果Fig.1 Preliminary screening results of antagonistic strains of Aspergillus flavus

A,对照组;B,试验组A,Control group;B,Experimental group图2 黄曲霉颉颃菌复筛结果Fig.2 Rescreening results of antagonistic strains of Aspergillus flavus
2.2 颉颃菌的鉴定
培养24 h后,平板表面长出一个个微隆起的白色圆形菌落,表面粗糙有褶皱,直径3~4 mm(图3)。由图4和表1可知,菌株B10是一种能产生孢子的、圆杆状革兰氏阳性好氧细菌,接近芽孢杆菌属。
以通用引物进行PCR扩增,获得1条1 500 bp左右的16S rDNA序列和1条1 000 bp左右的gyrB基因序列(图5)。通过序列比对及相似性分析发现,菌株B10与解淀粉芽孢杆菌GD4a(HM055603.1)的16S rDNA序列相似性为98.5%,在同一分支(图6、7);与解淀粉芽孢杆菌JX014631.1在同一分支且gyrB基因序列相似性为99.8%(图8、9)。可确定此菌为解淀粉芽孢杆菌,保藏在中国微生物菌种保藏中心(保藏号CCTCCNO:M2018353)。
2.3 颉颃菌最佳培养条件的测定
不同培养条件下菌株B10对黄曲霉的抑制效果存在差异。由图10A可知,以LA为培养基培养的菌株B10抑菌率最高,达到46.56%,后续试验均以LA为培养基。由图10B可知,40 ℃时得到最高抑菌率32.84%,其他温度下抑菌率低或几乎不抑制。由图10C可知,培养36 h效果最好,抑菌率达到31.53%,其他时间对应的抑菌率由高到低排序为60 h>48 h>24 h>12 h。由图10D可知,在接菌量到达3%前,接种量越大抑菌效果越好,最高抑菌率达到28.15%,之后迅速下降,抑菌效果极微弱。由图10E可知,pH为6.0和7.0时抑菌效果均较好,抑菌率分别为28.85%和26.53%。由图10F可知,120 r/min的抑菌效果最好,抑菌率为26.46%。由图10G可知,装液量为30 mL时抑菌率高达29.37%。
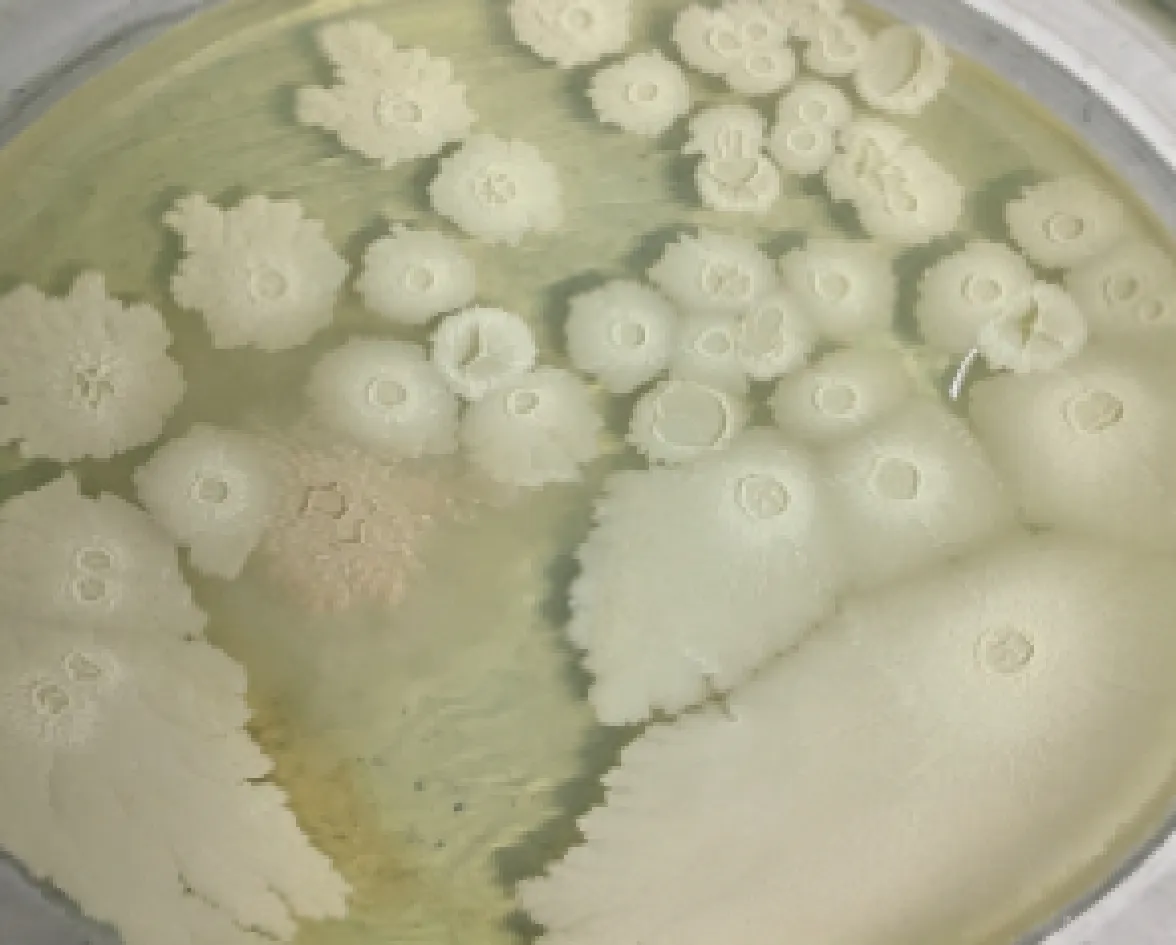
图3 菌株B10菌落形态Fig.3 Colony morphology of strain B10
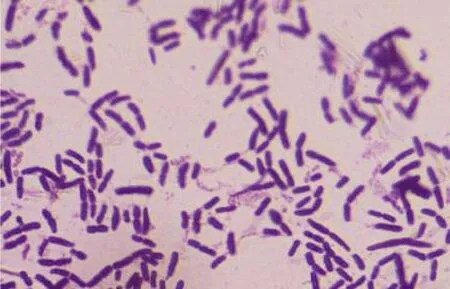
图4 菌株B10革兰氏染色结果(1 000×)Fig.4 Gram staining result of strain B10 (1 000×)
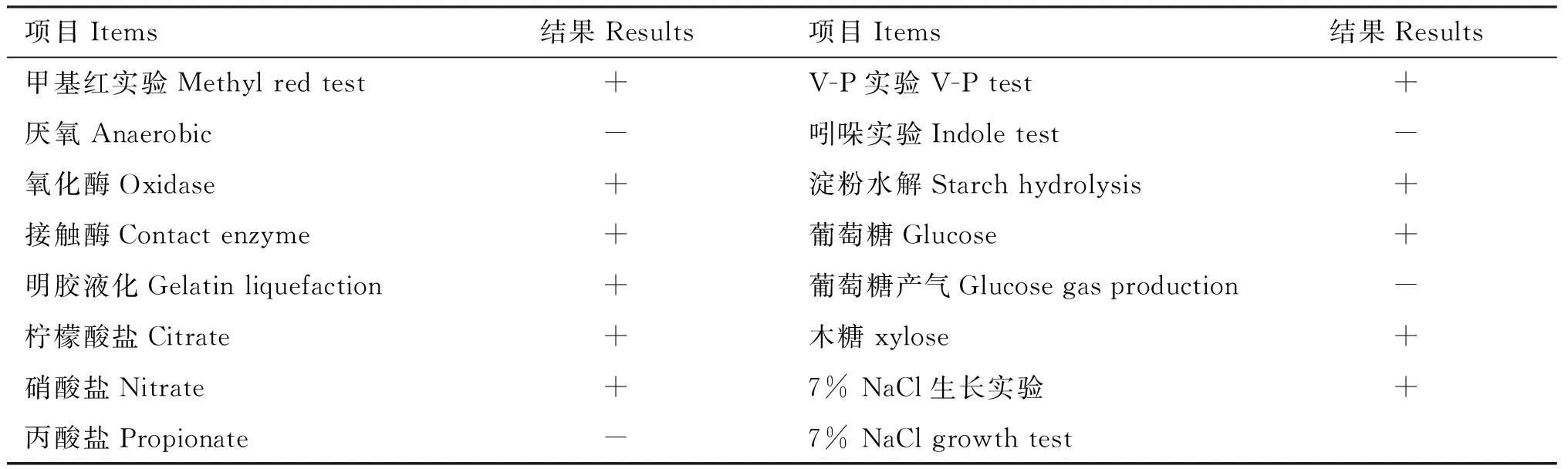
表1 菌株B10生理生化鉴定结果
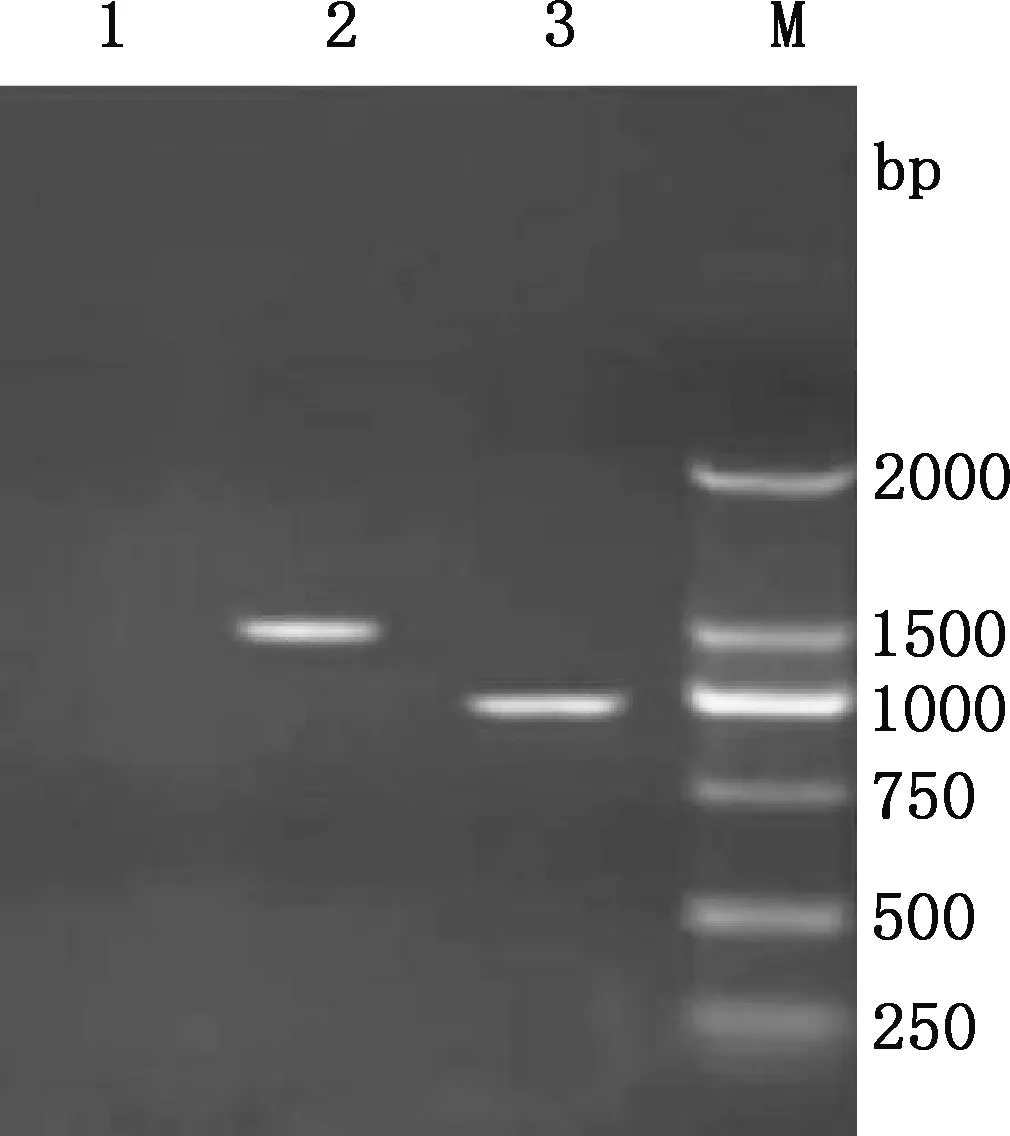
1,阴性对照;2,16S rDNA;3,gyrB基因;M,DL2000 DNA Marker1,Negative control;2,16S rDNA;3,gyrB gene;M,DL2000 DNA Marker图5 16S rDNA及gyrB 基因PCR产物电泳图Fig.5 Electropherogram of 16S rDNA and gyrB gene PCR products
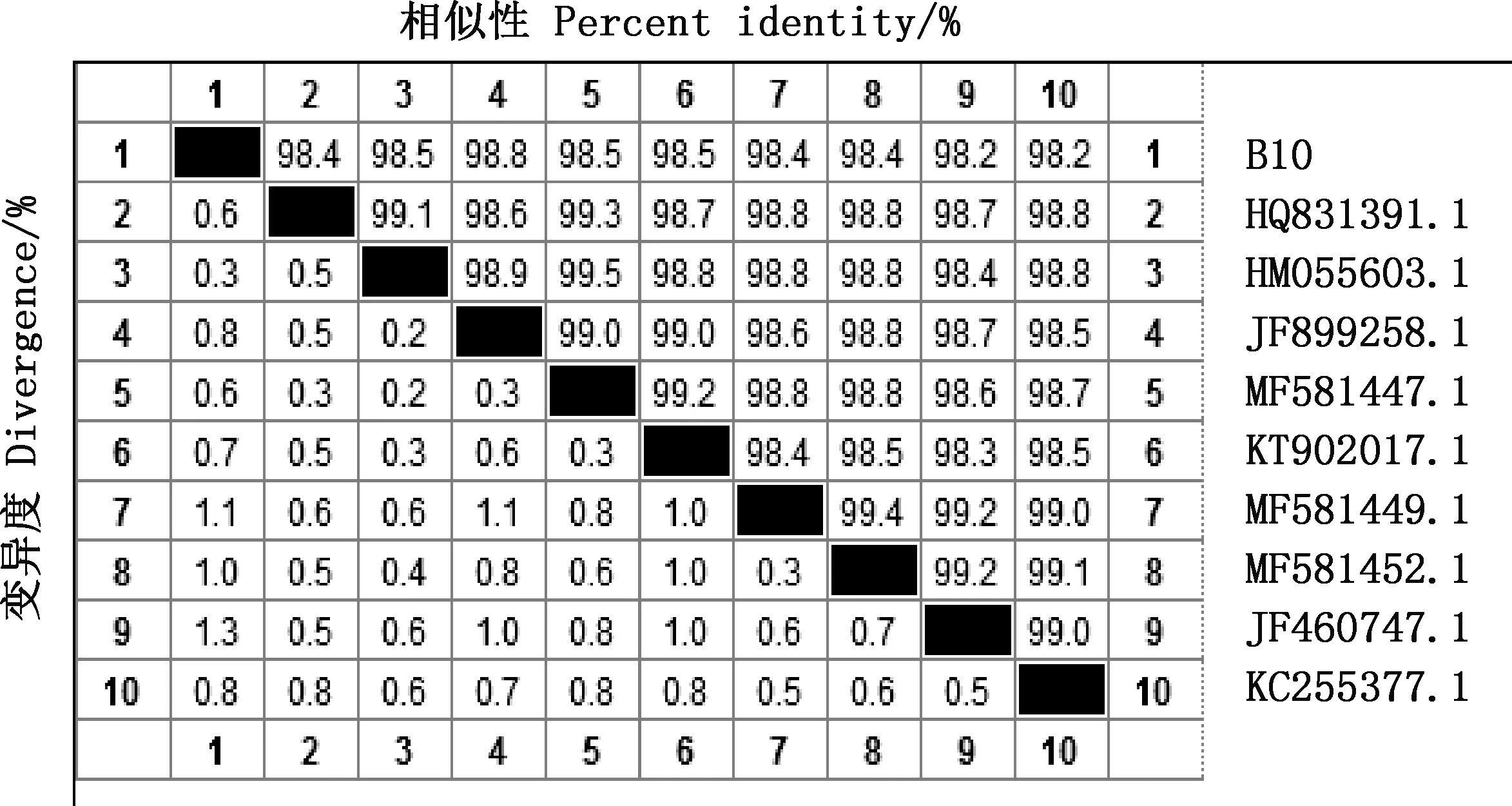
图6 菌株B10的16S rDNA序列相似性分析Fig.6 Similarity analysis of 16S rDNA sequence of strain B10
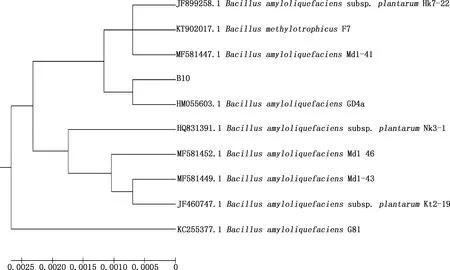
图7 菌株B10与参考株基于16S rDNA序列的的系统发育树Fig.7 Phylogenetic tree of strain B10 and reference strains based on 16S rDNA sequence
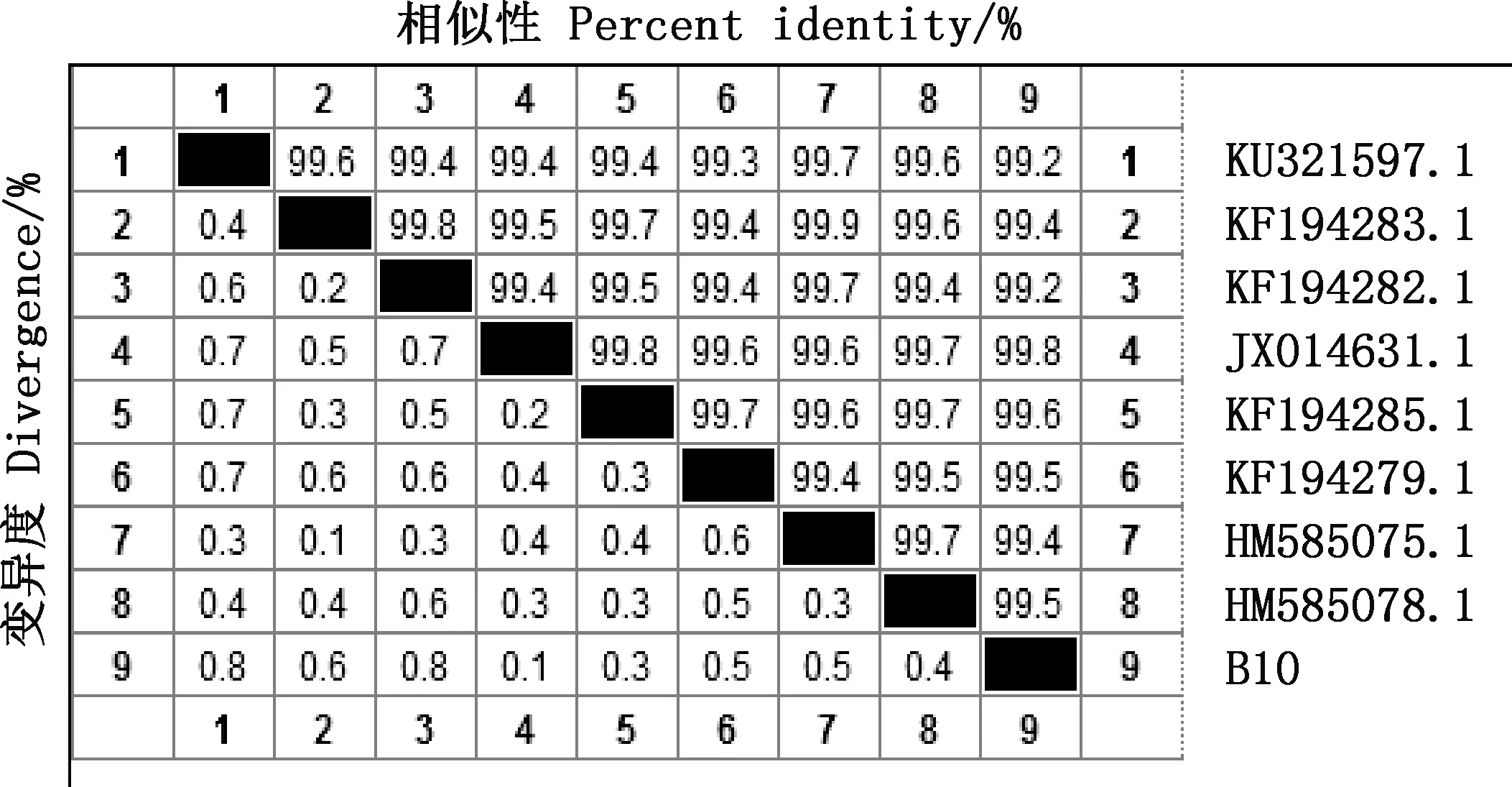
图8 菌株B10的gyrB基因序列相似性分析Fig.8 Similarity analysis of gyrB gene sequence of strain B10
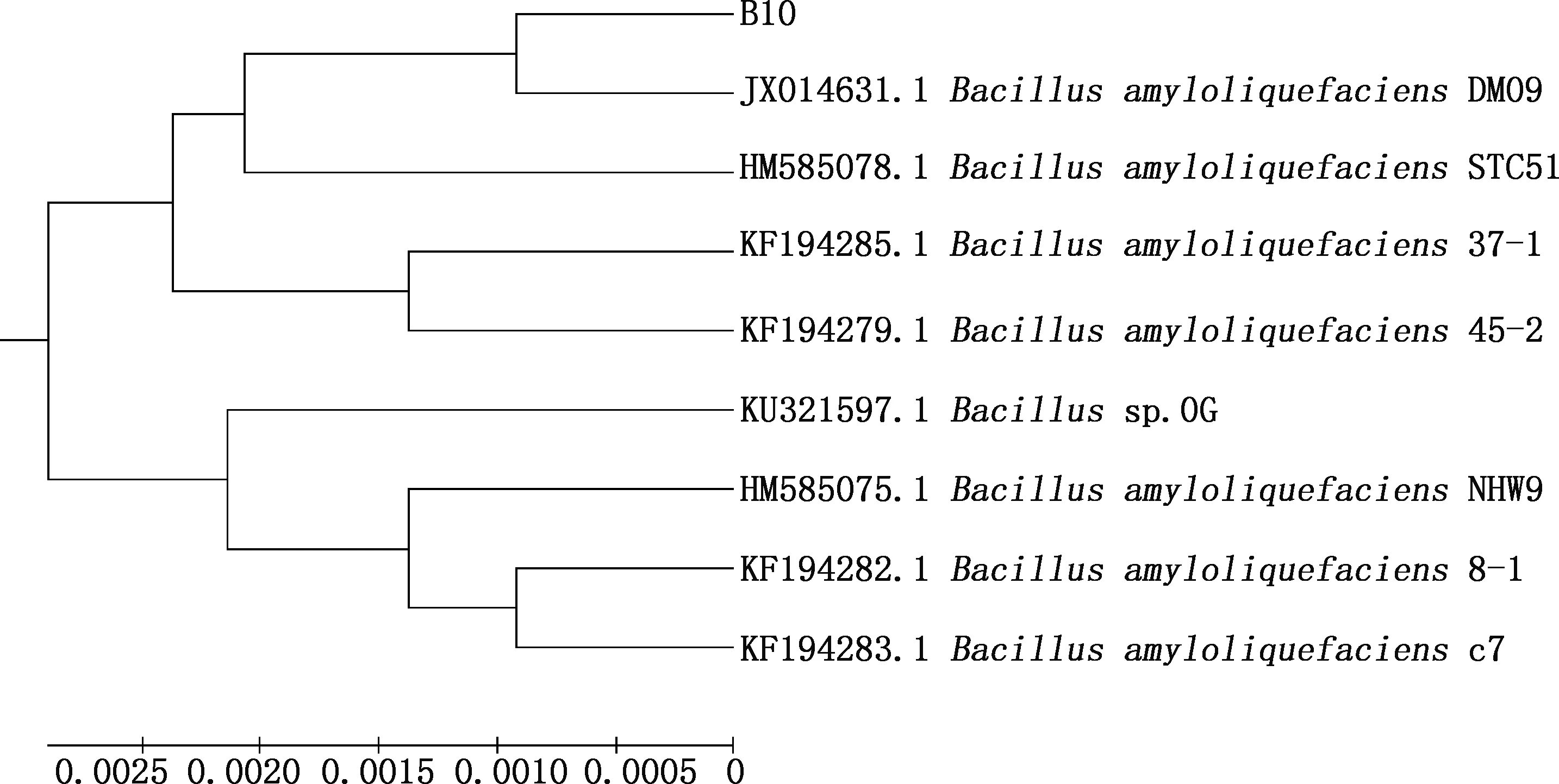
图9 菌株B10与参考株基于gyrB基因序列的的系统发育树Fig.9 Phylogenetic tree of strain B10 and reference strains based on gyrB gene sequence
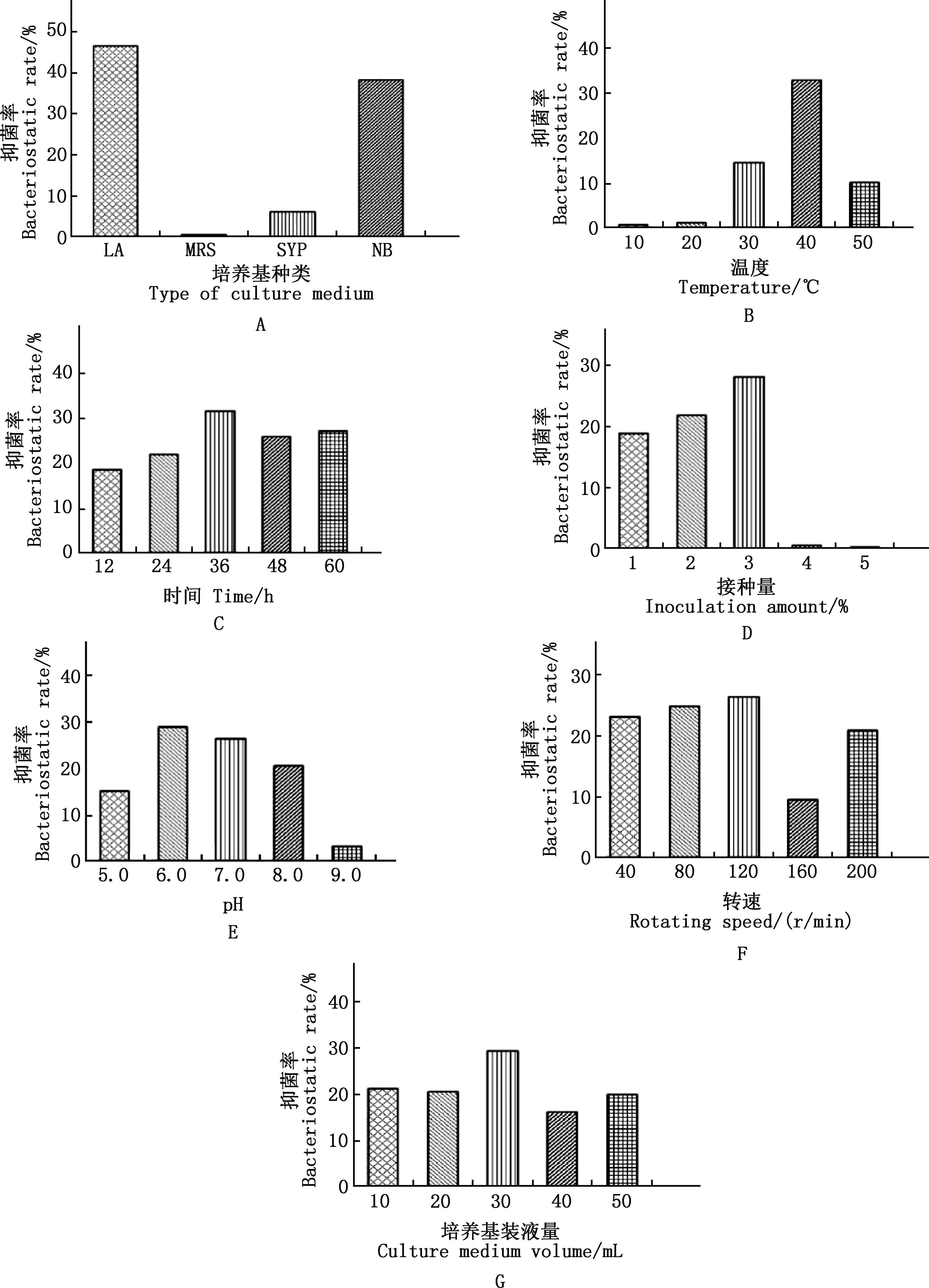
A,培养基;B,培养温度;C,培养时间;D,接种量;E,初始pH;F,转速;G,培养基装液量A,Culture medium;B,Culture temperature;C,Culture time;D,Inoculation amounts;E,Initial pH;F,Rotating speed;G,Culture medium volume图10 不同培养条件下菌株B10对黄曲霉的抑菌率Fig.10 Bacteriostatic rate of strain B10 against Aspergillus flavus under different culture conditions
2.4 粗提物对黄曲霉菌丝的影响
由图11可知,粗提物的添加抑制了黄曲霉的正常生长,形成了抑菌带,使菌株呈“方块”型,而对照组黄曲霉生长正常,证明粗提物对黄曲霉有抑制效果。
显微镜下菌丝形态见图12。由图12可知,正常黄曲霉的菌丝较笔直,孢子为规则的圆形或椭圆形。而粗提物作用下的黄曲霉菌丝则呈不规则弯曲状,菌丝体粗细不一。表明粗提物对黄曲霉菌丝形态造成了严重破坏,影响黄曲霉生长发育。
对菌丝干重的测定结果见图13。由图13可知,随着粗提物含量的增加,黄曲霉菌丝重量呈明显下降趋势。 未经处理的菌丝干重为3.20 g,当粗提液加入量达1 000 μL时,菌丝的重量减少到0.13 g,同比减少了96.05%。
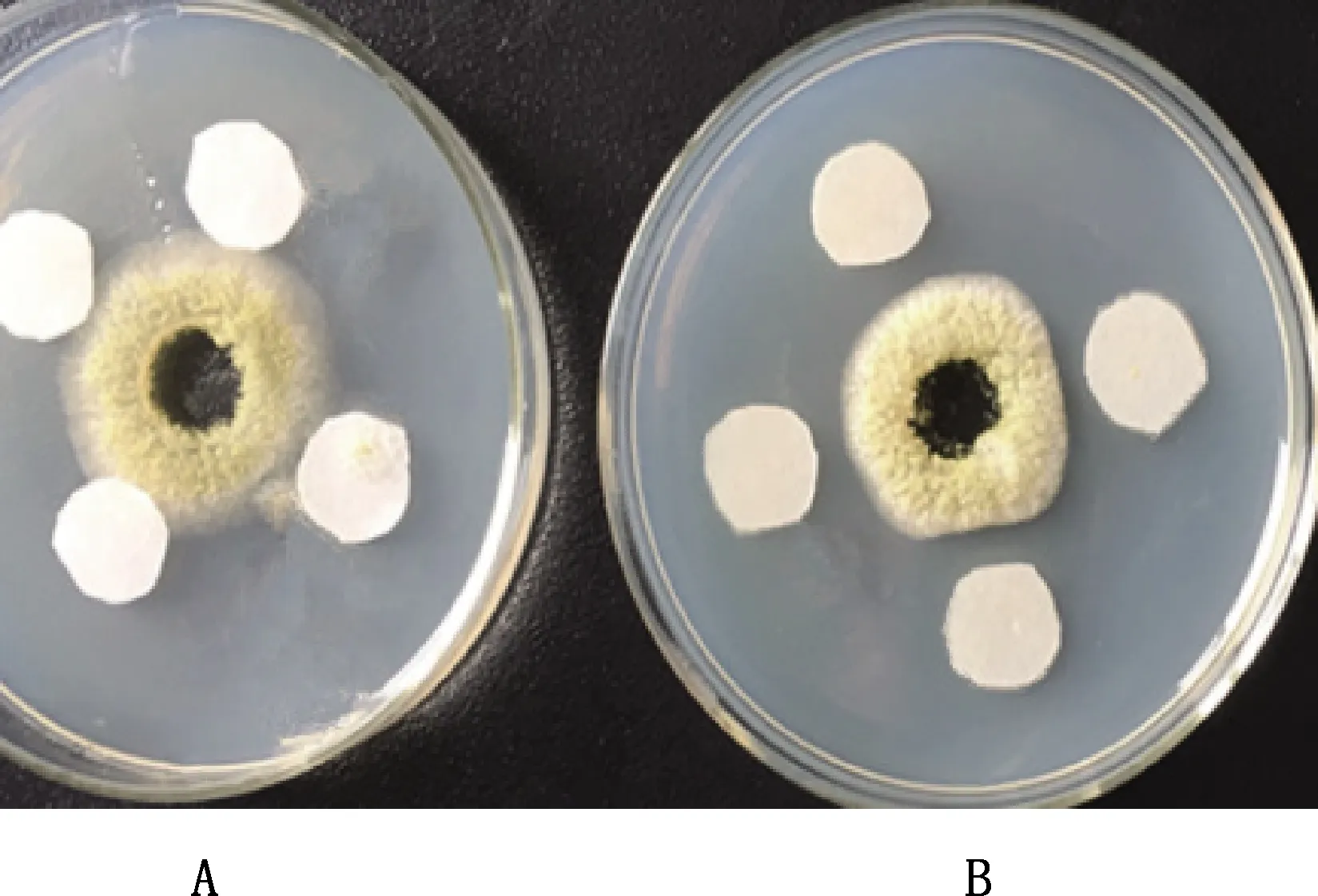
A,对照组;B,粗提物组A,Control group;B,Crude extract group图11 抗真菌活性粗提物对黄曲霉菌的作用效果Fig.11 Effect of crude extract with antibacterial activity on Aspergillus flavus

A,正常菌丝形态;B,粗提物作用下的菌丝形态A,Normal mycelial morphology;B,Mycelial morphology under the action of crude extract图12 抗菌活性粗提物对黄曲霉菌丝形态的影响(400×)Fig.12 Effect of crude extract of antibacterial activity on the morphology of Aspergillus flavus mycelia (400×)
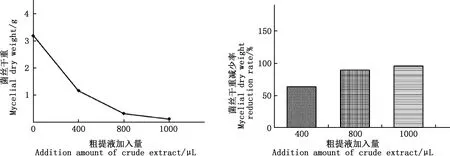
图13 抗菌活性粗提物对黄曲霉菌丝干重的影响Fig.13 Effect of crude extract with antibacterial activity on the dry weight of Aspergillus flavus mycelium
2.5 抗真菌蛋白的分离纯化及活性评价
粗提物经过阴离子交换色谱得到具有5个峰的洗脱曲线(图14)。各组分抑菌结果显示,培养12 h后,5个蛋白组中2、3号峰出现明显抑菌圈且直径较大,分别为1.52和1.23 cm。5号峰也出现抑菌圈,相较2、3号小,平均直径为0.81 cm,但其抑菌圈内最干净,抑菌带边缘最清晰。其他组分无抑菌效果。培养2 d后再次观察发现,除5号峰外,其余各组分抑菌圈均消失(图15)。
凝胶过滤色谱进一步纯化组分5,得到的洗脱峰曲线见图16。各组分抑菌结果显示,7个蛋白组中,只有5-2和5-3出现清晰且明显的抑菌圈,平均直径分别为1.21和1.08 cm,且后续抑菌圈不消失(图17)。其余5个组分均无显著抑菌效果。
2.6 蛋白测序分析
通过SDS-PAGE制得组分5蛋白条带,结合抑菌情况,选取组分5-2和5-3蛋白条带送测序。返回数据与蛋白质序列数据库中相应序列进行比对,得到一系列蛋白鉴定信息。整理数据并查阅相关文献之后,罗列了5-2和5-3中存在抗真菌可能性的8种蛋白(表2)。
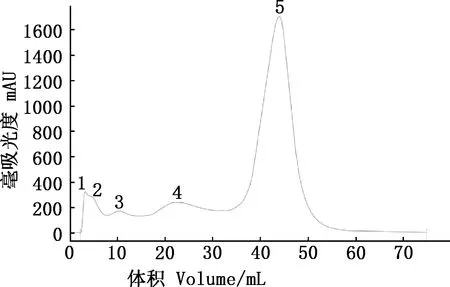
图14 阴离子交换结果Fig.14 Anion exchange results
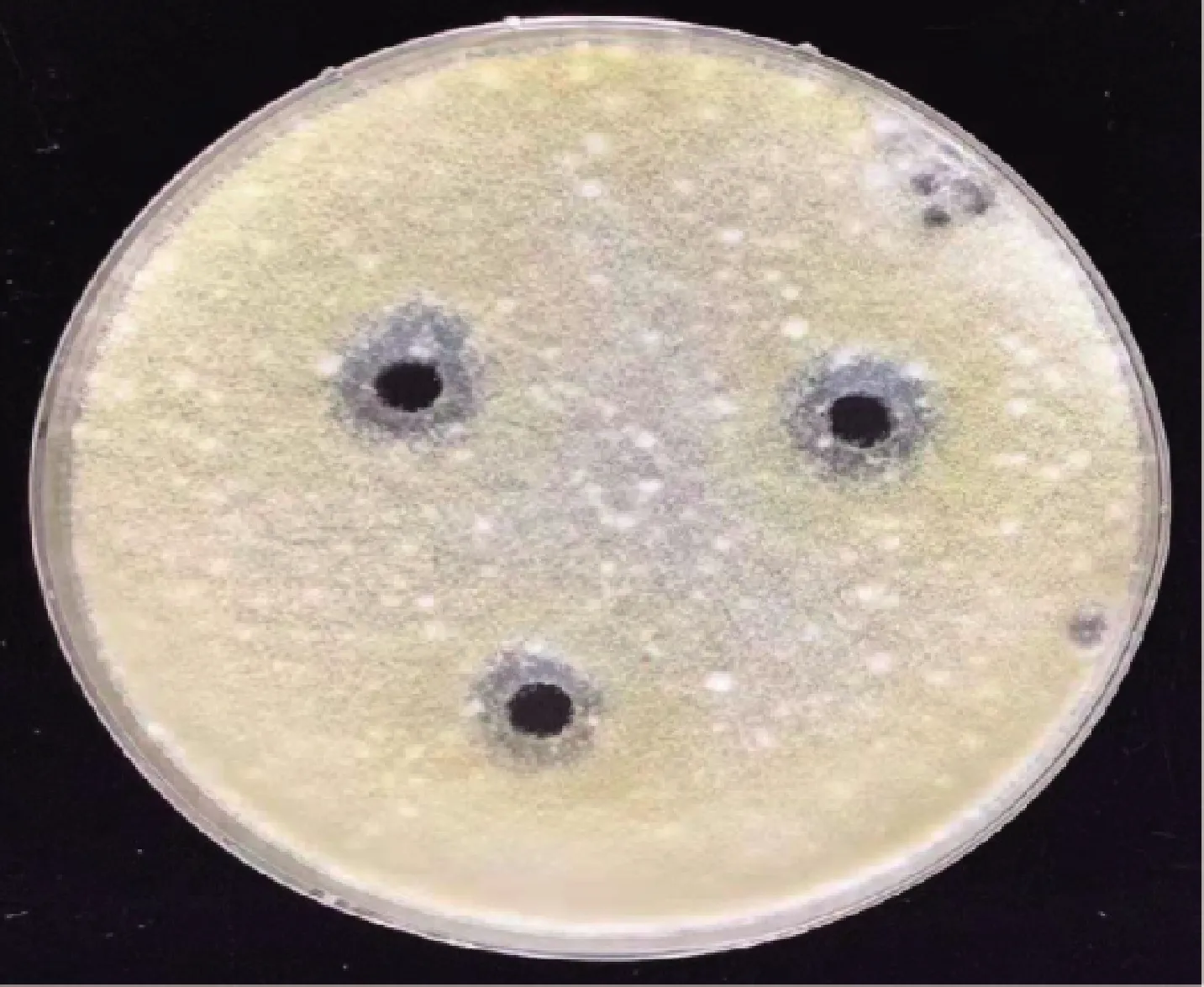
图15 组分5的抑菌效果Fig.15 Antibacterial effect of component 5
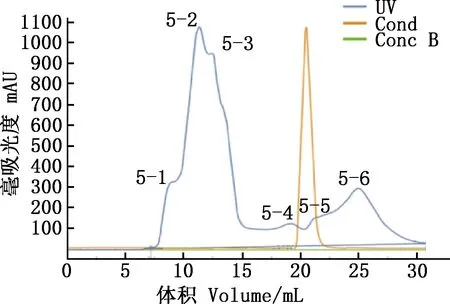
图16 组分5纯化结果Fig.16 Purification results of component 5

图17 5-2和5-3的抑菌效果Fig.17 Antibacterial effect of 5-2 and 5-3
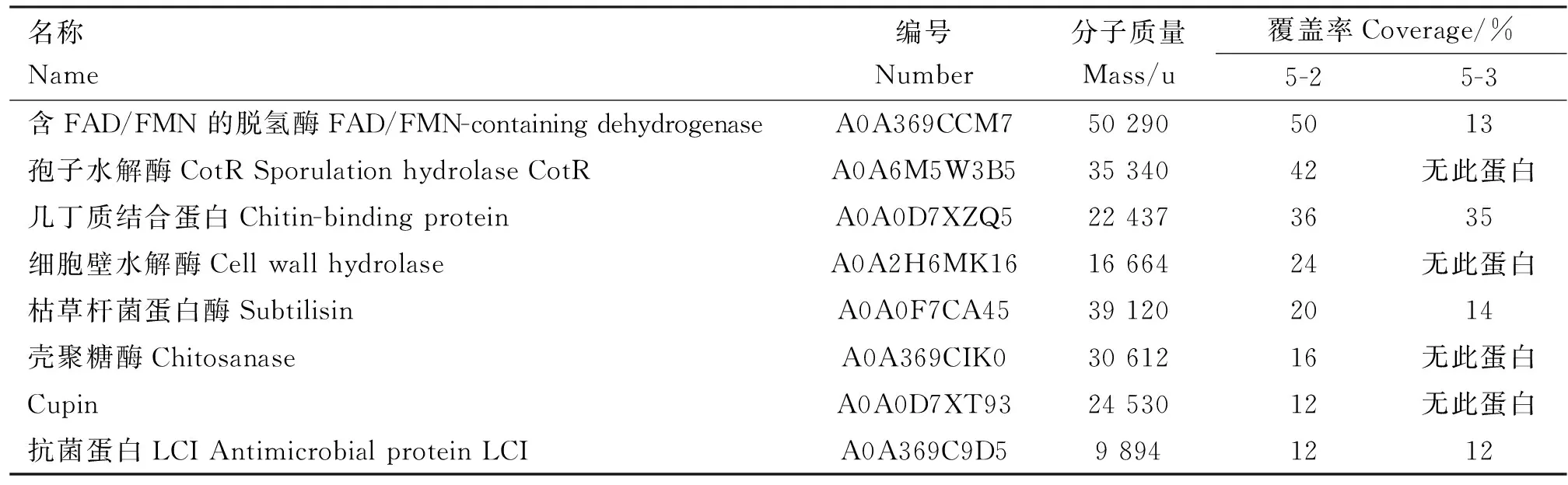
表2 存在抗真菌可能性的蛋白
3 讨 论
生防菌的筛选鉴定一直是生物防治的重要方法之一。本试验筛选出的解淀粉芽孢杆菌是畜禽养殖中常见的益生菌[18],在防治农作物病害上也有十分广泛的应用[19]。很多取得专利的生防菌及抑菌剂均与其相关[20-21],且其产生的次级代谢产物也有成为抗菌药物的潜力[22]。
颉颃菌的培养条件往往会对其抗菌效果产生重要影响。同为解淀粉芽孢杆菌,本试验确定的最适温度与秦楠等[23]试验结果相似,说明此温度接近颉颃菌最适生长温度,细菌生长速度快,代谢旺盛。但最适pH与秦楠等[23]及刘小玉等[24]结果有所不同,这可能是菌株产生的活性物质种类和所抗真菌种类不同导致的。有研究指出细菌会通过增减碱基来适应环境温度及pH的变化[25],这可能会对其蛋白质组成及功能产生影响。此外,最佳培养时间、活菌数及其生长状态明显影响抑菌物质产量,死亡细菌也可能释放出相应化学成分影响抑菌物质活性,这也是接菌量及培养液装量影响抑菌率的主要原因[26]。本试验在摇床转速120 r/min时抑菌率最高,但也有高转数下抑菌效果更好的报道[27]。这可能与颉颃菌对氧气的需求量有关。王晶[26]试验结果表明培养基种类对不同接菌量下活性物质产量的影响,揭示了各培养条件间的相互作用。所以对于确定菌株的最佳发酵条件,除了单因素试验,常通过方差分析选出影响显著的因素进行响应面设计[23],并应用模型综合评估其对菌株生长的影响[28],利于进一步优化菌株发酵工艺,提高产量,加快试验进程[29]。
对菌株B10作用机制的研究证实,粗提蛋白能明显抑制菌丝生长,破坏菌丝形态。冯蓉等[30]及Brown等[31]也发现了真菌菌丝在活性物质作用下的变化。但前者的结果显示这一改变影响了真菌生长,后者则是降低了真菌毒力,所以菌株B10最根本的抑菌机制还需深入研究。纯化的几种活性蛋白中,几丁质结合蛋白[32]和壳聚糖酶[33]是已被证实的能有效颉颃真菌的活性物质。他们作用于几丁质和壳聚糖,通过破坏真菌细胞壁发挥抗真菌作用。尤其是壳聚糖酶,其高生物降解性、无毒和抗微生物特性使其被广泛应用。除了作为天然生物膜抑制剂直接对抗病原菌[34],其酶解壳聚糖产生的壳寡糖也具有抗菌及抗氧化活性[35]。其余各蛋白均存在其颉颃真菌的相关报道(如含FAD/FMN的脱氢酶[36]、枯草杆菌蛋白酶[37]、Cupin家族蛋白[38]及LCI家族蛋白[39])或其作用方式可能会对真菌产生一定影响(如孢子水解酶[40]及细胞壁水解酶[41])。而这些蛋白的具体作用效果还需通过后续试验进行验证。
4 结 论
本研究分离鉴定出1株抑制黄曲霉菌丝生长的解淀粉芽孢杆菌B10,其最优培养条件为温度40 ℃,培养时间36 h,接种量3%,转速120 r/min,pH 6.0,装液量30 mL,其抑菌活性成分可能是几丁质结合蛋白、壳聚糖酶等。
