1株珊瑚共附生真菌GXIMD 02504的次级代谢产物及抑菌活性研究
2022-05-30张艳婷彭帅黄炳耀巫明媚陈锦营卢护木高程海刘永宏罗小卫
张艳婷?彭帅?黄炳耀?巫明媚?陈锦营?卢护木?高程海?刘永宏?罗小卫
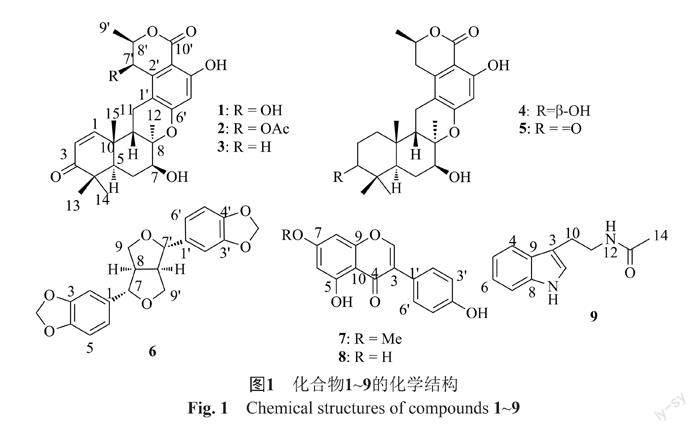
摘要:目的 开展1株北部湾来源珊瑚共附生真菌Talaromyces verruculosus GXIMD 02504的次级代谢产物及其抗菌活性研究。方法 采用多种现代色谱分离技术对菌株发酵产物进行分离纯化,利用核磁共振技术和文献数据对比解析化合物的化学结构,并采用滤纸片琼脂扩散法和改良肉汤稀释法测定其抑菌活性。结果 从其液体发酵产物中共分离鉴定了9个化合物,分别为chrodrimanins A-B, E-F, H(1~5)、芝麻素(6)、樱黄素(7)、5,7,4-三羟基异黄酮(8)、N-acetyl-tryptamine(9)。化合物8显示出对表皮葡萄球菌(Staphylococcus epidermidis)的弱抑制活性,最小抑菌浓度(minimal inhibitory concentration, MIC)为78 μg/mL。结论 从菌株T. verruculosus GXIMD 02504中分离得到以chrodrimanin类混源萜为主的化合物9个,其中化合物6~8为首次从该属中分离得到,且化合物8具有一定的抗表皮葡萄球菌活性。本研究丰富了该菌次级代谢产物的结构多样性。
关键词:珊瑚共附生真菌;疣孢篮状菌;次级代谢产物;抑菌活性
中图分类号:R9文献标志码:A
Antibacterial secondary metabolites from a coral-derived fungus Talaromyces verruculosus GXIMD 02504
Zhang Yan-ting, Peng Shuai, Huang Bing-yao, Wu Ming-mei, Chen Jin-ying, Lu Hu-mu, Gao Cheng-hai,
Liu Yong-hong, and Luo Xiao-wei
(Institute of Marine Drugs/Affiliated International Zhuang Medicine Hospital, Guangxi University of Chinese Medicine, Nanning 530200)
Abstract Objective To investigate the secondary metabolites from the Beibu Gulf coral-derived fungus Talaromyces verruculosus GXIMD 02504 and their antibacterial activity. Methods The fermentation products of the strain were isolated and purified by various modern chromatographic separation techniques. Structures of the obtained compounds were identified by nuclear magnetic resonance data analysis as well as comparison of literature data. Their antibacterial activity was further evaluated by methods of the Kirby-Bauer test and the modified broth dilution. Results Nine compounds (1~9) were obtained from the liquid fermentation products, which were determined as chrodrimanins A~B, E~F, H (1~5), sesamin (6), prunetin (7), 5,7, 4-trihydroxyisoflavone (8), and N-acetyl-tryptamine (9), respectively. Compound 8 showed weak antibacterial activity against Staphylococcus epidermidis, with minimal inhibitory concentration (MIC) of 78 μg/mL. Conclusion Nine compounds exemplified by chrodrimanin-type meroterpenoids were isolated from Talaromyces verruculosus GXIMD 02504, and meanwhile compounds 6~8 were obtained from the Talaromyces genus for the first time. In addition, compound 8 was found with antibacterial activity against S. epidermidis. This study would enrich the structural diversity of the strain.
Key words Coral-derived fungus; Talaromyces verruculosus; Secondary metabolites; Antibacterial activity
廣西北部湾地处热带和亚热带,拥有红树林、珊瑚礁、滨海湿地、海草床等典型海洋生态系统,是我国生物多样性最为丰富的区域之一,近年来已成为海洋微生物资源与化学研究的热点区域之一[1]。珊瑚礁生态系统具有很高的生物多样性和生产力水平,珊瑚表面和内部共附生有大量的微生物,包括真菌、细菌和放线菌等,这些微生物与宿主在长期的共同进化进程中形成了互惠共生的关系。宿主珊瑚为共生微生物提供居所,共生微生物通过产生化学防御物质以护卫宿主[2-4]。目前报道的珊瑚共附生微生物活性天然产物大多由真菌产生(85%以上),包括聚酮、萜类、生物碱、肽类、脂质等结构类型,具有抗菌、抗肿瘤、抗病毒、抗炎及抗污损等生物活性[4-5]。
疣孢篮状菌(Talaromyces verruculosus)主要来源于土壤[6],少数自海洋环境中分离到[7-8]。该菌属菌株被报道能够产生多种农业或工业用途降解酶,如纤维素酶、PHB解聚酶、可可碱降解酶等[7, 9-10]。疣孢篮状菌能够产生结构多样且活性显著的次生代谢产物,如萜类、聚酮类、香豆素类等,具有抗结核、抗肿瘤、抗菌等生物活性[8, 11-12]。本研究团队一直致力于典型海洋生态系统来源微生物活性次级代谢产物的发掘研究[13-14],从涠洲岛鹿角杯形珊瑚(Pocillopora damicornis)中分离得到一株代谢产物丰富的真菌T. verruculosus GXIMD 02504。利用色谱分离技术从其发酵产物中获得以chrodrimanin类混源萜为主的9个化合物(图1),分别鉴定为:chrodrimanins A-B, E-F, H(1~5)、芝麻素(6)、樱黄素(7)、5,7,4-三羟基异黄酮(8)、N-acetyl-tryptamine(9)。对所有化合物进行抗耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)和表皮葡萄球菌(Staphylococcus epidermidis)等致病菌抑制活性研究,结果显示化合物8对表皮葡萄球菌具有一定的抑制作用。
1 材料和方法
1.1 仪器试剂及测试病原菌
ZYJ-S型超净工作台(苏州净化设备公司);中压制备色谱仪(瑞士布奇公司);旋转蒸发仪(Eyelan-1100V-W型,日本东京理化株式会社);高效液相色谱仪(日本日立公司);AVANCE-700超导核磁共振仪(TMS为内标,德国布鲁克公司);葡聚糖凝胶 Sephadex LH-20(法玛西亚公司);薄层色谱及柱色谱用硅胶(青岛海洋化工厂);YMC-Pack ODS-A色谱柱(10 mm×250 mm, 5 μm,日本YMC公司);分析纯化学试剂(广州化学试剂厂和天津富宇精细化工有限公司);色谱纯试剂(美国默克公司)。
耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus),铜绿假单胞菌(P. aeruginosa ATCC9027)和表皮葡萄球菌(S. epidermidis ATCC 12228)等3株测试病原菌购自北京北纳创联生物技术研究院,菌株保藏于广西中醫药大学海洋药物研究院菌种库。
1.2 菌株来源及鉴定
菌株GXMID 02504分离自广西北海涠洲岛采集的鹿角杯形珊瑚(Pocillopora damicornis),菌种保存于广西中医药大学海洋药物研究院北部湾海洋微生物资源库中。利用PCR技术对菌株的18S rDNA进行扩增测序(上海美吉生物医药科技有限公司),通过Blast分析发现其ITS序列与菌株Talaromyces verruculosus AG67(accession No. KJ482652.1)的相似度高达100%,故初步将其鉴定为T. verruculosus GXMID 02504(疣孢篮状菌)。
1.3 菌株的培养
将菌株接种在MB液体培养基中,28℃恒温振荡培养箱中培养3 d,然后将种子液接种至经高压蒸汽灭菌(116℃,20 min)的改良真菌2号液体培养基中(黄豆粉20 g,麦芽糖20 g,甘露醇20 g,葡萄糖10 g,味精5 g,细菌学蛋白胨5 g,酵母膏3 g,海盐20 g,自来水1 L,pH 7.4)中。采用100个1 L锥形瓶(300 mL/瓶)对该菌株进行室温静置培养35 d,共发酵30 L。
1.4 发酵产物的提取分离
发酵结束后,收获发酵液及菌体,加入等体积的乙酸乙酯,用纱布过滤,滤液利用乙酸乙酯反复萃取提取多次至溶液颜色变浅。菌体利用丙酮超声提取3遍经减压蒸馏后得到相应浸膏,将得到的粗浸膏与前者合并得到总浸膏共12 g。将总浸膏用100~200目的硅胶拌样,经中压正相硅胶柱色谱(200~300目正相硅胶)分离,采用梯度洗脱(石油醚/二氯甲烷,100:0~0:100和二氯甲烷/甲醇,100:0~1:1,V/V),对所有收集的流分经TLC色谱分析后合并得到9个流分。根据HPLC-DAD指纹图谱,选取代谢产物较为丰富的流分Fr.6和Fr.8进行分离纯化。Fr.6经半制备高效液相色谱(CH3CN/H2O, 46: 54, 2 mL/min)分离得到化合物8(Rt=13 min, 27 mg)、化合物1(Rt=19 min, 16 mg)和流分Fr.6-1(Rt=9 min, 10 mg)。流分Fr.6-1继续采用半制备高效液相色谱(CH3OH/H2O, 56: 44, 1.5 mL/min)纯化得到化合物9(Rt=12 min, 3mg)和化合物7(Rt=16 min, 1 mg)。流分Fr.8经半制备高效液相色谱(CH3CN/H2O, 45: 55, 2 mL/min) 得到化合物4(Rt=19 min, 26 mg)、化合物5(Rt=24 min, 9 mg)、化合物6(Rt=37 min, 11 mg)及流分Fr.8-4 (Rt=29 min, 25 mg)。流分Fr.8-4继续采用半制备高效液相色谱(CH3OH/H2O, 75: 25, 2 mL/min)纯化得到化合物2 (Rt=22 min, 14 mg)和化合物3(Rt=27 min, 3 mg)。
1.5 抑菌活性实验
1.5.1 滤纸片法筛选抑菌活性化合物
参考文献报道的实验方法[15]。将耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)和表皮葡萄球菌(Staphylococcus epidermidis)3株病原菌分别接种于LB液体培养基(胰蛋白胨0.3 g、酵母膏0.15 g、NaCl 0.15 g、蒸馏水30 mL、pH7.4)中,37 ℃、180 r/min培养4h,取360 μL新鲜菌液加入360 mL LB固体培养基(45℃~55℃,胰蛋白胨3.6 g、酵母膏1.8 g、NaCl 1.8 g、琼脂6.5 g、蒸馏水360 mL、pH7.4)混匀后迅速倒平板。将待测化合物配制成浓度为20 mg/mL的甲醇溶液,氨苄西林(1 mg/mL甲醇溶液)作为阳性对照。分别用移液枪吸取5 μL待测化合物溶液置于直径为6 mm的无菌滤纸片上,待甲醇挥干后,用无菌镊子将滤纸片贴于含有菌液的LB固体培养基上。于37℃恒温培养箱内倒置培养24 h,每12 h观察一次,根据抑菌圈的大小初步判断化合物的抑菌活性。
1.5.2 改良肉汤稀释法测定活性化合物的MIC值
对具抑菌活性的化合物进一步采用改良肉汤稀释法测定MIC值[15]。简言之,采用2倍稀释法将阳性对照(氨苄西林)和待测化合物用DMSO溶解并稀释,其中氨苄西林(1.250~0.0013 mg/mL)和待测化合物(10.00~0.010 mg/mL)均设置11个浓度梯度。向96孔板中加入190 μL含菌的LB液体培养基和10 μL的待测化合物溶液,设置3个平行。于37℃培养12~24 h,使用酶标仪在600 nm处测量各孔的吸光度,每12 h观察一次,对比阳性和阴性对照,培养孔中无细菌生长最小化合物浓度是该化合物的MIC值。
2 结果
2.1 化合物结构鉴定
化合物1:分子式为C25H30O7(442.2);1H NMR(700 MHz, DMSO-d6), δH: 11.09 (1H, br s, 4'-OH), 7.39 (1H, d, J=10.3 Hz, H-1), 6.29 (1H, s, H-5'), 5.89 (1H, d, J=10.3 Hz, H-2), 5.07 (1H, d, J=1.6 Hz, H-7'), 4.63 (1H, td, J=6.5, 1.7 Hz, H-8'), 4.03 (1H, dd, J=8.6, 3.6 Hz, H-7), 3.16 (1H, dd, J=16.0, 4.9 Hz, H-11a), 2.58 (1H, t, J=16.0 Hz, H-11b), 2.20 (1H, m, H-6a), 2.17 (1H, m, H-5), 2.12 (1H, dd, J=14.4, 5.2 Hz, H-9), 1.69 (1H, td, J=14.0, 2.5 Hz, H-6b), 1.44 (3H, d, J=6.5 Hz, H-9'), 1.35 (3H, s, H-12), 1.18 (3H, s, H-15), 1.05 (6H, s, H-13, 14); 13C NMR (175 MHz, DMSO-d6), δC: 203.1(C, C-3), 169.5(C, C-10'), 160.7 (C, C-4'), 159.9 (C, C-6'), 158.1 (CH, C-1), 141.8 (C, C-2'), 126.0 (CH, C-2), 112.2 (C, C-1'), 103.5 (CH, C-5'), 100.6 (C, C-3'), 79.5 (C, C-8), 77.7 (CH, C-8'), 70.2 (CH, C-7), 61.8 (CH, C-7'), 44.1 (C, C-4), 42.0 (CH, C-5), 38.2 (C, C-10), 29.0 (CH2, C-6), 27.6 (CH3, C-15), 27.0 (CH3, C-14), 21.2 (CH3, C-13), 21.1 (CH3, C-12), 20.6 (CH2, C-11), 16.1 (CH3, C-9')。以上数据与文献[16]报道的基本一致, 鉴定为chrodrimanin A。
化合物2:分子式为C27H32O8(484.2);1H NMR(700 MHz, DMSO-d6), δH: 10.97 (1H, s, 4'-OH), 7.16 (1H, d, J=10.3 Hz, H-1), 6.40 (1H, s, H-5'), 6.24 (1H, d, J=1.7 Hz, H-7'), 5.90 (1H, d, J=10.3 Hz, H-2), 5.08 (1H, s, 7-OH), 4.89 (1H, qd, J=6.5, 1.7 Hz, H-8'), 4.01 (1H, J=8.6, 3.6 Hz, H-7), 2.82 (1H, dd, J=15.6, 5.1 Hz, H-11a), 2.66 (1H, t, J=14.3 Hz, H-11b), 2.16 (2H, m, H-6a, H-5), 2.15 (3H, s, H-12'), 2.12 (1H, dd, J=13.7, 5.1 Hz, H-9), 1.67 (1H, td, J=14.1, 2.6 Hz, H-6b), 1.34 (3H, d, J=6.6 Hz, H-9'), 1.31 (3H, s, H-12), 1.19 (3H, s, H-15), 1.06 (3H, s, H-14), 1.04 (3H, s, H-13);13C NMR (175 MHz, DMSO-d6), δC: 203.0(C, C-3), 170.4(C, 7'-OCCH3), 168.5(C, C -10'), 161.0(C, C-4'), 160.1(C, C-6'), 157.3(CH, C-1), 136.5(C, C-2'), 126.2(CH, C-2), 113.2(C, C-1'), 104.9(CH, C-5'), 101.5(C, C-3'), 79.7 (C, C-8), 75.9(CH, C-8'), 70.1(CH, C-7), 63.8 (CH, C-7'), 44.1(C, C-4), 41.8(CH, C-5), 41.6(CH, C-9), 38.2(C, C-10), 27.6(CH2, C-6), 27.0(CH3, C-14), 26.8(CH3, C-15), 21.2(CH3, C-12), 21.1(CH2, C-11), 21.0(CH3, C-13), 20.5(CH3, 7'-OCCH3), 15.9(C-9')。该化合物的波谱数据与文献[17]中的基本一致, 鉴定为chrodrimanin B。
化合物3:分子式为C25H30O6(426.2);1H NMR(700 MHz, DMSO-d6), δH: 11.07 (1H, s, 4'-OH), 7.43 (1H, d, J=10.3 Hz, H-1), 6.20 (1H, s, H-5'), 5.87 (1H, d, J=10.2 Hz, H-2), 5.06 (1H, s, 7-OH), 4.73 (1H, m, H-8'), 4.03 (1H, dd, J =8.4, 2.4 Hz, H-7), 3.09 (1H, dd, J=16.8, 3.3 Hz, H-7'), 2.90 (1H, dd, J =15.4, 5.1 Hz, H-11a), 2.78 (1H, dd, J =16.8, 12.0 Hz, H-7'), 2.46 (1H, t, J=15.4 Hz, H-11b), 2.19 (1H, dd, J=5.2, 2.1 Hz, H-5), 2.18 (1H, m, H-6a), 2.13 (1H, dd, J=13.5, 5.2 Hz, H-9), 1.69 (1H, td, J=14.0, 2.3 Hz, H-6b), 1.46 (3H, d, J=6.3 Hz, H-9'), 1.35 (3H, s, H-12), 1.17 (3H, s, H-15), 1.06 (3H, s, H-14), 1.04 (3H, s, H-13);13C NMR (175 MHz, DMSO-d6), δC: 203.0(C, C-3), 169.7(C, C-10') 161.2(C, C-4'), 159.8(C, C-6'), 158.3(CH, C-1), 140.6(C, C-2'), 125.8(CH, C-2), 111.9(C, C-1'), 102.3(CH, C-5'), 101.3(C, C-3'), 79.3(C, C-8), 74.8(CH, C-8'), 70.0(CH, C-7), 44.0(C, C-4), 42.2(CH, C-5), 41.6(CH, C-9), 38.2(C, C-10), 31.0(CH2, C-7'), 27.6(CH3, C-14), 26.8(CH3, C-15), 26.8(CH2, C-6), 21.8(CH2, C-11), 21.2(CH3, C-13), 20.9(CH3, C-12), 20.6(C-9')。該化合物的波谱数据与文献[18]中的基本一致, 鉴定为chrodrimanin E。
化合物4:分子式为C25H34O6(430.2);1H NMR(700 MHz, DMSO-d6), δH: 11.04 (1H, s, 4'-OH), 6.17 (1H, s, H-5'), 4.72 (1H, s, 7-OH), 4.67 (1H, m, H-8'), 3.90 (1H, dd, H-7), 2.99 (1H, dd, J=16.8, 3.3 Hz, H-7'), 2.74 (1H, dd, J=16.8, 12.1 Hz, H-7'), 2.47 (2H, m, H-11), 2.09 (2H, m, H-6), 1.95 (1H, dd, J=13.6, 5.6 Hz, H-9), 1.58 (2H, m, H-2), 1.54 (2H, m, H-1), 1.44 (3H, d, J=6.3 Hz, H-9'), 1.30 (1H, dd, J=13.5, 4.9 Hz, H-5), 1.18 (3H, s, H-12), 1.11 (3H, s, H-15), 0.88 (3H, s, H-14), 0.74 (3H, s, H-13);13C NMR (175 MHz, DMSO-d6), δC: 169.8(C, C-10'), 161.0(C, C-4'), 159.9(C, C-6'), 140.2(C, C-2'), 112.2(C, C-1'), 102.1(CH, C-5'), 100.9(C, C-3'), 79.7(C, C-8), 76.9(CH, C-3), 74.8(CH, C-8'), 71.1(CH, C-7), 43.5(CH, C-5), 42.8(CH, C-9), 38.9(C, C-4), 35.4(C, C-10), 33.7(CH2, C-1), 30.9(CH2, C-7'), 28.7(CH3, C-14), 28.0(CH2, C-2), 27.6(CH2, C-6), 24.1(CH3, C-15), 21.4(CH3, C-12), 20.5(CH3, C-9'), 19.9(CH2, C-11), 16.1(CH3, C-13)。该化合物的波谱数据与文献[18]中的基本一致, 鉴定为chrodrimanin F。
化合物5:分子式为C25H32O6(428.2);1H NMR(700 MHz, DMSO-d6), δH: 11.05 (1H, s, 4'-OH), 6.23 (1H, s, H-5'), 4.67 (1H, ddd, J=12.1, 6.2, 3.3 Hz, H-8'), 3.85 (1H, t, J=7.6 Hz, H-7), 3.00 (1H, dd, J=16.8, 3.3 Hz, H-7'a), 2.80 (2H, m, H-7'b, H-2), 2.28 (1H, ddd, J=12.3, 9.4, 4.9 Hz, H-6a), 2.05 (1H, m, H-1a), 1.96 (1H , dd, J=12.3, 2.9 Hz, H-5), 1.60 (1H, ddd, J=12.8, 9.4, 4.7 Hz, H-6b), 1.44 (3H, d, J=6.3 Hz, H-9'), 1.38 (1H, td, J=13.8, 7.1 Hz, H-1b), 1.29 (3H, s, H-12), 1.03 (3H, s, H-14), 0.96 (3H, s, H-13), 0.92 (3H, s, H-15);13C NMR (175 MHz, DMSO-d6), δC: 217.3(C, C-3), 169.8(C, C-10'), 161.0(C, C-4'), 159.5(C, C-6'), 140.1(C, C-2'), 111.0(C, C-1'), 101.9(CH, C-5'), 101.0(C, C-3'), 78.5(C, C-8), 74.8(CH, C-8'), 72.3(CH, C-7), 46.2(C, C-4), 42.5(CH, C-5), 40.7(CH, C-9), 35.3(C, C-10), 33.4(CH2, C-2), 31.3(CH2, C-1), 30.8(CH2, C-7'), 28.6(CH3, C-14), 27.9(CH2, C-6), 22.9(CH3, C-12), 22.4(CH3, C-15), 20.5(CH3, C-9'), 19.8(CH3, C-13), 18.8(CH2, C-11)。以上波譜数据与文献[18]中的基本一致, 鉴定为chrodrimanin H。
化合物6:分子式为C20H18O6(354.1);1H NMR(700 MHz, DMSO-d6), δH:6.92(2H, s, H-2, 2'), 6.86(2H, d, J=7.9 Hz, H-5, 5'), 6.83 (2H, d, J=8.0, H-6, 6'), 5.99 (4H, s, H-10, 10'), 4.64 (2H, d, J=4.1 Hz, H-7, 7'), 4.11 (2H, m, H-9e, 9e'), 3.75 (2H, dd, J=9.1, 3.6 Hz, H-9a, 9a'), 2.99 (2H, m, H-8, 8');13C NMR (175 MHz, DMSO-d6), δC: 147.4(C, C-4, 4'), 146.5(C, C-3, 3'), 135.5(C, C-1, 1'), 119.4(CH, C-6, 6'), 108.0(CH, C-5, 5'), 106.6(CH, C-2, 2'), 100.9(CH2, C-10, 10'), 84.8(CH2, C-7, 7'), 71.0(CH, C-9, 9'), 53.8(CH, C-8, 8')。以上波谱数据与文献[19]中的基本一致, 鉴定为芝麻素。
化合物7:分子式为C16H12O5(284.1);1H NMR(700 MHz, DMSO-d6), δH: 8.02 (1H, s, H-2), 7.3 (2H, d, J=8.6 Hz, H-2', 6'), 7.18 (1H, s, H-8), 6.77 (2H, d, J=8.5 Hz, H-3', 5'), 6.37 (1H, s, H-6), 3.78 (3H, s, O-CH3);13C NMR (175 MHz, DMSO-d6), δC:173.6(C, C-4), 156.9(C, C-7), 154.2(C, C-5), 154.3(C, C-4'), 150.7(C, C-9), 150.0(CH, C-2), 130.0(CH, C-2', 6'), 123.7(C, C-1'), 122.4(C, C-3), 114.8(CH, C-3', 5'), 102.7(C, C-10), 101.4(CH, C-8, C-6), 55.3(CH3, 7-OCH3)。以上波譜数据与文献报道[20]基本一致, 鉴定为樱黄素。
化合物8:分子式为C15H10O5(270.1);1H NMR(700 MHz, DMSO-d6), δH: 12.96 (1H, s, 5-OH), 8.29 (1H, s, H-2), 7.38 (2H, d, J=8.6 Hz, H-2', 6'), 6.83 (2H, d, J=8.6 Hz, H-3', 5'), 6.37 (1H, d, J=2.1 Hz, H-8), 6.22 (1H, d, J=2.1 Hz, H-6);13C NMR (175 MHz, DMSO-d6), δC:180.1(C, C-4), 165.0(C, C-7), 162.0(C, C-4'), 157.7(C, C-9), 157.4(C, C-5), 153.8(CH, C-2), 130.2(CH, C-2', 6'), 122.3(C, C-1'), 121.3(C, C-3), 115.1(CH, C-3', 5'), 104.3(C, C-10), 99.2(CH, C-6), 93.8(CH, C-8)。以上波谱数据与文献[21]中基本一致, 鉴定为5, 7, 4'-三羟基异黄酮。
化合物9:分子式为C12H14N2O, 分子量202.1;1H NMR(700 MHz, DMSO-d6), δH: 10.80 (1H, s, 12-NH), 7.93 (1H, s, 1-H), 7.51 (1H, d, J=7.8 Hz, H-4), 7.33 (1H, d, J=8.1 Hz, H-7), 7.14 (1H, d, J=2.2 Hz, H-2), 7.06 (1H, ddd, J=8.1, 6.9, 1.2 Hz, H-6), 6.97 (1H, ddd, J=7.9, 6.9, 1.0 Hz, H-5), 3.31 (2H, m, H-11), 2.81 (2H, m, H-10), 1.80 (3H, s, CH3-14);13C NMR (175 MHz, DMSO-d6), δC: 169.0(C, C-13), 136.2(C, C-8), 127.2(C, C-9), 122.6(CH, C-6), 120.9(CH, C-5), 118.2(CH, C-4), 111.9(C, C-3), 111.3(CH, C-7), 40.0(CH2, C-11), 25.2(CH2, C-10), 22.7(CH3, C-14)。以上波谱数据与文献[22]报道基本一致, 鉴定为N-acetyl-tryptamine。
2.2 化合物抑菌活性结果分析
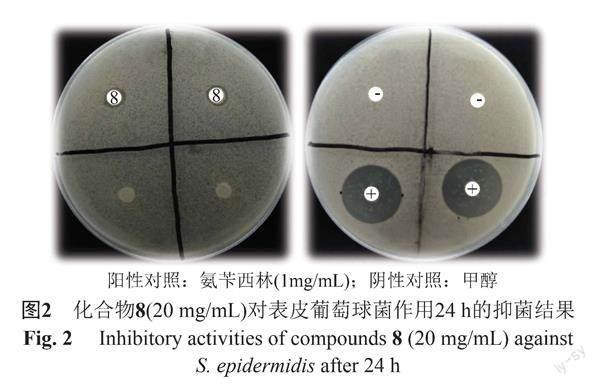
滤纸片琼脂扩散法筛选抑菌活性化合物的结果如图2所示,化合物8对表皮葡萄球菌具有弱抑制作用。用改良肉汤稀释法测定其MIC值,结果显示,化合物8的最小抑菌浓度值为78 μg/mL,阳性对照氨苄西林的MIC值为2.5 μg/mL。与化合物8相比,化合物7没有显示出抗菌活性,说明化合物8中的7位羟基有利于提高其抗菌活性。
3 讨论
本文从广西北海涠洲岛珊瑚来源的真菌Talaromyces verruculosus GXMID 02504中分离到5个混源萜类化合物(1~5)、1个苯丙素类化合物(6)、2个黄酮类化合物(7~8)和1个吲哚生物碱(9),化合物6~8为首次从该属中分离得到,并测试了抗病原菌活性,其中化合物8对表皮葡萄球菌具有弱抑制作用,7位羟基有利于提高其抗菌活性,黄酮类化合物7和8可能来自添加黄豆粉的改良真菌2号液体培养基。Chrodrimanins类化合物属于由C10聚酮单元和倍半萜部分组成的混源萜类结构,文献报道化合物2~4对甲型流感病毒(H1N1)具有抑制活性,其IC50值分别为21, 55和57 μmol/L[23]。另外,化合物2对家蚕幼虫(Bombyx mori)具有毒杀活性,LD50值(半数致死量)为10 mg/g[24]。本研究丰富了该菌次级代谢产物的结构多样性,也为进一步发现抗菌化学成分提供了参考。
参 考 文 献
徐新亚, 杨宏, 宁小清, 等. 北部湾海洋微生物物种多样性与化学多样性研究进展[J]. 广西科学, 2020, 27(5): 433-450.
刘佳璐. 珊瑚共生微生物的研究进展分析[J]. 南方农业, 2020, 14(15): 141-143.
周进, 晋慧, 蔡中华. 微生物在珊瑚礁生态系统中的作用与功能[J]. 应用生态学报, 2014, 25(3): 919-930.
Hou X M, Xu R F, Gu Y C, et al. Biological and chemical diversity of coral-derived microorganisms[J]. Curr Med Chem, 2015, 22(32): 3707-3762.
Sang V T , Dat T T H, Vinh L B, et al. Coral and coral-associated microorganisms: Aprolific source of potential bioactive natural products[J]. Mar Drugs, 2019, 17(8): 468.
A L H, B R T, A F L, et al. Draft genome sequence of Talaromyces verruculosus ("Penicillium verruculosum") strain TS63-9, a fungus with great potential for industrial production of polysaccharide-degrading enzymes[J]. J Biotechnol, 2016, 219: 5-6.
Devi S S, Sreenivasulu Y, Rao K V B. Talaromyces verruculosus, anovel marine fungi as a potent polyhydroxybutyrate degrader[J]. Res J Pharm Technol, 2014, 7(4): 433-438.
Wang M, Yang L, Feng L, et al. Verruculosins A-B, new oligophenalenone dimers from the soft coral-derived fungus Talaromyces verruculosus[J]. Mar Drugs, 2019, 17(9): 516.
Goyari S, Devi S H, Bengyella L, et al. Unveiling the optimal parameters for cellulolytic characteristics of Talaromyces verruculosus SGMNPf3 and its secretory enzymes[J]. J Appl Microbiol, 2015, 119(1): 88-98.
Oduro-Mensah D, Ocloo A, Lowor S T, et al. Isolation and characterisation of theobromine-degrading filamentous fungi[J]. Microbiol Res, 2018, 206: 16-24.
Mitsuhashi T, Rinkel J, Okada M, et al. Mechanistic characterization of two chimeric sesterterpene synthases from Penicillium[J]. Chem-A Europ J, 2017, 23(42): 10053-10057.
Miao F, Yang R, Chen D D, et al. Isolation, identification and antimicrobial activities of two secondary metabolites of Talaromyces verruculosus[J]. Molecules, 2012, 17(12): 14091.
Chen C M, Chen W H, Tao H M, et al. Diversified polyketides and nitrogenous compounds from the mangrove endophytic fungus Penicillium steckii SCSIO 41025[J]. Chin J Chem, 2021, 39(8): 2132-2140.
Luo X W, Gao C H, Lu H M, et al. HPLC-DAD-guided isolation of diversified chaetoglobosins from the coral-associated fungus Chaetomium globosum C2F17[J]. Molecules, 2020, 25(5): 1237.
陳春梅, 罗小卫, 李坤龙, 等. 一株海绵共附生真菌Fusarium equiseti SCSIO 41019的次级代谢产物及其抑菌活性研究[J]. 中国抗生素杂志, 2019, 44(9): 1035-1040.
Guo J, Ran H, Zeng J, et al. Tafuketide, a phylogeny-guided discovery of a new polyketide from Talaromyces funiculosus Salicorn 58[J]. Appl Microbiol Biotechnol, 2016, 100(12): 5323-5338.
刘德胜, 黄玉玲, 马丽英, 等. 微紫青霉菌次级代谢产物的化学成分和细胞毒活性[J]. 中成药, 2016, 38(4): 830-834.
Hayashi H, Oka Y, Kai K, et al. New chrodrimanin congeners, chrodrimanins D-H, from YO-2 of Talaromyces sp.[J]. Biosc Biotechnol Biochem, 2012, 76(9): 1765-1768.
张羡媛, 李贺然. 刺五加根的抗炎活性成分研究[J]. 中国医药导报, 2016, 13(13): 20-23.
李丽梅, 娄洁, 刘贵有, 等. 玫瑰花中的异黄酮类化合物及其活性研究[J]. 中草药, 2015, 46(10): 1420-1422.
任风芝, 张丽, 牛桂云, 等. 海风藤的化学成分研究(Ⅰ)[J]. 中草药, 2005, (2): 184-185.
Oleinikova G K, Ivchuk O I, Denisenko V A, et al. Indolic metabolites from the new marine bacterium Roseivirga echinicomitans KMM 6058 T[J]. Chem Nat Comp, 2006, 42(6): 713-717.
Zhou H, Li L, Wang W, et al. Chrodrimanins I and J from the antarctic moss-derived fungus Penicillium funiculosum GWT2-24[J]. J Nat Prod, 2015, 78(6): 1442-1445.
Hayashi H, Oka Y, Kai K, et al. A new meroterpenoid, chrodrimanin C, from YO-2 of Talaromyces sp.[J]. Biosc Biotechnol Biochem, 2012, 76(4): 745-748.
收稿日期:2021-08-12
基金項目:广西自然科学基金-创新研究团队项目(No. 2020GXNSFGA297002);广西科技基地和人才专项(No. 桂科AD19110013);广西
高校中青年教师科研基础能力提升项目(No. 2021KY0315);广西中医药大学校级科研项目(No. 2020QN025)
作者简介:张艳婷,女,生于1997年,在读硕士研究生,研究方向为海洋微生物活性次级代谢产物,E-mail: ting9097@163.com
*通讯作者,E-mail: luoxiaowei1991@126.com
