LL-37对COPD模型大鼠Th17/Treg平衡及炎症反应的调节作用
2022-05-30李琳刘菊王爱利肖方喜戴朝博李秀娟
李琳?刘菊?王爱利?肖方喜?戴朝博?李秀娟
摘要:目的 觀察人源抗菌肽LL-37对慢性阻塞性肺疾病(COPD)大鼠辅助性T细胞17(Th17)/调节性T细胞(Treg)平衡、炎症反应的影响,并探讨可能机制。方法 40只Wistar大鼠随机分为正常组、COPD组、LL-37组、LL-37联合DAPT(Notch1/Jagged1信号通路抑制剂)组。正常组室温下正常喂养,COPD组、LL-37组、LL-37联合DAPT组采用烟熏法建立COPD模型。LL-37组大鼠经鼻滴入LL-37(10 μg) 50 μL,LL-37联合DAPT组大鼠经鼻滴入总体积50 μL的LL-37(10 μg)+DAPT(10 μg)。正常组、COPD组大鼠分别经鼻滴入等体积的生理盐水。检测外周血Th17、Treg细胞占比;检测肺泡灌洗液(BALF)中白介素-8(IL-8)、白三烯B4(LTB4)含量;HE染色检测气道重塑指标;Western Blot法检测肺组织Notch1、Jagged1、发状分裂相关增强子1(Hes1)蛋白表达量。结果 与COPD组比较,LL-37组外周血Th17占比和Th17/Treg、BALF中IL-8、LTB4含量、管壁厚度/外径(MT%)及管壁面积/气管总面积(MA%)均降低,Treg占比升高(P<0.05);与LL-37组比较,LL-37联合DAPT组外周血Th17占比和Th17/Treg、BALF中IL-8、LTB4含量、MT%及MA%均升高,Treg占比降低(P<0.05)。与COPD组比较,LL-37组Notch1、Jagged1、Hes1蛋白表达量升高(P<0.05);与LL-37组比较,LL-37联合DAPT组Notch1、Jagged1、Hes1蛋白表达量降低(P<0.05)。结论 人源抗菌肽LL-37可调节COPD大鼠外周血Th17/Treg失衡,抑制炎症反应及气道重塑,激活Notch1/Jagged1信号通路可能是其发挥治疗作用的机制之一。
关键词:慢性阻塞性肺疾病;人源抗菌肽LL-37;辅助性T细胞17;调节性T细胞
中图分类号:R563文献标志码:A
Effect of human antimicrobial peptide LL-37 on Th17/Treg balance and inflammatory reaction in COPD rats
Li Lin, Liu Ju, Wang Ai-li, Xiao Fang-xi, Dai Chao-bo, and Li Xiu-juan
(Wuhan No.1 Hospital, Wuhan 430022)
Abstract Objective To observe the effect of human antimicrobial peptide LL-37 on the balance of T helper 17 (Th17)/regulatory T cells (Treg) and inflammatory response in chronic obstructive pulmonary disease (COPD) rats, and to explore the possible mechanism. Methods Forty Wistar rats were randomly divided into normal group, the COPD group, the LL-37 group, and the LL-37 combined with DAPT (Notch1/Jagged1 signaling pathway inhibitor) group. The normal group was fed normally at room temperature, and the COPD group, the LL-37 group, and the LL-37 combined with DAPT group were treated using the smoking method to establish the COPD model. Rats in the LL-37 group were injected with 50 μL of LL-37 (10 μg) by nasal instillation, while rats in the LL-37 combined with DAPT group were injected with 50 μL of LL-37 (10 μg) + DAPT (10 μg) by nasal instillation. Rats in the normal group and the COPD group were instilled with an equal volume of normal saline through the nose. The proportion of Th17 and Treg cells in peripheral blood was detected; the contents of interleukin-8 (IL-8) and leukotriene B4 (LTB4) in bronchoalveolar lavage fluid (BALF) were detected; HE staining was used to detect airway remodeling indexes. Western blot was used to detect expressions of Notch1, Jagged1, and hairy division-related enhancer 1 (Hes1) proteins in lung tissue. Results Compared with the COPD group, the proportion of Th17 in peripheral blood, Th17/Treg, IL-8, LTB4 content in BALF, wall thickness/outer diameter (MT%), and wall area/trachea total area (MA%) in the LL-37 group both decreased, and the proportion of Treg increased (P<0.05). Compared with the LL-37 group, peripheral blood Th17 proportion, Th17/Treg, IL-8, LTB4 content in BALF, MT%, and MA% increased in the LL-37 combined with DAPT group, and the proportion of Treg decreased (P<0.05). Compared with the COPD group, the protein expressions of Notch1, Jagged1, and Hes1 in the LL-37 group increased (P<0.05); compared with the LL-37 group, the protein expressions of Notch1, Jagged1, and Hes1 in the LL-37 combined with DAPT group decreased (P<0.05). Conclusion Human antimicrobial peptide LL-37 can regulate the imbalance of Th17/Treg in peripheral blood of COPD rats. Inhibition of the inflammatory response and airway remodeling and activation of the Notch1/Jagged1 signaling pathway may be one of the mechanisms for its therapeutic effect.
Key words Chronic obstructive pulmonary disease; Human antimicrobial peptide LL-37; Helper T cell 17; Regulatory T cell
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续性、不完全可逆气流受限为主要特征的肺部炎症性疾病,在全球死因中位居第四,且发病率呈上升趋势[1]。克拉霉素、罗红霉素、阿奇霉素等大环内酯类抗生素是治疗COPD的常用抗生素,可抑制细菌定植于气道,阻滞病情发展,但不良反应较多,且易产生耐药性[2]。LL-37是cathelicidin肽Hcap-18的C末端切割产物,是一种由机体免疫防御体系生成的抗菌肽,能直接杀死细菌、真菌和病毒。LL-37还可以通过趋化免疫细胞、调节炎性促进因子/抑制因子的分泌、协调天然免疫和获得性免疫等功能,发挥免疫调节作用。LL-37可作用于血管内皮细胞和上皮细胞,刺激血管生成和促进损伤修复。LL-37具有广谱抗菌、减轻炎症反应的作用,且不易导致耐药性,可能成为有潜力的新型抗菌药物[3]。有国外学者将LL-37应用于大鼠脓毒症模型的治疗,结果显示其可通过抑制巨噬细胞调亡、刺激中性粒细胞释放抗菌微泡来改善脓毒症病情、提高大鼠存活率,表明其具有抗菌和抑炎作用[4]。然而,目前对人源LL-37治疗COPD的体内研究尚少。鉴于此,本研究通过建立COPD大鼠模型,并采用人源LL-37干预,观察其对该疾病模型的治療效果,以期为临床应用提供实验基础。
1 材料与方法
1.1 实验动物
SPF级Wistar大鼠40只,雄性,6周龄,体质量(190±20) g,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。
1.2 药物、主要试剂、仪器
人源抗菌肽LL-37(规格5 mg,批号53017ES08)购自翌圣生物科技股份有限公司;Notch1/Jagged1信号通路抑制剂DAPT(规格10 mg,批ab120633),购自美国Abcam公司;白介素-8(Interleukin8,IL-80)酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒(规格96T,批号LB3051B)、白三烯B4(leukotriene B4,LTB4)ELISA试剂盒(规格96T, 批号LB3107B),购自武汉力博瑞生物科技有限公司;HE染色试剂盒(规格3×10 mL,批号G1120-10),购自北京Solarbio科技有限公司;兔抗鼠一抗CD4+(规格50 mL,批号bs-0647R)、白介素-17(interleukin-17,IL-17)(规格50 mL,批号bs1183R),购自北京博奥森生物技术有限公司;叉状头/翅膀状螺旋转录因子(forkhead/winged helix transcription factor,Foxp3)(规格10 mL,批号ab215206)、Notch1(规格10 mL,批号ab52627)、Jagged1(规格10 mL,批号ab109536)、发状分裂相关增强子1(hairy and enhancer of split 1,Hes1)(规格10 mL ,批号ab108937)、GADPH(规格10 mL,批号ab181602),购自美国Abcam公司;辣根过氧化物酶标记山羊抗兔二抗IgG(H+L)(规格1 mL,批号A0208),购自上海碧云天生物技术有限公司。
大鼠烟熏箱(上海玉研科学仪器有限公司);Accuri C6流式细胞仪(美国BD公司);酶标GENios Pro仪(瑞士Tecan公司)。
1.3 构建COPD模型[5-6]
40只Wistar大鼠随机分为正常组、COPD组、LL-37组、LL-37联合DAPT组,每组各10只。经烟熏法建模,将大鼠置入烟熏箱,每次放进10只点燃的香烟,持续烟熏30 min,3 次/d,连续90 d。正常组室温下正常喂养。以实验结束后HE染色结果出现COPD病理变化为建模成功标准。
1.4 干预方式
烟熏完成后次日,LL-37组大鼠经鼻滴入LL-37(10 μg) 溶解液50 μL,LL-37联合DAPT组大鼠经鼻滴入总体积50 μL的LL-37(10 μg)+DAPT(10 μg),正常组、COPD组大鼠经鼻滴入50 μL生理盐水,1次/d,干预2周。
1.5 组织取材
末次干预后4 h颈椎脱臼处死大鼠,开胸,手术线结扎、固定右肺;左肺经37℃生理盐水2 mL灌洗左肺3次,回收后(回收率>80%)离心收集肺泡灌洗液(bronchoalveolar lavage fluid,BALF)上清,冷冻保存备用;取右肺上叶,PBS冲洗干净,留取右肺门组织块(1 mm3),固定于4%多聚甲醛中24 h,顺垂直支气管走向最大横径位置切取厚度4 mm的组织,酒精梯度脱水、透明和包埋,切片机切片。其余右肺组织冷冻保存,用于Western blot检测蛋白。
1.6 检测外周血辅助性T细胞17(T helper cell 17,Th17)、调节性T细胞(regulatory T cell,Treg)占比
末次给药后,给予戊巴比妥钠麻醉,采集腹主动脉血5 mL置于抗凝管,分离淋巴细胞,取96孔板,加入细胞悬液100 μL/孔,加入刺激剂0.5 μL/孔,培养60 min,阻断剂0.5 μL阻断,5% CO2、37℃、饱和湿度下孵育12 h;将细胞悬液转移至流式管中,加入CD4抗体0.5 μL,常温遮光孵育20 min,洗涤后,加入PBS重悬,加入固定破膜工作液,振荡5 s混合均匀,4℃遮光孵育40 min,加入破膜缓冲工作液2 mL,离心后洗涤细胞,弃上清,加入PBS重悬,分别在测定管中加入IL-17抗体0.7 μL、Foxp3抗体5 μL,将等量、同型对照抗体加入对照管中,4℃遮光孵育40 min,洗涤后弃上清,加入4%多聚甲醛重悬,4℃遮光保存,24 h内使用流式细胞仪检测Th17、Treg细胞占比。
1.7 检测BALF中IL-8、LTB4含量
取冷冻保存BALF,采用ELISA法检测IL-8、LTB4含量,严格按照试剂盒说明书设计实验操作步骤,经酶标仪检测570 nm波长位置吸光度值,根据标准曲线计算IL-8、LTB4含量。
1.8 HE染色检测气道重塑指标、观察肺组织病理学改变
取肺组织切片,常规脱蜡、HE染色,中性树胶封片。每张切片随机选取5个不相邻视野,数码相机拍照,测量直径750~1100 μm,长径/短径≥0.7 μm的膜性细支气管管壁厚度、外径、面积,气管总面积,计算管壁厚度/外径(MT%),管壁面积/气管总面积(MA%);光学显微镜下观察肺组织病理学改变。
1.9 Western blot法检测肺组织Notch1、Jagged1、Hes1蛋白表达量
取40 μg待测样本按比例混合上样缓冲液,电泳分离,湿转至膜,5%脱脂牛奶封闭2 h,加入兔抗大鼠Notch1、Jagged1、Hes1一抗孵育过夜,加入二抗室温孵育2 h后,暗室曝光,计算目的蛋白/内参GAPDH条带灰度值。
1.10 统计学分析
采用IBM SPSS 22.0统计学软件分析数据,计量资料以均数±标准差(x±s)表示,以单因素方差分析检验,两两比较采用LSD-t检验。P<0.05表明差异具有统计学意义。
2 结果
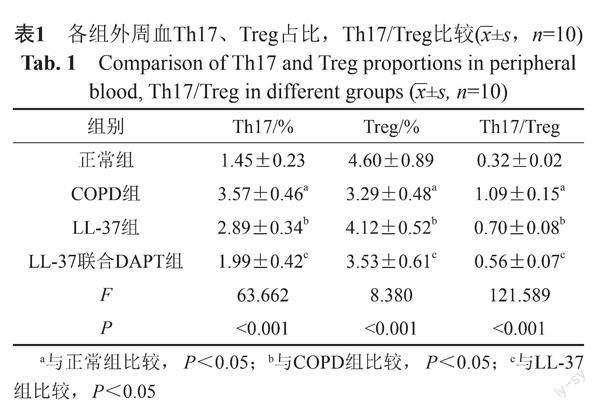
2.1 外周血Th17/Treg平衡
与正常组比较,COPD组外周血Th17占比、Th17/Treg升高,Treg占比降低(P<0.05);与COPD组比较,LL-37组外周血Th17占比、Th17/Treg降低,Treg占比升高(P<0.05);与LL-37组比较,LL-37联合DAPT组外周血Th17占比、Th17/Treg升高,Treg占比降低(P<0.05)。见表1。
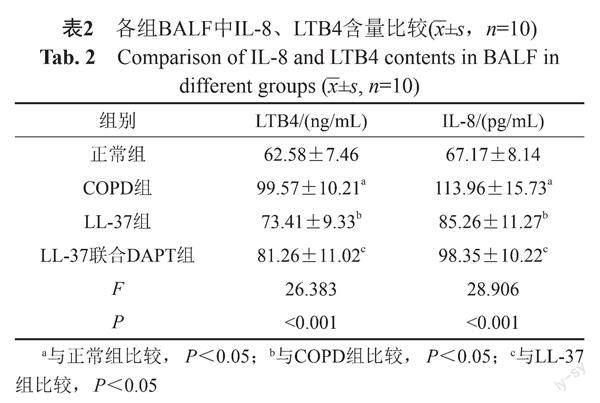
2.2 BALF中IL-8、LTB4含量比较
与正常组比较,COPD组BALF中IL-8、LTB4含量升高(P<0.05);与COPD组比较,LL-37组BALF中IL-8、LTB4含量降低(P<0.05);与LL-37组比较,LL-37联合DAPT组BALF中IL-8、LTB4含量升高(P<0.05)。见表2。
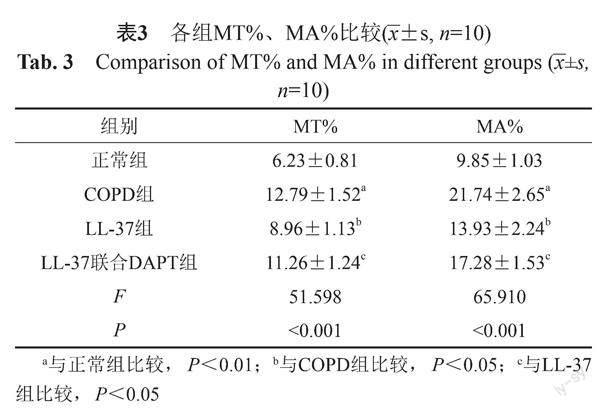
2.3 MT%和MA%比较
与正常组比较,COPD组MT%、MA%升高(P<0.05);与COPD组比较,LL-37组MT%、MA%降低(P<0.05);与LL-37组比较,LL-37联合DAPT组MT%、MA%升高(P<0.05),见表3。
2.4 肺组织病理学改变
正常组肺组织形态正常,无支气管黏膜上皮变形或脱落,未观察到腺体增生、炎性细胞聚集;模型组支气管黏膜上皮细胞大量脱落、增生(黑色箭头),大量炎性细胞浸润(蓝色箭头),血管壁增厚(红色箭头),肺泡间隔增加,气腔壁厚度明显增加,部分肺泡发生融合、扩张;LL-37组有少量支气管上皮细胞脱落(黑色箭头),血管周围聚集有少量炎性细胞,相较于模型组肺泡间隔及气腔壁厚度减少,病理学变化有所减轻;LL-37联合DAPT组支气管黏膜上皮细胞脱落、增生(黑色箭头),有炎性细胞浸润(蓝色箭头),血管壁增厚(红色箭头),相较于模型组病理学变化有所减轻,相较于LL-37组有所加重。见图1。
2.5 肺组织Notch1、Jagged1、Hes1蛋白表达量
与正常组比较,COPD组肺组织Notch1、Jagged1、Hes1蛋白表达量降低(P<0.05);与COPD组比较,LL-37组Notch1、Jagged1、Hes1蛋白表达量升高(P<0.05);与LL-37组比较,LL-37联合DAPT组Notch1、Jagged1、Hes1蛋白表达量降低(P<0.05)。见表4和图2。
3 讨论
目前关于COPD的发病机制众说纷纭,多认为与氧化应激、固有免疫、炎症介质、弹力蛋白酶/抗弹力蛋白酶失衡等有关[7]。Th17细胞主要通过释放炎性因子IL-17介导免疫应答,通过募集、活化中性粒细胞增高气道反应性,改变肺组织弹性。Treg细胞可抑制抗原提呈细胞及T细胞功能,减少炎性细胞因子及抗体产生,从而维持自身免疫耐受及免疫内环境平衡。Th17/Treg失衡引发的免疫抑制或应答过度是COPD重要的免疫学发病机制之一[8]。气道重塑是COPD病理特征之一,与炎症介质LTB4、IL-8等的释放关系密切,且是导致气道管腔狭窄、气流受限、肺功能进行性下降的主要病理改变[9]。因此,探究有效的免疫调节、抗炎、气道重塑抑制药物及相关分子靶点对于改善COPD治疗效果具有重大意义。
而LL-37属cathelicidins家族,通常由上皮细胞与中性粒细胞分泌,其活性有赖于螺旋构象的分子结构,其作为一类多功能小分子抗菌肽,已被证实具有抗寄生虫、抗病毒、抗真菌、抗肿瘤和免疫调节功能等多种生物作用[10-11]。此外,LL-37可通过结合CD14与脂多糖中和内毒素,并募集免疫细胞至感染部位以杀灭病原菌。研究发现LL-37应用于COPD的治疗可在抗菌的同时调节机体免疫功能、抑制細菌与宿主介导的促炎因子分泌[12]。本研究结果显示,与COPD组比较,LL-37组外周血Th17占比、Th17/Treg,BALF中IL-8、LTB4含量,MT%和MA%降低,Treg占比升高,提示LL-37可维持外周血Th17/Treg平衡,减轻炎症反应及气道重塑。Tatsuta等[13]研究也发现,LL-37可抵消香烟烟雾提取物诱导的跨上皮电阻降低,并防止occludin和ZO-1被破坏,从而减轻气道上皮屏障功能障碍,对哮喘和COPD等呼吸系统疾病具有显著益处,本研究结果与其具有相似性。
进一步探讨LL-37引起COPD改变的分子机制,其中我们重点检测Notch通路在COPD中的变化,目前发现Notch通路在决定器官形成与形态过程中起重要作用,其成员之一Notch1通过与相邻细胞的表面配体Jagged1相互作用参与细胞分化、发育、调控,并激活下游碱性-螺旋-环-螺旋转录抑制因子Hes1,发挥生物学效应[14]。此外,Notch受体及配体表达于T细胞、巨噬细胞、抗原提呈细胞等多种成熟免疫细胞的表面,参与调节机体免疫功能[15]。Notch受体被激活后可促使淋巴前体细胞分化为T淋巴细胞,通过调节T淋巴细胞活性抑制其凋亡,从而影响机体免疫功能[16]。近年来研究发现[17],Notch1/Jagged1信号通路与肺动脉高压、肺间质病变、COPD、哮喘和肺癌等呼吸系统疾病的发生与发展,激活或阻断该途径可对其病理变化、预后造成明显影响。Wu等[18]认为,相较于正常大鼠,COPD模型大鼠肺组织中Notch1及其靶基因的表达受到明显抑制,且采用异硫氰酸烯丙酯干预后大鼠肺功能得以明显改善,且可能依赖于Notch1信号通路,提示靶向Notch1信号通路可能是治疗COPD的有效策略。此外,已有研究发现白藜芦醇可能通过激活Notch1信号通路介导的自噬部分挽救香烟烟雾或Notch1 siRNA诱导的COPD肺内皮细胞凋亡,发挥治疗作用[19]。本研究中,与COPD组比较,LL-37组Notch1、Jagged1和Hes1蛋白表达量升高,且在LL-37干预COPD的基础上联合Notch1/Jagged1信号通路抑制剂DAPT将减弱LL-37对COPD的治疗作用,提示该信号通路可能是LL-37发挥作用的通路之一。然而,也有学者认为Notch信号通路在COPD中被过度激活,Th1/Th2介导的促炎免疫是主要发病机制[20]。免疫应答及炎症反应均是复杂的病理、生理过程,COPD病情严重程度不同,通路被激活、抑制的状态也不同。因此,在今后研究中需对该通路在COPD中的表达情况进行进一步验证:使用Notch1/Jagged1信号通路激动剂对LL-37的作用通路进行正向验证;探寻有效的COPD模型严重程度分级标准,分层次研究通路表达情况;对该通路蛋白之间的相互作用进行深入研究,明确上下游基因关系,为临床提供更为准确的实验依据。
综上所述,人源抗菌肽LL-37可调节COPD大鼠外周血Th17/Treg失衡,抑制炎症反应及气道重塑,激活Notch1/Jagged1信号通路可能是其发挥治疗作用的机制之一。
参 考 文 献
Maselli D J, Bhatt S P, Anzueto A, et al. Clinical epidemiology of COPD: Insights from 10 years of the COPD gene study[J]. Chest, 2019, 156(2): 228-238.
Hillas G, Papaporfyriou A, Dimakou K, et al. Pharmacological treatment of stable COPD: Need for a simplified approach[J]. Postgrad Med, 2020, 132(2): 126-131.
Engelberg Y, Landau M. The Human LL-37(17-29) antimicrobial peptide reveals a functional supramolecular structure[J]. Nat Commun, 2020, 11(1): 3894-3903.
Nagaoka I, Tamura H, Reich J. Therapeutic potential of cathelicidin peptide LL-37, an antimicrobial agent, in a murine sepsis model[J]. Int J Mol Sci, 2020, 21(17): 5973-5988.
王戈. 阿托伐他汀对烟熏慢性阻塞性肺病大鼠肺组织内质网应激和炎症的影响[J]. 河北医药, 2019, 41(10): 64-67.
赵媚, 许光兰, 李娇, 等. 通肺化痰汤对慢性阻塞性肺疾病急性加重期痰浊瘀阻证大鼠气道炎症因子影响研究[J]. 辽宁中医药大学学报, 2020, 22(5): 9-12.
Cho W K, Lee C G, Kim L K. COPD as a disease of immunosenescence[J]. Yonsei Med J, 2019, 60(5): 407-413.
Cervilha D A B, Ito J T, Louren?o J D, et al. The Th17/Treg cytokine imbalance in chronic obstructive pulmonary disease exacerbation in an animal model of cigarette smoke exposure and lipopolysaccharide challenge association[J]. Sci Rep, 2019, 9(1): 1921-1933.
Stanford D, Kim H, Bodduluri S, et al. Airway remodeling in ferrets with cigarette smoke induced COPD using ?CT imaging[J]. Am J Physiol Lung Cell Mol Physiol, 2020, 6(1): L11-20.
Pahar B, Madonna S, Das A, et al. Immunomodulatory role of the antimicrobial LL-37 peptide in autoimmune diseases and viral infections[J]. Vaccines (Basel), 2020, 8(3): 517-518.
Aidoukovitch A, Dahl S, F?lt F, et al. Antimicrobial peptide LL-37 and its pro-form, hCAP18, in desquamated epithelial cells of human whole saliva[J]. Eur J Oral Sci, 2020, 128(1): 1-6.
楊翼萌, 张洪胜, 孙铁英. 慢性阻塞性肺疾病与支气管哮喘患者血浆抗菌肽LL-37水平的比较[J]. 国际呼吸杂志, 2020, 40(8): 561-565.
Tatsuta M, Kan O K, Ishii Y, et al. Effects of cigarette smoke on barrier function and tight junction proteins in the bronchial epithelium: protective role of cathelicidin LL-37[J]. Respir Res, 2019, 20(1): 251-264.
Wu H, Li X, Zhou C, et al. Circulating mature dendritic cells homing to the thymus promote thymic epithelial cells involution via the Jagged1/Notch3 axis[J]. Cell Death Discovery, 2021, 7(1): 225-226.
Magee C N, Murakami N, Borges T J, et al. Notch-1 inhibition promotes immune regulation in transplantation via regulatory T cell-dependent mechanisms[J]. Circulation. 2019, 140(10): 846-863.
Sodsai P, Klinchanhom S, Hirankarn N, et al. Notch signaling regulates function of human mucosal-associated invariant T (MAIT) cells[J]. Asian Pac J Allergy Immunol, 2021, 10(15): 35-36.
Kiyokawa H, Morimoto M. Notch signaling in the mammalian respiratory system, specifically the trachea and lungs, in development, homeostasis, regeneration, and disease[J]. Dev Growth Differ, 2020, 62(1): 67-79.
Wu J, Wang X, Yao Z, et al. Allyl isothiocyanate may reverse the expression of MRP1 in COPD rats via the Notch1 signaling pathway[J]. Arch Pharm Res, 2019, 42(11): 1000-1011.
Zong D D, Liu X M, Li J H, et al. Resveratrol attenuates cigarette smoke induced endothelial apoptosis by activating Notch1 signaling mediated autophagy[J]. Respir Res, 2021, 22(1): 22-24.
张玲, 徐宛玲, 崔明辰, 等. 大豆肽下调Notch 1信号通路抑制哮喘大鼠气道炎症反应[J]. 现代预防医学, 2019, 46(9): 128-132.
收稿日期:2021-08-25
基金项目:武汉市卫健委科研项目(No. WX20D25)
作者简介:李琳,女,生于1988年,硕士,住院醫师,主要研究方向为老年内科疾病,E-mail: lilin_198808@163.com
*通讯作者,E-mail: liuju1973@126.com
