左氧氟沙星不同注射时间治疗实验动物鼠疫疗效观察
2022-05-30张琪何建杨晓艳辛有全靳娟李胜熊浩明杨建国代瑞霞
张琪?何建?杨晓艳?辛有全?靳娟?李胜?熊浩明?杨建国?代瑞霞
摘要:目的 观察左氧氟沙星不同注射时间治疗实验动物鼠疫的疗效。方法 参照《中国药典》成人剂量,用施新猷动物折算系数法计算豚鼠每日所需注射剂量。实验设立24 h治疗组和48 h治疗组及对照组,每组10只豚鼠。30只实验豚鼠均于鼠鼷部皮下注射菌量为1×107 cfu/mL鼠疫菌141株,24 h治疗组和48 h治疗组分别于染毒后24 h和48 h开始注射左氧氟沙星进行治疗,12 mg/d,
1日1次,连续治疗9日再观察9日。结果 左氧氟沙星24 h、48 h治疗组治愈率分别为100%和70%,对照组动物全死亡。结论 左氧氟沙星治疗实验动物鼠疫疗效显著,可用于鼠疫临床一线治疗。
关键词:鼠疫;左氧氟沙星;治疗;豚鼠;疗效观察
中图分类号:R978.1文献标志码:A
Effect of levofloxacin injection time on plague in experimental animals
Zhang Qi1, He Jian1, Yang Xiao-yan1, Xin You-quan1, Jin Juan1, Li Sheng1, Xiong Hao-ming2,
Yang Jian-guo2, and Dai Rui-xia1
(1 Specialized Laboratory of Yersinia pestis, Qinghai Institute for Endemic Disease Prevention and Control, Xi'ning 811602;
2 Department of Plague, Qinghai Institute for Endemic Disease Prevention and Control, Xi'ning 811602)
Abstract Objective To observe the efficacy of levofloxacin in the treatment of experimental plague in guinea pigs. Methods According to China pharmacopoeia, the daily dose of levofloxacin were converted into the guinea pig dose by using the method of Shixinyou animal conversion coefficient. A 24 h treatment group, a 48 h treatment group, and a control group were set up, with 10 guinea pigs in each group. Thirty guinea pigs were injected subcutaneously with 141 strains of Yersinia pestis of 1×107 cfu/mL on the mouse surface. Levofloxacin was injected 12 mg/d at 24 h
and 48 h in the treatment group, respectively, once a day for nine consecutive days and nine days of observation. Results The cure rates of levofloxacin in 24 h and 48 h treatment groups were 100% and 70%, respectively, and all the animals in control group died. Conclusion Levofloxacin has a significant therapeutic effect on plague in experimental animals and can be used in the first-line clinical treatment of plague.
Key words Plague; Levofloxacin; Treatment; Guinea pigs; Clinical observation on
鼠疫(Plague)是由鼠疫耶爾森菌(Yersinia pestis, Y. pestis)引起的一种自然疫源性传染病,发病急、传染性强且该传染病死率极高,属国际检疫传染病,是我国《中国传染病防治法》第三条中规定的甲类传染病之一。历史上曾有过多次鼠疫大流行,感染者死亡总人数接近2亿[1]。随着青霉素及其他抗生素的广泛应用,鼠疫全球性的大流行再未出现,也未造成病例的大量死亡[2]。但是最近几年鼠疫卷土重来,其中比较严重的2017年非洲马达加斯加鼠疫疫情,确诊病例超过了2600例,超过半数病例为肺鼠疫[3]。我国自进入21世纪后,鼠疫疫情呈现局灶性与散发性分布,多发于西北部的青海省和西藏自治区,主要由于青壮年主动进入鼠疫疫区或者接触了患有鼠疫的宿主动物,因此被鼠疫菌感染[4]。2019年我国北京市出现2例从内蒙古输入的肺鼠疫病例[5],之后内蒙古又出现2例腺鼠疫患者[6-7],这一事件为我们敲响了警钟,提示我国鼠疫防控形势仍然严峻,防控工作不容松懈[8]。
目前国内外鼠疫的治疗一线方案中仍一致选用链霉素,只是各国在选用的治疗剂量上有所不同而已[9],这与鼠疫菌种属的遗传特征和对抗生素的敏感性不同有关,但链霉素属于氨基糖苷类抗生素,其安全范围窄,不良反应明显,具有一定的耳毒性和肾毒性[10]。近年来陆续有鼠疫耐药菌株的报道,其中马达加斯加报道了一株多重耐药性鼠疫菌,不仅耐链霉素而且对磺胺类药物也出现耐药[11-13]。氟喹诺酮类药物在体外试验中对鼠疫菌显示良好的抗菌活性,在动物实验中也取得了良好效果。目前美国FDA已经批准左氧氟沙星为鼠疫治疗中的主要抗生素[14],但是我国还未确定其为鼠疫患者一线治疗药物或替代治疗药物。本试验旨在观察左氧氟沙星不同注射时间治疗感染鼠疫动物的疗效,从而为是否能将左氧氟沙星作为替代药物纳入我国鼠疫的治疗方案中提供科学依据。
1 材料与方法
1.1 实验动物、菌株、培养基及药物
SPF级豚鼠30只,雌性,体重250~300 g,由辽宁长生生物技术股份有限公司提供。鼠疫菌强毒株141及試验用赫氏培养基(购自北京陆桥股份有限公司)均由青海省地方病预防控制所鼠疫菌专业实验室提供。注射用甲磺酸左氧氟沙星,山东罗欣药业集团有限公司,0.2 g,国药准字H20051882。
1.2 主要仪器
意大利泰尼百斯公司动物负压隔离笼,赛默飞世尔公司Ⅱ级B2型生物安全柜,美国纽埃尔公司换笼工作台。
1.3 实验方法
1.3.1 实验分组
将30只、体重为250~300 g的SPF级雌性豚鼠完全随机地分配至24 h治疗组、48 h治疗组和对照组,每组10只,实验前编号、称重。
1.3.2 实验感染
取强毒鼠疫菌141株37℃ 24 h培养物,比浊稀释为浓度约为1×107 cfu/mL的菌悬液于豚鼠鼠鼷部,采用皮下注射方式感染,染毒剂量为1 mL/只。
1.3.3 治疗
左氧氟沙星用量参照《中国药典》成人剂量,用施新猷等[15-16]动物折算系数法换算豚鼠用药剂量。左氧氟沙星为40 mg/kg/ d,豚鼠给药量=40 mg/(kg·d) ×0.3 kg=12 mg/d,24 h和48 h治疗组均通过皮下注射给药,对照组不治疗。
1.3.4 治愈标准
按常规量用左氧氟沙星治疗感染动物9 d,经医学观察9 d未死亡,处死解剖,各脏器均未分离到鼠疫菌,同时具备上述两项条件判定为豚鼠鼠疫治愈。如治疗期间豚鼠死亡,解剖后取脏器压印培养后如果分离到鼠疫菌则判定为鼠疫治疗无效,动物属特异性死亡。
1.3.5 观察
对实验期间死亡动物解剖后取材做压印鼠疫细菌学培养,并观察其组织脏器病理改变。存活动物于停药后第9天全部处死,解剖取材后进行细菌学检验和组织脏器病理观察。
1.3.6 实验操作
涉及高生物安全风险的实验步骤,例如鼠疫菌培养、动物染毒和解剖培养等均在青海省地方病预防控制所生物安全三级动物实验室进行。
2 结果
2.1 治疗组疗效观察
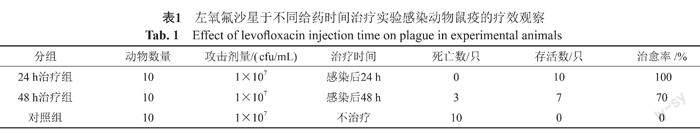
表1结果显示,左氧氟沙星于感染后24 h开始治疗的10只豚鼠全部治愈,治愈率为100%,于感染后48 h开始治疗的10只豚鼠存活7只,治愈率为70%,动物死亡时间为感染后3~7 d。
2.2 对照组的观察
未治疗实验豚鼠于染毒后第3天死亡3只,之后陆续死亡,第6天实验动物全部死亡,解剖后剪取各脏器,用脏器切面压印于培养基培养后均分离到鼠疫菌,属于特异性死亡。
2.3 动物感染鼠疫后的观察
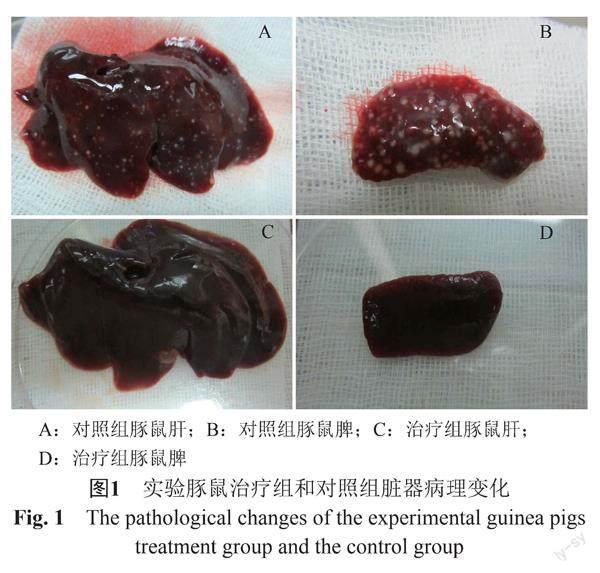
染毒后的对照组动物表现为精神差,食欲不佳,食量骤减,不饮水或饮水较少,身体蜷缩在笼盒角落发抖,毛竖立状,盗汗,行动迟缓或不活动,3~6 d陆续死亡,解剖后肉眼可见皮下有充血,鼠鼷部淋巴结均有肿大,并且与周围组织发生黏连,局部有个别化脓灶。24 h治疗组和48 h治疗组动物染毒后,起初精神萎靡,纳食差,饮水少,活动量减少,随着每日治疗的进行,24 h治疗组实验动物于2 d后开始摄食,其活动量也逐渐增加,纳食转佳、毛逐渐顺滑,恢复正常状态,然而48 h治疗组实验动物则于4~5 d后才开始转愈恢复正常状态。治疗动物停药后观察9 d,各方面状况佳,体重有所增加,对照组豚鼠解剖后,肝脏轻微充血肿大呈紫褐色,表面有点状坏死灶。脾脏明显肿大发生充血,质地硬,表面有点状坏死灶,双肺也充血肿大状态,颜色为暗红色,分别将肝脏、脾脏、肺、心脏、淋巴腺切面压印于培养基进行鼠疫细菌学检验,镜下可见鼠疫菌,鼠疫菌裂解实验阳性,属特异性死亡。治疗组豚鼠解剖后,肝、脾已逐渐恢复正常大小,其他各脏器无明显病理改变,接受治疗的动物死亡后脏器压印培养后均未见鼠疫菌,详见图1。
3 讨论
近些年来鼠疫时有发生,仍威胁着世界各国的公共卫生安全[17],因此未来鼠疫治疗研究方向中应着眼于研究有效安全的治疗药物,制定药物敏感且药物毒副作用小的治疗方案。在我国链霉素仍然为鼠疫治疗首选药物,但在未来的临床治疗中不可避免的出现鼠疫菌耐链霉素状况,这时候则需要果断启用链霉素替代治疗方案。我国鼠疫菌的生物型别更丰富,所以在左氧氟沙星的使用剂量上,国内外治疗方案会有差异,还需进一步进行实验验证。左氧氟沙星为第三代喹诺酮类药物,其药物作用机制是通过抑制细菌DNA的合成从而杀灭细菌。辛有全等体外抗菌活性试验结果表明鼠疫菌对左氧氟沙星是敏感的,左氧氟沙星对我国1010株鼠疫菌的MIC范围为0.03~0.25 μg/mL[18-19],根据CLSI鼠疫耶尔森菌标准(敏感:≤0.25 μg/mL),因CLSI尚无鼠疫耶尔森菌耐药中介及标准,参照一般细菌标准拟定左氧氟沙星的耐药折点(耐受:≥8 μg/mL),但这些试验均为体外实验,其不能完全证明左氧氟沙星的疗效,因此还需要通过动物实验加以验证。
本次实验使用的染毒株141属于鼠疫强毒株,其对豚鼠最小致死量(MLD)为50 cfu/mL[20],本实验攻击剂量为1×107 cfu/mL,是其MLD 2×105倍,左氧氟沙星于感染后24 h接受治疗的实验豚鼠存活率为100%,48 h开始治疗的存活率为70%,虽然48 h治疗组较24 h治疗组存活率低,但仍有大于半数的实验豚鼠存活。这就说明了左氧氟沙星治疗鼠疫疗效显著。因此,我们可以认为左氧氟沙星治疗重症鼠疫是可行的,如果在临床治疗中出现耐链霉素的患者,左氧氟沙星可替代链霉素进行临床治疗,但应遵循早诊断,早治疗的原则,从而提高鼠疫患者的治愈率。任何药物初期使用阶段都是敏感有效的,但是在长期使用过程中可能会不可避免的出现抗药,因此在左氧氟沙星临床治疗过程中,应尽量做到规范用药,并且定期做药物耐药性监测,使之成为一种可持续发展的治疗方案。本研究对我国鼠疫治疗方案的更新具有现实意义,也将进一步提高了我国鼠疫防控工作的防治水平。
参 考 文 献
黎文鸿, 王梦迪, 尹家祥. 自然环境改变对鼠疫发生的影响[J]. 中国热带医学, 2021, 21(10): 1013-1016.DOI:10.13604/j.cnki.46-1064/r.2021.10.20.
Gage K L, Kosoy M Y. Natural history of plague: Perspectives from more than acentury of research[J]. Annu Rev Entomol, 2005, 50: 505-528.
李硕, 张云辉, 王永怡, 等. 2017年全球传染病热点回顾 [J]. 传染病信息, 2018, 31(1): 5-10.
向锁玉, 孙希, 吴忠道. 中国鼠疫的疫情及防治进展[J]. 中国热带医学, 2020, 20(5): 486-490.
内蒙古锡林郭勒盟卫生健康委、北京市朝阳区卫生健康委. 锡林郭勒盟确诊两例鼠疫病例[EB/OL]. (2019-11-13)[2019-11-18]. http : // www.chinacdc.cn/jkzt/crb/jl/sy/gzdt/201911/t20191118_206911.html.
内蒙古自治区卫生健康委员会. 内蒙古自治区四子王旗确诊1例腺鼠疫病例[EB/OL]. (2019-11-28)[2019-12-28].http://www.chinacdc. cn/jkzt/crb/jl/sy/gzdt/201911/t20191128_207187.html.
内蒙古自治区卫生健康委员会. 锡林郭勒盟一患者在化德县被确诊为腺鼠疫自治区采取切实措施加大防控力度 [EB/OL]. (2019-11-17)[2019-11-18].http://www.chinacdc.cn/jkzt/crb/jl/ sy/gzdt/201911/t20191118_206913.html.
苏丽琼, 梁云, 吴鹤松, 等. 云南省1986—2014年人间鼠疫流行病学特征分析[J]. 中国媒介生物学及控制杂志, 2016, 27(4): 386-388.
陈冲, 葛子若, 王琳, 等. 国内外鼠疫抗菌治疗方案辨析及前瞻[J]. 中国药物戒, 2020, 17(1): 1-5, 22.
李海龙, 马英, 郑谊. 鼠疫治疗研究进展[J]. 中国地方病防治杂志, 2009, 24(1): 32-33.
Wong J D, Barash J R, Sandfort R F, et al. Susceptibilities of Yersinia pestis strains to 12 antimicrobial agents[J]. Anti-microb Agents Chemother, 2000, 44(7): 1995-1996.
Galimand M, Guiyoule A, Gerbaud G et al. Multidrug resistance in Yersinia pestis mediated by a transferable plasmid[J]. N Engl J Med, 1997, 337(10): 677-680.
Welch T J, Fricke W F, McDermott P F, et al. Multiple antimicrobial resistance in plague: An emerging public health risk[J]. PLoS one, 2007, 2(3): e309.
佚名. 左氧氟沙星獲批用于治疗鼠疫[J]. 中国食品药品监管, 2012, (6): 5.
秦川, 魏泓. 实验动物学[M]. 北京: 人民卫生出版社, 2010. 298.
施新猷. 医用实验动物学[M]. 陕西: 陕西科学技术出版社, 1989. 421.
WHO. Weekly bulletins on outbreaks and other emergencies[EB/OL].[2018-02-27]. http://apps.who.int/iris/bitstream/10665/259809/1/ OEW1-2018.pdf
辛有全, 何建, 杨晓艳, 等. 左氧氟沙星和莫西沙星对鼠疫耶尔森菌最低抑菌浓度的测定[J]. 现代预防医学, 2020, 47(22): 4148-4150.
CDC. Diagnosis and Treatment[EB/OL]. [2018-11-17].https://www. cdc. gov/ plague/ healthcare/ clinicians. html.
戴瑞霞, 李敏, 杨晓艳, 等. 小白鼠及豚鼠和家兔对鼠疫菌敏感性实验比较[J]. 中国地方病学杂志, 2006, 25(3): 347.
收稿日期:2021-03-05
基金项目:青海省科技厅基础研究计划项目(No. 2019-ZJ-7074);国家卫生健康委鼠疫防治研究重点实验室 (共建)(No. 2019PT310004);
青海省鼠疫防控及研究重点实验室(No. 2021-ZJ-Y15)
作者简介:张琪,女,生于1988年,主管医师,主要从事鼠疫防治及鼠疫菌种鉴定,E-mail: 449132626@qq.com
*通讯作者,E-mail: drx200907@163.com
