肠道定植耐碳青霉烯肠杆菌科细菌(CRE)与感染病原菌关系
2022-05-30杨璐李云轩宋婉红王文倩黄云龙
杨璐?李云轩?宋婉红?王文倩?黄云龙


摘要:目的 以腸道定植碳青霉烯类耐药肠杆菌科细菌(carbapenem resistance Enterobacteriaceae, CRE)与同一患者后期感染细菌的关系为出发点,同源性检测和耐药基因筛查为中心,从重症医学科(intensive care unit, ICU)患者肠道CRE的定植情况、CRE肠道定植与后期感染的关系层次上,进行CRE防治的应用基础研究,从而为临床及时有效的抗感染治疗提供一定指导。方法 收集2018—2019年来自ICU病房及由其他科室转入ICU的共11位患者的临床资料,分别分离同一患者肠道定植CRE菌株和后期其他感染部位的菌株,对所有菌株进行药物敏感性试验和耐药基因携带情况检测,采用多位点序列分析(MLST)、脉冲场凝胶电泳(PAGE)试验的方法对定植CRE菌株和后期其他感染部位的菌株进行同源性分析。结果 95位ICU患者中有19位患者肠道CRE筛查阳性,定植率为20.00%。其中发生后期其他部位感染的患者11位,目标菌株耐碳青霉烯酶基因检测结果显示22株菌株中有21株检出耐药基因,占95.45%(21/22)。其中19株检出KPC-2耐药基因,阳性率为86.36%(19/22);2株检出NDM-1耐药基因,阳性率为9.09%(2/22)。其他碳青霉烯酶基因检测均为阴性。22株目标菌的MLST分型共分为3个型,主要为ST11型,11位患者中除了1位患者的后期感染菌株与定植菌株差异明显外,其余患者的肠道定植菌株与后期感染菌株均为相同的ST型;PAGE检出22株菌的分型可分为A群和B群,共7个型别,其中7位患者的肠道定植菌株与后期感染菌株之间条带位置与数目相同,视为同一克隆型,3位患者的肠道定植菌株与后期感染菌株条带有2~3个差异,同源性极高,视为高度相关菌株;1位患者的肠道定植菌株与后期感染菌株的条带异超过7条,视为不相关菌株。结论 ICU患者定植率高,应加强入院CRE定植筛查;ICU患者部位检出的定植及感染CRE菌株MIC值高,为高耐药性菌株;ICU患者发生CRE感染的菌株与自身定植的菌株有极高的同源性。
关键词:耐碳青霉烯类肠杆菌科;同源性分析;脉冲场凝胶电泳;多位点序列分析
中图分类号:R978.1文献标志码:A
The relationship between carbapenem-resistant Enterobacteriaceae (CRE) colonized in intestinal tract and pathogenic bacteria of infection
Yang Lu, Li Yun-xuan, Song Wan-hong, Wang Wen-qian, and Huang Yun-long
(The Second Affiliated Hospital of Kunming Medical University, Kunming 650000)
Abstract Objective Starting from the relationship between intestinal colonized carbapenem-resistant Enterobacteriaceae (CRE) and later infected bacteria in the same patient, our study focused on homology detection and drug resistant gene screening. From the level of intestinal CRE colonization in Intensive Care Unit (ICU) patients and the relationship between intestinal CRE colonization and late infection, basic applied research on the prevention and treatment of CRE was carried out, so as to provide certain guidance for timely and effective clinical anti-infection treatment. Methods A total of 11 patients in ICU between 2018 and 2019 were retrospectively included. CRE colonized in intestinal tracts of ICU patients and bacterial strains in other sites of later infections were isolated to test the homology, drug sensitivity, and drug-resistant genes using multi locus sequence analysis (MLST) and pulsed field gel electrophoresis (PAGE). Results Positive intestinal CRE was identified in 19/95 (20.00%) ICU patients. Among 19 patients, 11 had later infections of other sites. A total of 22 strains were isolated from the 19 patients. Carbapenem-resistant genes were detected in 21/22(95.45%) strains, including KPC-2-resistant gene detected in 19/22(86.36%) strains and NDM-1 resistant gene detected in 2/22(9.09%) strains. Other carbapenem-resistant genes were negative. According to the MLST typing, 22 target strains were divided into three types, and they mainly belonged to the ST11 type. Among the 11 patients, the intestinal colonization and colonization strains all belonged to the same ST type, except for one patient where obvious difference between the late infection strains and colonization strains was found. According to the PAGE results, 22 strains could be divided into group A and B. There were seven types in group A and group B. Among them, seven strains of colonization in intestinal tracts and late infections in ICU patients with the same number of stripe locations were viewed as the same cloning. Three strains of colonization in intestinal tracts of ICU patients with late infections with two or three different stripe locations, showing an extremely high homology, were treated as highly related strains. The intestinal colonization strains of one patient, which differed from the late infection strains by more than 7 bands, were irrelevant strains. Conclusion The colonization rate of ICU patients is high, and the screening of CRE in admission should be highlighted. The MIC values of colonized and infected CRE strains detected in ICU patients are high, indicating high risk of drug resistance. The strains of CRE infection in ICU patients are highly homologous to the self-colonized strains.
Key words Carbapenem-resistant Enterobacteriaceae; Homology analysis; Pulsed field gel electrophoresis; Multilocus sequence typing
肠杆菌科细菌是院内感染的常见菌,碳青霉烯类抗菌藥物是目前针对革兰阴性杆菌感染治疗最强效的抗生素。耐碳青霉烯类肠杆菌科细菌(carbepenem-resistant Enterobacteriaceae, CRE)尤其是克雷伯菌属的耐药率从2009年低于5%升至2017年大于20%[1-4],常引起下呼吸道、泌尿道、血流感染[5]。因CRE的高致死率以及其给临床用药带来的挑战,其院内预防与控制越来越受到关注[6]。在美国疾病预防控制中心于2015年更新发布的CRE预防与控制指南中,建议对CRE感染的高风险人群进行主动筛查[7]。但我国尚缺乏对主动筛查的必要性和效果观察。为了解临床耐碳青霉烯类肠杆菌科细菌的耐药情况及肠道定植菌与肠道外感染菌株的同源性,此次试验中采用多位点序列分析(MLST)、脉冲场凝胶电泳(PAGE)试验探索同一病人肠道定植CRE菌株与后期肠道外感染部位菌株的同源性,以证实两者关系,帮助临床实现对CRE的预防和控制,减少CRE引起的院内感染。
1 材料和方法
1.1 试验菌株收集
菌株纳入标准:患者入院前未检出CRE感染,转入ICU后48h内采集大便或直肠拭子标本。标本培养后挑取其中肠杆菌科细菌,检测其药敏浓度,根据抗微生物药物敏感性试验执行标准(CLSI M100 29th),若亚胺培南、美罗培南的最低抑菌浓度(MIC)≥4 mg/L,或厄他培南MIC≥2 mg/L则判定为肠道定植CRE菌株。观察这些CRE筛选阳性患者,收集其后期感染部位菌株。肠道定植CRE以“KB”字母开头编号,后期感染部位检出的菌株编以相同的数字编码,仅字母不同以示样本来源区别(B:大便;T:痰;X:血液;Y:引流液;N:尿液)。
1.2 仪器和试剂
法国梅里埃VITEK 2全自动微生物分析仪;K30干式恒温器,XO-1旋涡振荡器,TGL-16B高速离心机,ABI 9700PCR扩增仪。细菌基因组DNA提取试剂盒(购自BioFlux);2×T5 Super PCR Mix试剂(购自北京擎科新业生物技术有限公司);引物合成和目的基因扩增及测序送由昆明擎科生物科技有限公司完成。
1.2.1 PCR扩增管家基因
运用煮沸法提取菌株DNA模板,PCR扩增以下管家基因:gapA、infB、mdh、pgi、phoE、rpoB和tonB。引物序列来源于https://bigsdb.pasteur.fr/klebsiella/primers_used.html。PCR反应体系为50 μL:金牌Mix45 μL,DNA1 μL,上下游引物各2 μL;反应条件为:98°C预变性2 min,98°C变性20 s,退火10 s,72°C,上下游引物各2 μL;98℃预变性2 min,98℃变性20 s,退火10 s,72℃ 5 min,共40个循环。
1.2.2 PCR扩增耐药基因
运用煮沸法提取菌株DNA模板,PCR扩增以下耐药基因:blaKPC、blaIMP、blaIMI、blaGIM、blaVIM、blaSME、blaOXA-48、blaGES、blaNDM和blaSPM。引物序列参照相关文献[29-31]。PCR扩增体系:2×T5 Super PCR Mix 25 μL,上下游引物各1,DNA模板2A,加无菌双蒸水至50。98℃预变性70 s, 98℃变性10 s,退火10 s,72℃ 2 min,共35个循环。
1.3 多位点序列分析(multilocus sequence typing, MLST)
对管家基因完成测序后,将结果在线提交到MLST分析网站,查询相应等位基因号,所有管家基因编号组合(gapA-infB-mdh-pgi-phoE-rpoB-tonB)后查询出菌株的序列型(sequence type,ST)[3]。
1.4 脉冲场凝胶电泳(plused field gel electrophoresis, PFGE)实验
使用含蛋白酶K的细胞裂解液(CLB)对实验菌株进行消化后用内切酶进行酶切,将经孵育的胶块在电泳仪中进行脉冲场电泳后使用核酸染料染色。在读胶仪中成像并识别图像条带,经统一的分子质量标准,进行聚类,构建聚类树。
2 结果
2.1 ICU住院患者肠道CRE菌株定植率
收集2018年1月—2019年1月就诊于昆明医科大学第二附属医院ICU,符合入选标准的患者共95位,在其入院48 h内采集大便或直肠拭子标本进行培养,检出肠杆菌科细菌进行药敏实验,收集其中肠道定植有CRE的菌株19株。ICU住院患者肠道CRE菌株定植率为20.00%。
2.2 ICU住院期间发生CRE感染患者肠道定植菌株与后期感染菌株的耐药情况
2.2.1 ICU住院期间发生CRE感染患者肠道定植菌株与后期感染菌株的药敏试验结果
收集的19株肠道定植CRE菌株对头孢唑啉耐药率均为100.00%,对哌拉西林、阿莫西林/克拉维酸等及氨曲南、环丙沙星、左氧氟沙星和呋喃妥因也存在较高耐药率(≥89.47%);对阿米卡星、庆大霉素以及四环素的耐药率相对较低(分别为78.95%、78.95%、63.16%)。如表1所示。
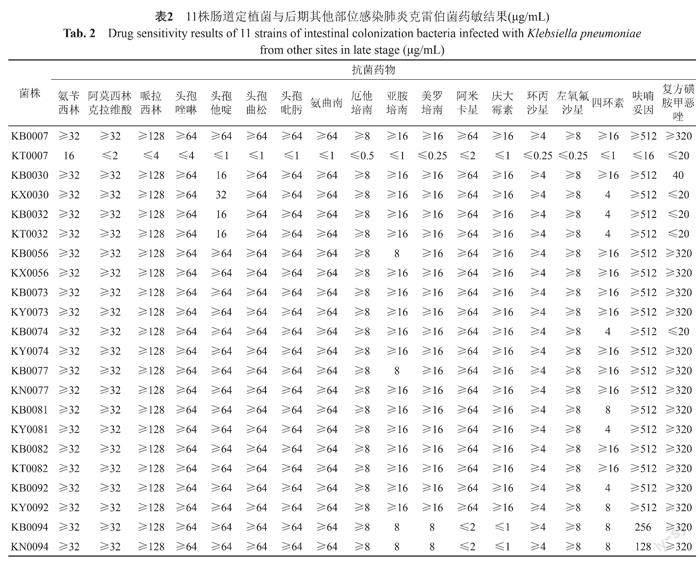
观察收集的19株肠道定植菌株患者信息,其中后期发生其他部位感染者11位,留取这11位患者后期感染部位分离的菌株。筛选出的11株后期其他部位感染的肠杆菌科细菌,对碳青霉烯类抗菌药的耐药率为90.90%,其中KT0007号尿液标本的厄他培南MIC值为≤0.5 μg/ml,亚胺培南和美洛培南的MIC值分别为≤1 μg/ml、≤0.25 μg/ml;对β-内酰胺类药物如阿莫西林/克拉维酸、哌拉西林、等及氨曲南、环丙沙星、左氧氟沙星和呋喃妥因耐药率均为90.90%,对阿米卡星和庆大霉素的耐药率相对较低,均为81.82%;四环素和复方磺胺甲恶唑敏感度相比于其他抗生素更高,分为45.45%和72.73%。如表2所示:
2.2.2 ICU住院期间发生CRE感染患者肠道定植菌株与后期感染菌株的耐药基因检测
经检测碳青霉烯酶基因结果显示,11株肠道定植菌和对应的肠道外感染菌共22株菌均为肺炎克雷伯菌,其中有21株检出耐药基因,占95.45%(21/22)。其中有19株检出KPC-2耐药基因,阳性率为86.36%(19/22);2株检出NDM-1耐药基因,阳性率为9.09%(2/22)。22株目标菌中blaGES、blaIMI、blaSME、blaVIM、blaIMP、blaGIM、blaSPM和blaOXA-48碳青霉烯酶基因检测均为阴性,见表3。
2.3 同源性检测
2.3.1 住院期间发生CRE感染患者肠道定植菌株与后期感染菌株MLST结果
22株住院期间发生CRE感染患者肠道定植菌株及后期感染菌株经16S rDNA鉴定分析结果均为肺炎克雷伯菌。对22株目标菌的7个管家基因(管家基因查询来源https://bigsdb.pasteur.fr/klebsiella/primers_used.html)分别进行测序后,结果提交至MLST网站,结果显示,86.36%的菌株为ST11型(19/22),9.10%的菌株为ST101型(2/22),4.55%为ST2995型(1/22),这与我国流行菌株型别相符合,除KT0007分型为2995型,与KB0007号菌株差异较明显,其余患者肠道定植的CRE菌株与后期感染部位检出的CRE菌株都是相同的ST型,同源性较高。11位患者定植与后期感染部位的菌株MLST查询结果如表4。
2.3.2 住院期間发生CRE感染患者肠道定植菌株与后期感染菌株PAGE试验结果
PFGE图像导入BioNumerics(Version7.1,Applied maths, Inc.)软件包进行处理,识别图像条带,经统一的分子质量标准进行校准,标定条带位置,必要时进行手工校正,<20.5 kb的条带忽略不计。每两个图像之间的相似性系数用Dice系数(Dice coefficients,SD)表示,SD=2nxy/(nx+ny),其中nx是菌株x的总条带数,ny是菌株y的总条带数,nxy是菌株x和菌株y共有的条带数。SD值反映不同菌株PFGE图像之间的相似性程度,范围在0~1之间,0代表完全不一样,1代表完全相同。出现不同条带即判定为不同的型别,对每一个型别都进行命名。根据每两个图像之间的相似性系数,用非加权配对算术平均法进行聚类,构建聚类树。
22株目标菌的DNA图像经BioNumerics软件处理后做出聚类分析图如图1所示,22株菌可分为2个群(A和B群),A群分为A1、A2型,B群分为B1、B2、B3、B4、B5型,A1、B1、B3、B5型分别有密不可分的带型,11例患者中有7例来源于消化道定植的CRE菌株(KB0094、KB0092、KB0073、KB0081、KB0032、KB0030和KB0082)与后期分离的菌株(KN0094、KY0092、KY0073、KT0081、KY0032、KX0030、KT0082)分别为同一克隆菌株;74号患者消化道定植的CRE菌株(KB0074)电泳条带为B2型,其后期引流液中检出的菌株(KY0074)为B3型,差异在4个条带,同源性极高,视为高度相关菌株;56号及77号患者消化道定植的CRE菌株(KB0056和KB0077)与后期感染部位检出的菌株 (KY0056和KN0077)电泳条带为B4型,差异在2~3个条带,同源性极高,视为高度相关菌株;7号患者来源于消化定植的CRE菌株(KB0007)电泳条带为A2型,后期痰液中检出的菌株(KT0007)电泳条带为B4型,两者条带差异超过七条,同源性差异较为明显,视为不相关菌株。
3 讨论
由于临床治疗中对碳青霉烯类抗生素的不合理应用,CRE的检出率逐年提高,耐药菌的种类也趋于多样性[9],本研究收集的肠道定植菌株及后期感染菌株全部被鉴定为肺炎克雷伯菌,与相关报道一致[10]。
CRE最常见的耐药机制是产碳青霉烯酶[11]。本次研究对肠道定植菌株与后期感染菌株的耐药基因进行检测后发现22株肺炎克雷伯菌中有21株检出耐药基因,占95.45%(21/22)。其中以KPC-2耐药基因检出为主。目前发现的碳青霉烯酶包括Ambler A、B、D。Ambler A类为KPC型,KPC是我国肺炎克雷伯菌株产生临床耐药的最主要原因,其具有质粒介导的丝氨酸活性,能水解多种β-内酰胺结构,因同时常与其他耐药基因同时出现,因此对其他非β-内酰胺类药物也具有耐药性[12-13]。Ambler B类又称金属酶,依靠锌离子水解β-内酰胺类抗菌药,常见GIM、IND、IMP、VIM和NDM型[14]。在本研究中发现两株菌株带有NDM-1耐药基因,NDM-1型酶属于B类金属金属β-内酰胺酶,于2009年首先在印度新德里检出[27]。因其能够水解临床上使用的大多数抗生素,表现出超强的耐药性,因此应该高度重视产NDM-1细菌的监测,进而做好院内感染控制的有效措施,避免NDM-1基因的传播。
本次研究发现本院重症医学科患者中的CRE定植率为20.00%。陈美恋等[10]在2017年对北大人民医院ICU调查显示CRE定植率为10.9%。美国芝加哥各综合医院住院患者CRE平均定植率为30%,不同医院CRE定植率处于10%~60%[28]。对22株目标菌进行MLST分型发现本次收集菌株多为ST11型,占比86.36%(19/22)。据相关报道显示,亚洲地区尤其是中国,ST11型为主要流行株[21]。CRE的易感人群主要为长期住院患者,而ICU是CRE感染发生的高风险科室,ICU患者住院时间长,多有免疫力下降或菌群失调,接触到医院内病原体的机会越多。医务人员手卫生状况、医院环境清洁与消毒情况和侵入性操作时的无菌操作不当均容易引起CRE的定植转移从而导致其他部位的感染。
由CRE感染引发的病死率可高达25.20%[25],不同菌属的CRE菌株对常用抗生素耐药率也居高不下,致使CRE实行有效治疗较为棘手,因此,控制耐药菌株的感染及播散成为临床亟待解决的公共健康问题。目前主要通过流行病学的监测达到遏制细菌的目的,本实验通过多位点序列分析、脉冲场凝胶电泳分析进行耐药菌株基因序列分型,了解CRE感染的菌株来源,进一步为临床提供依据采取有效措施控制耐药菌株的自身感染。临床上患者发生CRE的感染并非单一因素所致,也可能是多重因素叠加的结果,与年龄、入住科室、患者免疫能力等息息相关,需在临床医院感染控制中对多因素进行管理。
参 考 文 献
胡付品, 汪复, 朱德妹, 等. 2015年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(6): 685-694.
胡付品, 郭燕, 朱德妹, 等. 2016年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2017, 17(5): 481-491.
胡付品, 郭燕, 朱德妹, 等. 2017年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251.
胡付品, 郭燕, 朱德妹, 等. 2018年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2020, 20(1): 1-10.
徐英春, 肖永红, 卓超, 等. 中国碳青霉烯类耐药肠杆菌科细菌的流行病学和防控策略[J]. 中国执业药师, 2013, 10(4): 3-8.
Abboud C S, De Souza E E, Zandonadi E C, et al. Carbapenem-resistant Enterobacteriaceae on a cardiac surgery intensive care unit: Successful measures for infection control[J]. J Hospital Infect, 2016: 60-64.
Centers for disease control and prevention. Facility guidance for control of carbapenem-resistant Enterobacteriaceae (CRE)2015 update[EB/OL]. [2017-07-29]. https: //www. cdc. gov/hai/pdfs/ cre/cre-guidance-508. pdf.
郑伟, 茅一萍, 周宏, 等. 耐碳青霉烯类肠杆菌科医院感染患者预后的相关影响因素研究[J]. 中华医院感染学杂志, 2018, 28(11): 21-24.
胡付品, 朱德妹, 汪复, 等. 2012年中国CHINET碳青霉烯类耐药肠杆菌科细菌的分布特点和耐药性分析[J]. 中国感染与化疗杂志, 2014, 14(5): 382-386.
陈美恋, 王守军, 匡季秋, 等. 重症监护病区CRE主动筛查及其效果评价[J]. 中华医院感染学杂志, 2017, 27(18): 4123-4126.
李渊婷, 金凤玲. 肠杆菌科细菌对碳青霉烯类药物的耐药机制及臨床治疗进展[J]. 中国感染控制杂志, 2015, 14(9): 644-648.
Jung J H, Song G G, Lee Y H, et al. Serum uric acid levels and hormone therapy type: A retrospective cohort study of postmenopausal women[J]. Menopause, 2017, 25(1): 1.
Andrade J A, Kang H C, Greffin S, et al. Serum uric acid and disorders of glucose metabolism:the role of glycosuria[J]. Braz J Med Biol Res, 2014, 47(10): 917-923.
Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae[J]. Emerg Infect Dis, 2011, 17(10): 1791-1798.
曹敬荣, 沈定霞. 新发现的获得性金属β-内酰胺酶GIM-1和SIM-1[J]. 国外医药(抗生素分册), 2006, 27(3): 139-142.
李继红, 时东彦, 李雅静, 等. 产吲哚金黄杆菌耐药性及其携带MBL-INDuniv研究[J]. 河北医科大学学报, 2011(1): 68-71.
韩仁如, 胡付品. 耐碳青霉烯类肠杆菌科细菌中OXA-48家族碳青霉烯酶分子流行病学研究进展[J]. 中国感染与化疗杂志, 2019, 19(6): 687-690.
A García-Fernández, Miriagou V , Papagiannitsis C C, et al. An ertapenem-resistant extended spectrum-beta-lactamase-producing Klebsiella pneumoniae clone carries a novel OmpK36 porin variant[J]. Antimicrob Agents Chemother, 2010, 54(10): 4178-4184.
黄素玲. 产超广谱β-内酰胺酶大肠埃希菌的分布特点及耐药性分析[J]. 中国感染与化疗杂志, 2017, 17(2): 182-186.
刘永瑞, 张妍, 李秀英. 肺炎克雷伯菌AmpC酶检测及抗生素选择[J]. 医学信息, 2019(19).
Munoz-Price L S, Poirel L, Bonomo R A. clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases[J]. Lancet Infect Dis, 2013, 13(9): 785-796.
杨绍基, 任红. 传染病学[M]. 7版. 北京: 人民卫生出版社, 2008.
李梦东, 王宇明. 实用传染病学[M]. 3版. 北京: 人民卫生出版社, 2004.
李兰娟. 微生态学与医院感染[J]. 浙江预防医学, 2002, 3(12): 1.
杨璐, 李思琪, 李庆蓉, 等. ICU患者耐碳青霉烯类肠杆菌科易感因素及预后影响因素分析[J]. 检验医学与临床, 2020, 17(01): 25-30.
闫云. 替加环素联合美罗培南、磷霉素对耐碳青霉烯类肠杆菌科细菌感染患者的疗效[J]. 河南医学研究, 2019, 28(11): 2004-2006.
Yong D, Toleman M A, Giske C G, et al. (2013).Characterization of a new metallo-beta-lactamase gene, bla(ndm-1), and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India[J]. Antimicrob Agents Ch, 2009, 53(12): 5046-5054.
Otter J A. Whats steending in the infection prevention and control literature? From his 2012 to his 2014, and beyond[J]. J Hosp Infect, 2015, 89(4): 229-236.
胡付品. 碳青霉烯类耐药肠杆菌科细菌的耐药机制及其所致医院感染控制研究[D]. 上海, 复旦大学, 2010.
葛超荣. 肠道产KPC型碳青霉烯酶细菌特性及产生机制研究[D]. 杭州, 浙江大学, 2014.
丁家伟. 耐碳青霉烯类肺炎克雷伯菌分子流行病学及耐药机制研究[D]. 昆明, 昆明医科大学, 2018.
收稿日期:2021-04-06
基金项目:昆明医科大学第二附属医院院内科技计划项目(No. 2018yk015)
作者简介:杨璐,女,生于1988年,主管技师,研究方向为临床微生物学,E-mail: ylcoolly@hotmail.com
*通訊作者, E-mail: carlgout@163.com.
