ε-聚赖氨酸对耐甲氧西林金黄色葡萄球菌USA300的作用机制
2022-05-30刘萌魏莲花林赋桂李可可刘东霞杨雅迪廖蓓关晓雯
刘萌 魏莲花 林赋桂 李可可 刘东霞 杨雅迪 廖蓓 关晓雯


摘要:目的 研究ε-聚賴氨酸(ε-polylysine,ε-PL)对耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)标准菌株USA300的抑菌作用及其机制。方法 依据CLSI微量肉汤稀释法测定最低抑菌浓度(minimum inhibitory concentration, MIC)和最低杀菌浓度(minimum bactericidal concentration, MBC);绘制24 h内不同浓度ε-PL作用后USA300菌株时间-抑菌曲线;SYBR Green I/PI检测ε-PL处理后USA300的生存情况;测定ε-PL处理后菌液电导率、胞外ATP含量、可溶性蛋白含量的变化;利用扫描电镜(scanning electron microscopy,SEM)观察ε-PL对USA300形态的影响。结果 ε-PL对USA300的MIC、MBC分别为5.12和10.24 mg/mL。ε-PL处理后细菌死/活比例,菌液电导率,胞外ATP含量,胞外可溶性蛋白含量均增加,表明菌膜破损;经SEM进一步确证。结论 ε-PL对USA300生长有良好的抑制作用,且与ε-PL浓度呈正相关。ε-PL处理后细胞膜结构破坏、通透性改变,导致细胞内容物大量渗出,其抑菌机制可能与破坏细菌菌体结构有关。
关键词:ε-聚赖氨酸;USA300; 抑菌机制
中国分类号:R978.1文献标志码:A
Antibacterial effect and mechanism of ε-polylysine against methicillin-resistant Staphylococcus aureus USA300
Liu Meng1, Wei Lian-hua2, Lin Fu-gui2, Li Ke-ke2, Liu Dong-xia3, Yang Ya-di3, Liao Bei3, and Guan Xiao-wen4
(1 NingXia Medical University, Yinchuan 750004; 2 Department of Clinical Laboratory, Gansu Provincial Hospital, Lanzhou 730000;
3 Lanzhou University, Lanzhou 730000; 4 Gansu University of Traditional Chinese Medical, Lanzhou 730000)
Abstract Objective To investigate the antibacterial activity and mechanism of ε-polylysine (ε-PL) against methicillin-resistant Staphylococcus aureus (MRSA) standard strain USA300. Methods Microbroth dilution was performed to determine the minimal inhibitory concentration (MIC) and the minimum bactericidal concentration (MBC) of ε-PL according to the CLSI document. The time-inhibition curve of USA300 strain was evaluated after the treatment with ε-PL at different concentrations within 24 h. SYBR Green I/PI was used to detect bacterial survival after ε-PL treatment. The changes of electrical conductivity, extracellular ATP content and soluble protein content were determined after ε-PL treatment. The effect of ε-PL on the morphology of USA300 was observed by scanning electron microscopy (SEM). Results The MIC and MBC of ε-PL to USA300 were 5.12 and 10.24 mg/mL, respectively. The ratio of dead to alive, electric conductivity, extracellular ATP content and extracellular soluble protein content increased after ε-PL treatment,which indicated the rupture of USA300 and further confirmed by SEM. Conclusion ε-PL has a significant inhibitory effect on the growth of USA300, which was positively correlated with the drug concentration. After treatment of ε-PL, the structure of cell membrane was destroyed and the permeability of cell membrane was changed, resulting in a large amount of exudation of cell contents. Its antibacterial mechanism may be related to the destruction of bacterial cell structure.
Key words ε-polylysine; USA300; Antibacterial mechanism
金黄色葡萄球菌(Staphylococcus aureus, S. aureus)是人类和动物化脓感染中最常见的病原菌之一,可引起局部化脓感染,也可引起败血症和脓毒血症等全身感染[1]。作为“ESKAPE”生物之一,S. aureus在世界范围内引发了越来越大的威胁,耐甲氧西林金黄色葡萄球菌(MRSA)是金黄色葡萄球菌引起的主要感染类型之一[2-3]。耐甲氧西林金黄色葡萄球菌的出现限制了抗生素的使用,给病原菌的清除和防治带来巨大的困难和挑战。近年来,国内外学者致力于从天然抗菌肽中寻找抗菌药物,研究表明,多种天然抗菌肽具有良好的抗菌活性。如ε-聚赖氨酸(ε-PL),ε-PL是一种天然的广谱抗菌阳离子多肽,最早从白色链霉菌的发酵液中发现,由25~35个赖氨酸残基通过α-簇基和ε-氨基脱水缩合形成酰胺键连接而成,分子量通常为2.5~4.5 kDa[4]。2003年,美国食品药品监督管理局(Food and Drug Administration, FDA)将其批准为新型天然食品防腐剂,作为安全多肽在食品中使用[5]。ε-PL凭借抗菌谱广、耐热、耐酸碱等优点,对于革兰阴性菌、革兰阳性菌、真菌等具有良好的抑菌效果[6-8],但ε-PL对MRSA的抑制作用及机制尚无基础实验验证。本研究以USA300(MRSA标准菌株)为试验菌株,探究ε-PL对其的抑菌作用及机制。
1 材料
1.1 菌株
USA300菌株由复旦大学仁济医院李敏教授惠赠。
1.2 主要试剂
ε-聚赖氨酸(郑州拜纳佛生物工程股份有限公司),胰蛋白胨大豆培养基、ATP含量检测试剂盒、BCA蛋白浓度测定试剂盒(增强型)、SYBR Green I核酸染料(10000×)、PBS缓冲液、碘化丙啶(PI)均购自索莱宝,氯化钾(KCl)、二甲亚砜、无水乙醇均购自国药集团化学试剂有限公司,盐酸万古霉素、苯唑西林钠、氯仿/三氯甲烷均购自麦克林,2.5%戊二醛(Servicebio)。
1.3 主要仪器设备
酶标分析仪RT-6500(深圳雷杜生命科学股份有限公司),紫外可见分光光度计(北京普析通用仪器有限责任公司),倒置荧光显微镜(Olympus),Scientz-IID超声波细胞粉碎机(宁波新芝生物科技股份有限公司),立式全温振荡培养箱(上海旻泉仪器有限公司),离心机(Eppendrof),便携式电导率仪(青岛路博伟业环保科技有限公司),压力蒸汽灭菌器(山东博科生物产业有限公司),离子溅射仪MC1000(日本Hitachi公司),扫描电镜SU8100(日本Hitachi公司),高速冷冻离心机(美国Thermo Fisher Scientific公司),BSC-1004 ll A2生物安全柜(苏州安泰空气技术有限公司)。
2 方法
2.1 菌株保存及复苏
接种环挑取-80℃冰箱中保存的USA300菌株,接种在TSA固体培养基上,37℃,恒温培养箱培养过夜。挑取单个菌落接種于新鲜的TSB液体培养基中,37℃,180 r/min,培养16 h到稳定期,再次转接于新鲜培养基,37℃,180 r/min,活化3 h培养至对数期,将菌液与灭菌后50%(体积分数)的甘油1:1比例混合后,分装保存在-80℃冰箱中。复苏时将冻存的菌液解冻后以1‰(体积分数)接种于TSB培养基中,37℃,180 r/min,培养16 h,备用。
2.2 MIC和MBC的测定[9]
依据CLSI文件[10]微量肉汤稀释法测定MIC,将复苏后菌液,1‰接种于新鲜培养基,37℃,180 r/min震荡培养至对数期,使用TSB培养基将活化后的菌液稀释至5×106 CFU/mL。在TSB肉汤中制备ε-PL溶液,通过连续倍比稀释获得不同的亚抑菌浓度(0.32~163.84) mg/mL。96孔板每孔中加入菌悬液和ε-PL稀释液孔各100 μL,同时设置生长对照孔(不加ε-PL处理)和空白对照孔(培养基200 μL)。37℃下培养24 h,黑色背景下肉眼观察未见菌落生长的最小药物浓度即为MIC。将MIC实验中MIC不同孔培养混合物涂布在血琼脂平板上,37℃培养24 h后生长菌落数≤5个的最小药物浓度即为MBC[11]。
2.3 ε-PL对USA300生长的影响[12]
将2.1所制备的USA300菌悬液按照2.2的方法处理样本,将不同浓度的ε-PL加入菌悬液中,37℃,180 r/min震荡培养24 h,每隔2 h吸取100 μL液体,加入96孔板中测定其600 nm处的吸光度值并绘制时间-抑菌曲线。每组试验平行重复3次。
2.4 SYBR Green I /PI检测ε-PL作用后不同时间USA300菌株的生存率
按照“2.2”方法处理样本。各取上述菌液1 mL于编号为1~4的无菌EP管中,分别加入ε-PL(终质量浓度为MBC)、万古霉素(终质量浓度为Cmax=25 μg/mL)[13]、苯唑西林(终质量浓度为Cmax=63 μg/mL)[13]、等量无菌水,2~4号分别为阳性对照、阴性对照、空白对照。37℃,180 r/min震荡培养7 d。分别在3、5和7 d从相应的EP管中吸取100 μL,5000 r/min,离心5 min,弃上清液。PBS(pH 7.4)洗涤2次,等体积PBS重悬混匀。金黄色葡萄球菌的染色染料是通过SYBR Green I与PI (1:3)在100 μL蒸馏水中混合制成的[14]。将SYBR Green I/ PI 染色混合物(10 μL)添加到每100 μL的每个样品中。将样品涡旋混匀,室温条件,黑暗孵育30 min。载玻片上滴加6~7 μL样品,荧光显微镜下观察并随机选取视野拍摄图像。
2.5 电导率测定[15]
按照2.2的方法处理样本。将稀释的细菌悬液分成5个烧瓶,向每个烧瓶中加入不同浓度的ε-PL:1/4 MIC、1/2 MIC 、1×MIC、2×MIC,设置空白对照组(不加ε-PL处理)。37℃振荡培养24 h,每隔4 h分别吸取5 mL培养液,5000 r/min 离心10 min,取上清液并用电导率仪(测定前经KCI校准)测定其电导率。 每组试验平行重复3次。
2.6 胞外ATP测定[16]
按照“2.2”的方法处理样本。将稀释的细菌悬液分成3个试管,分别加入不同浓度的ε-PL:0、1×MIC、2×MIC,分别在4、8和16 h取样。实验具体操作按照ATP含量检测试剂盒说明书所述步骤进行。每组试验平行重复3次。
2.7 胞外可溶性蛋白含量测定[17]
按照“2.2”方法处理样本。将稀释的细菌悬液分成3个试管,分别加入不同浓度的ε-PL:0、1×MIC、2×MIC。分别在4、8和16 h取样,5000 r/min离心10 min,PBS洗涤3次并重悬,将重悬后的菌体进行低温超声破碎(功率200 W,超声2 s,停1 s,3 min)后,5000 r/min离心10 min,取上清液,按照BCA蛋白浓度测定试剂盒(增强型)说明书介绍的实验步骤测定样品的蛋白浓度,根据蛋白浓度标准曲线及加样体积计算其含量。
2.8 扫描电镜观察ε-PL处理对USA300形态结构的影响[18]
按照“2.2”方法处理样本。3000 r/min,离心10 min,用PBS(pH 7.4)洗涤3次,弃上清液,加入ε-PL(终质量浓度为10.24 mg/mL),设置空白对照组(未加ε-PL处理)。37℃处理12 h,以5000 r/min离心5 min,PBS洗涤3次,除净上清液,4℃条件下使用2.5%戊二醛固定12 h。2500 r/min离心4 min,0.1 mol/LPBS清洗10 min,此步骤重复3次。依次使用50%、60%、70%、80%、90%和100%浓度的乙醇对细胞进行脱水,最后用叔丁醇替代乙醇。将样品固定、风干,于离子溅射仪中喷金。扫描电镜观察并随机选取视野拍照。
2.9 数据处理
所有试验均平行重复3次,实验数据用IBM SPSS Statistics 26软件进行统计学分析,当P<0.05时具有统计学意义,使用GrandPad Prism软件进行绘图。
3 结果与分析
3.1 最小抑菌浓度(MIC)、最低杀菌浓度(MBC)
由表1可知,ε-PL对USA300的MIC为5.12 mg/mL。
从肉眼可见清晰的微孔中移取菌悬液的涂布结果(表2)可知,ε-PL对USA300的MBC为10.24 mg/mL。
3.2 ε-PL对USA300对生长的影响
由图1知,空白对照组细菌生长呈典型的“S”型生长,1/4 MIC ε-PL(P<0.05)、1/2 MIC ε-PL(P<0.001)、MIC ε-PL(P<0.0001)組细菌A值增长的幅度较空白对照组明显减少,2×MIC ε-PL组细菌的吸光度值几乎没有变化(P<0.0001)。
3.3 SYBR Green I /PI检测 ε-PL作用后不同时间USA300菌株的生存率
SYBR Green I /PI检测可以评估各种细菌病原体的生存能力。SYBR Green I是一种渗透性染料,可将所有活细胞染成绿色,而PI是一种非渗透性染料,仅将死亡或细胞膜受损的细胞染成红色[14]。因此,易于通过荧光显微镜的绿色/红色荧光比率代表细菌种群的生存能力。由图2可知,对照组(图2A、图2E、图2I)USA300菌体细胞完全存活;阳性对照组(图2B、图2F和图2J)随培养时间的延长,USA300的生存率逐渐下降,培养至第5天时(图2F),镜下红色荧光比率增加,大部分菌体死亡,部分菌体裂解,培养至第7天时(图2J),镜下红色荧光少数可见,几乎全部菌体裂解、死亡;阴性对照组初期(图2C)对USA300有一部分杀菌作用,培养至第5天以后(图2G和图2K)几乎完全耐药,USA300菌体细胞基本存活;ε-PL处理后(图2D、图2H和图2L)USA300的生存率随处理时间的延长生存率逐渐下降。
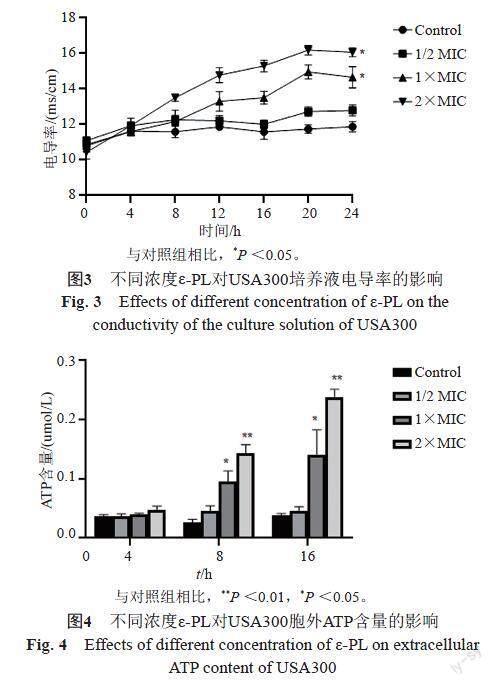
3.4 ε-PL对USA300菌液电导率的影响
由图3结果可知,药物浓度为MIC和2×MIC组的电导率相对于对照组,有显著性差异(P <0.05)。
3.5 ε-PL对USA300胞外ATP的影响
由图4知,ε-PL处理初期,对照组和细菌组的ATP含量无明显差别(P>0.05),当药物作用8 h之后,与对照组相比,药物组胞外可溶性蛋白含量增加(P<0.05)。
3.6 ε-PL对USA300胞外可溶性蛋白含量的影响
根据蛋白浓度标准曲线(y=1.8091x+0.0558,R2=0.9906)以及加样量,计算得出各时间点对照组与1×MIC及2×MIC药物组USA300可溶性蛋白的含量,见表3和图5。当药物作用8 h之后,与对照组相比,药物组胞外可溶性蛋白含量有显著性差异(P<0.05)。
3.7 ε-PL对USA300菌体细胞形态的影响
扫描电镜可以对经ε-PL处理后的USA300菌体细胞进行更直观的形态观察。由图可知,空白对照组(图6A)USA300菌体细胞表面光滑、形态饱满且呈典型葡萄状紧密排列、大小均一,细胞膜完整,无表面损伤。实验组(图6B)菌体形态结构遭到破坏,菌体皱缩变形,表面粗糙。由此可见,ε-PL可以破坏USA300菌体形态结构。
4 讨论
近年来研究报道的抗菌药物,对其作用机理的研究多集中在药物对菌体细胞结构及代谢过程的影响上。包括破坏细胞壁的结构、改变细菌细胞膜的通透性、影响能量代谢、干扰蛋白质合成的表达及核酸合成过程等。MRSA除对甲氧西林耐药外,对其他所有与甲氧西林相同结构的β-内酰胺类和头孢类抗生素均耐药,MRSA还可通过改变抗生素作用靶位,产生修饰酶,降低膜通透性等不同机制[19]。
ε-PL具有较高的亲水性、无毒性和可降解等特点,且具有广泛抗菌活性。前期研究结果表明,ε-PL对金黄色葡萄球菌有一定的抑菌作用,因此推测其对MRSA也可能有一定抑菌效果[20-21]。本研究首先通过微量肉汤稀释法测定了USA300的MIC值,ε-PL浓度为5.12 mg/mL时,黑色背景下,肉眼可见菌悬液清晰,而2.56 mg/mL ε-PL菌液浑浊,有细菌生长;试验结果表明5.12 mg/mL ε-PL可以抑制USA300的生长。菌悬液涂布法试验结果发现10.24 mg/mL ε-PL对USA300有一定的杀菌抑制作用,因此可以確定其MIC和MBC值分别为5.12和10.24 mg/mL 。为进一步分析ε-PL对USA300的抑菌活性,绘制了不同浓度下ε-PL的生长曲线,由生长曲线得出不同浓度的ε-PL对USA 300的生长表现出不同程度的抑制作用,即呈浓度依赖性。空白对照组细菌生长呈典型的“S”型生长,说明细菌生长状况良好。2×MIC ε-PL组细菌其A600值几乎没有变化,表示ε-PL完全抑制了USA300的生长。因此,从研究结果可以得出ε-PL可以有效减慢甚至完全抑制USA300的生长的结论。此外,SYBR Green I /PI检测试验表明ε-PL对USA300的生存率有影响,对其菌体细胞有部分杀伤作用,但作用效果弱于万古霉素处理效果。
细菌质膜为小离子如Na+和K+等的通过提供了渗透性屏障,电解质渗漏,电导率增加,表明渗透屏障的破坏。此外,维持离子稳态是维持能量状态、溶质转运、代谢调节、控制细胞运动等的组成部分,即使膜结构相对较小的变化也会有害地影响细胞代谢并导致细菌死亡[22]。不同浓度的ε-PL处理后对细菌细胞膜的完整性有不同程度的影响,随着处理时间的延长和ε-PL浓度的增加,菌悬液的电导率不断增加,说明细菌细胞膜的通透性会相应增加,导致电解质的渗漏,从而导致细胞死亡。
蛋白质是有机体生命活动的物质基础,本研究通过检测USA300可溶性蛋白含量的变化,发现ε-PL可以抑制USA300可溶性蛋白的表达,蛋白质作为生命活动的主要承担者,其合成量的降低对菌体细胞的生理生化功能将产生严重的影响。这些结果表明ε-PL能够对细胞质膜造成不可逆的损伤,并通过破坏细胞膜而降低细胞可溶性蛋白的含量,蛋白质是微生物细胞的大分子,是微生物细胞的关键结构成分,在暴露于大气中后,蛋白质从微生物细胞中释放出来。由于细胞质膜的不可逆损伤,蛋白质从处理过的细菌中迅速损失,从而导致菌体细胞死亡。同时,葡萄糖作为金黄色葡萄球菌最常见的能量代谢底物,在无氧条件下,经糖酵解过程释放少量ATP。ATP的代谢水平间接反映了有机体生命活动的状态。当细菌在遭受到药物作用时,通常会使其生物膜破损或流动性降低,从而导致细胞内容物溢出。ε-PL处理初期,推测可能是细菌本身对药物有一定的适应期,因此细菌本身细胞壁和细胞膜的组成和结构特性等对药物表现出一定的耐受性;ε-PL作用8 h以后,药物组(1×MIC及2×MIC)ATP胞外含量增加,说明ε-PL可以改变细胞膜的通透性,从而增加胞外ATP含量,证实了其对USA300细胞膜的破坏作用。经扫描电镜观察,进一步验证了ε-PL对USA300的作用。
综上所述,ε-PL对USA300抑菌机制可能与破坏细菌菌体结构有关,其他抑菌机制还需要进一步研究。
参 考 文 献
[1]Tong S, Davis J S, Eichenberger E, et al. Staphylococcus aureus infections: Epidemiology, pathophysiology, clinical manifestations, and management[J]. Clin Microbiol Rev, 2015, 28(3): 603-661.
[2]Savoldi A, Azzini A M, Baur D, et al. Is there still a role for vancomycin in skin and soft-tissue infections?[J]. Curr Opin Infect Dis, 2018, 31(2): 120-130.
[3]Li Q Q, Kang O H, Kwon D Y. Study on demethoxycurcumin as a promising approach to reverse methicillin-resistance of Staphylococcus aureus[J]. Inter J Mole Sci, 2021, 22(7): 3778-3795.
[4]Jia S, Liu Y, Zhuang S, et al. Effect of ε-polylysine and ice storage on microbiota composition and quality of Pacific white shrimp (Litopenaeus vannamei) stored at 0℃[J]. Food Microbiol, 2019, 83(OCT.): 27-35.
[5]Jiang X, Radko Y, Gren T, et al. Distribution of ε-poly-L-lysine synthetases in coryneform bacteria isolated from cheese and human skin[J]. Appl Envir Microbiol, 2021; 87(10): e01841-20.
[6]Abbott I J, Jenney A W, Jeremiah C J, et al. Reduced in vitro activity of ceftaroline by E-test among clonal complex 239 methicillin-resistant Staphylococcus aureus clinical strains from Australia[J]. Antimicrob Agents Chemother, 2015, 59(12): 78-83.
[7]时文静, 余甜, 李可可, 等. ε-聚赖氨酸对鲍曼不动杆菌生长及生物膜形成的影响[J]. 中国抗生素杂志, 2020, 45(1): 73-77.
[8]余甜, 时文静, 谢跃, 等. ε-聚赖氨酸对白念珠菌抑菌活性及机制研究[J]. 中国抗生素杂志, 2019, 44(5): 606-612.
[9]袁中伟, 陈志英, 甘盈盈, 等. 百里香酚对耐甲氧西林金黄色葡萄球菌的抑菌作用机制[J]. 华南农业大学学报, 2018, 39(6): 18-23.
[10]National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved standard[S]. NCCLS document M27-A. Wayne, Pennsylvania: NCCLS, 2008, 28(14): 1-25.
[11]徐婷婷. 皮寒药对金黃色葡萄球菌的抑制作用及其抑菌机制研究[D]. 重庆; 西南大学, 2017.
[12]徐令清, 莫艳梅, 简永欢, 等. 大黄及单体对金黄色葡萄球菌的体外抑菌作用及作用机制研究[J]. 国际检验医学杂志, 2021, 42(16): 1929-1934.
[13]Barcia-Macay M, Seral C, Mingeot-Leclercq M P, et al. Pharmacodynamic evaluation of the intracellular activities of antibiotics against Staphylococcus aureus in a model of THP-1 macrophages[J]. Antimicrob Agents Chemother, 2006, 50(3): 841-851.
[14]Feng J, Wang T, Zhang S, et al. An optimized SYBR green I/PI assay for rapid viability assessment and antibiotic susceptibility testing for Borrelia burgdorferi[J]. Plos One, 2014, 9(11): e111809.
[15]甘盈盈, 袁中伟, 张天翼, 等. 香芹酚对耐甲氧西林金黄色葡萄球菌(USA300)抑菌机制的研究[J]. 四川农业大学学报, 2019, 37(2): 276-282.
[16]李妍, 松长青, 周本宏. 安石榴苷的抗菌活性筛选及对金黄色葡萄球菌的作用机制研究[J]. 中国药师, 2020, 23(8): 1492-1497.
[17]谷可欣, 张天翼, 何泾正, 等. 檀香醇对耐甲氧西林金黄色葡萄球菌USA300的抑制作用[J]. 湖南农业大学学报(自然科学版), 2020, 46(5): 594-600.
[18]纪翠芳, 李欢, 曾玉虹, 等. 串钱柳间苯三酚衍生物抗耐甲氧西林金黄色葡萄球菌活性研究[J]. 广东药科大学学报, 2021, 37(2): 85-89.
[19]Salge T O, Vera A, Anions D, et al. Fighting MRSA infections in hospital care: How organizational factors matter[J]. Health Services Research, 2017, 52(3): 959-983.
[20]陈晓青. 金黄色葡萄球菌耐药性及ε-PL对其生物膜形成的影响[D]. 兰州: 甘肃中医药大学, 2018.
[21]景双艳. 金黄色葡萄球菌生物膜中持留菌形成机制研究[D]. 兰州: 甘肃中医药大学, 2020.
[22]Li X C, He C F, Song L Y, et al. Antimicrobial activity and mechanism of Larch bark procyanidins against Staphylococcus aureus[J]. Acta Biochimica et Biophysica Sinica, 2017, 49(12): 1058-1066.
